요약목적울금(Curcuma longa L.)은 항산화, 항암, 그리고 항염 등 다양한 생리활성이 보고되어 있지만, 미용관련 기능성 평가는 상대적으로 미비한 실정으로, 본 연구에서는 국내 진도산 울금 추출물(Curcuma longa L. extracts, CLE)의 항산화 및 3T3-L1에서의 항비만 활성 평가를 통해 미용기능식품 소재로서의 가능성에 대해 알아보고자 하였다.
방법CLE의 항산화 활성은 2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거능을 통하여 평가하였으며, 세포독성은 thiazolyl blue tetrazolium bromide (MTT) assay를 이용하였다. 또한 CLE의 지방 축적 억제활성은 3T3-L1를 day –2에서 day 6까지 총 8일 동안 분화시키면서 CLE를 처리하고 Oil Red O (ORO) 염색법을 통해 정량분석 하였다. 또한 현미경 관찰 및 이미지 분석을 통해 지방구의 수 및 크기의 변화를 정성분석 하였다. CLE가 3T3-L1 세포의 지방세포분화에 관여하는 전사인자들의 mRNA 발현수준은 reverse transcription-polymerase chain reaction (RT-PCR)을 통해 분석하였다.
AbstractPurpose
Curcuma longa L. (CL) has been widely used as a medicinal herb and spice. Although several biological effects, such as anti-oxidant and anti-inflammatory effects, of CL have been reported, its anti-adipogenic effects as a nutri-cosmetic material are relatively unclear. This study aimed to evaluate the anti-oxidant and anti-adipogenic effects of CL extracts (CLE) in 3T3-L1 adipocytes.
MethodsThe 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical-scavenging activity of CLE was tested. Cell viability was evaluated by a thiazolyl blue tetrazolium bromide (MTT) assay. The anti-adipogenic effects of CLE were estimated using Oil Red O (ORO) staining in 3T3-L1 adipocytes. In addition, number and size of lipid droplets were determined by photomicrograph analysis. The mRNA expression levels of adipogenic transcriptional factors in CLE-treated 3T3-L1 adipocytes were analyzed by reverse transcription-polymerase chain reaction (RT-PCR).
ResultsUp to 10 mg/mL concentration of CLE effectively scavenged DPPH radicals. Treatment with up to 800 μg/mL concentration of CLE for 24 h did not affect 3T3-L1 adipocytes viability. Thus, we chose up to 800 μg/mL CLE for further experiments. Treatment with CLE significantly inhibited lipid accumulation, and decreased number and size of lipid droplets in 3T3-L1 adipocytes. In addition, down-regulated CCAAT/enhancer binding protein β (CEBPB), peroxisome proliferator activated receptor γ (PPARG), CCAAT/enhancer binding protein α (CEBPA), fatty acid synthase (FASN), and lipoprotein lipase (LPL) expression levels were observed in CLE treated 3T3-L1 cell.
中文摘要目的 姜黄(Curcuma longa L.)被报道具有抗氧化,抗癌以及抗炎等多种生理活性,但美容相关功能性评价的研究相对很少。因此探讨韩国国产姜黄提取物(Curcuma longa L. extracts, CLE)的抗氧化以及在3T3-L1细胞的抗肥胖活性, 调查其作为美容功能性食品原料的应用可行性。
方法 CLE的抗氧化活性, 利用2,2-diphenyl-1-picrylhydrazyl(DPPH)自由基消除能力来检测, 利用thiazolyl blue tetrazolium bromide(MTT)assay法来检测细胞毒性。为检测CLE的脂肪堆积抑制活性, 将3T3-L1细胞从day –2到day 6总共分化8日并用CLE处理, 利用Oil Red O(ORO)染色法定量分析。此外, 通过显微镜观察以及图像分析, 定性分析脂肪球的数量和大小变化。利用 reverse transcription-polymerase chain reaction(RT-PCR)法检测CLE对3T3-L1细胞中与脂肪细胞分化相关的转录因子mRNA表达水平。
Introduction비만은 에너지 섭취와 소비간의 불균형으로 인해 체지방이 과잉 축적되어있는 상태를 일컫는다(Chua & Leibel, 1997). 비만은 정신적, 유전적, 그리고 내분비계 장애 등을 비롯한 다양한 원인들로 인해 발생하는 것으로 알려져 있으며, 그 중 체내의 산화적 스트레스(oxidative stress) 또한 비만, 당뇨, 그리고 암 등을 비롯한 만성질환의 주요한 원인으로 알려져 있다.
비만의 다양한 요인 중 하나로 보고되는 산화적 스트레스는 비만 외에도 인슐린 저항성, 그리고 고혈압 등 여러 만성질환과 밀접하게 관련되어 있다(Salla et al., 2016). 체내의 에너지 생산 과정에 있어 활성산소(reactive oxygen species)의 발생은 필수불가결한 요소이다. 활성산소의 정상적인 생산은 정상세포의 성장, 증식 및 분화 등에 긍정적으로 관여하지만, 이 활성산소의 농도가 과도하게 증가하게 되면 체내의 항산화 방어 시스템이 무너지게 되고 이는 체내 산화적 스트레스를 유발하게 된다(Evans et al., 2002). 고지방과 고콜레스테롤 상태에서 산화적 스트레스는 더욱 촉진되는데, 이때 체내 항산화 시스템이 충분히 활성화 되지 못하면 자유라디칼을 제거하는 항산화 방어기전의 불균형을 초래하게 되고, 심혈관계 질환이 유발된다(Jakoby, 1978). 따라서, 항비만 천연물 소재의 탐색에 있어 항산화 활성을 검증하는 것은 중요한 부분 중 하나로 판단된다.
비만의 직접적인 원인은 비정상적인 지방세포의 숫자 및 크기의 증가로 보고되고 있으며, 지방세포는 지방조직에서 분비되는 생체조절물질인 아디포카인(adipokine)의 생산과 분비를 통해 비만 및 관련 대사질환 발병을 야기한다고 알려져 있다(de Ferranti & Mozaffarian, 2008; Holst & Grimaldi, 2002). 지방세포의 숫자 및 크기는 전지방세포의 지방세포로의 분화과정(adipogenesis)에 의하여 증가되어 체내에 축적된다. 이러한 adipogenesis의 기전을 조절하는 것이 항비만의 효과적인 치료법이라고 알려져 있다(Cao et al., 1991). Adipogenesis 관련 실험에는 in vitro cell model system 중 mouse embryo로부터 유래된 3T3-L1 지방전구세포를 주로 사용한다. Adipogenesis는 지방세포형성 과정 중에 단백질 및 유전자 발현, 호르몬 민감성 등의 여러 인자에 작용을 받게 된다(Koutnikova & Auwerx, 2001; Rosen & Spiegelman, 2000). 지방분화과정유도에 필수적인 여러 전사인자들은 발현되는 양과 시기, 전사인자간의 상호조절 등을 통하여 제어가 된다. 분화과정에서의 유전자 발현에는 초기분화에 관여하는 CCAAT/enhancer binding proteins (CEBP)에 속한 CEBPB와 CCAAT/enhancer binding protein δ (CEBPD), 분화중기에 조절되는 PPARG와 CEBPA를 중심으로 세포분열유도 물질과 함께 분화가 시작된다(Chen et al., 2005; Zhang et al., 2004). Adipogenesis의 핵심조절인자로 알려진 PPARG와 CEBPA는 상호작용을 하여 상승효과를 불러일으켜 adipogenesis의 후기 전사인자의 발현을 증가시킨다(Morrison & Farmer, 2000; Rosen & MacDougald, 2006).
이러한 연구결과들을 바탕으로 최근 합성 항산화제를 대체할 수 있는 천연 항산화제와, 전지방세포로부터 지방세포로 분화되는 과정을 억제하여 비만을 예방하고자 천연유래 소재에 대한 다양한 연구가 진행되고 있다(Choi et al., 2012; Lee et al., 2012a).
울금(Curcuma longa L.)은 생강과에 속하며 인도, 중국, 미얀마 그리고 우리나라 진도군에서 재배되고 있다. 울금은 덩이뿌리 또는 주피를 제거한 형태로 찌거나 말려 사용하며, 현재 한약재, 식품의 향신료, 음료, 그리고 차 등으로 식품산업에서 다양하게 활용되고 있다(Jelodar et al., 2005). 울금의 주요한 생리활성 성분은 커큐민(curcumin), 데메톡시커큐민(demethoxycurcumin), 그리고 비스데메톡시커큐민(bisdemethoxycurcumin)으로 알려져 있으며(Lee et al., 2012b), 이들을 이용한 항산화(Barry et al., 2009), 항암(Mudduluru et al., 2011), 그리고 항비만 활성(Kim et al., 2013a) 등이 보고되었다. 그러나, 앞선 연구들에서 강황(Curcuma aromatica)과 울금이 혼용되거나, 대부분이 동남아시아 지역 유래의 울금을 활용한 것으로 조사되어 국내산 울금에 대한 생리활성 평가가 요구된다.
따라서 본 연구에서는 DPPH 라디칼 소거를 통한 울금 추출물(CLE)의 항산화 활성을 평가하고, 더불어 3T3-L1 세포에서 CLE가 지방세포분화과정에서 지방 축적에 어떻게 작용을 하는지 알아보고자 하였다. 또한 CLE 처리가 adipogenesis 과정에 관여하는 유전자 및 전사인자들의 특이적 발현에 어떻게 영향을 미치는지 알아봄으로써, 국내산 울금의 화장품 및 미용식품 소재로서의 가능성을 평가하였다.
Methods1. 실험재료본 실험에 사용된 국내 진도산 CLE는 ㈜삼진내추럴(Korea)에서 구입하여 사용하였다. CLE의 제조는 1 kg의 울금을 증류수 10 L에 희석하여 100±5℃에서 가열 및 추출한 후, 1차 매쉬망 및 2차 필터를 통해 여과하였으며 최종 65 brix에 농축을 종료하여 제조되었다. MTT, ORO, 3-isobutyl-1-methylxanthine (IBMX), insulin, vitamin C (L-ascorbic acid), dexamethasone (DEX)은 Sigma-Aldrich (USA)에서 구매하여 사용하였다. Dulbecco’s modified Eagle’s medium (DMEM), antibiotics (penicillin-streptomycin mixture), bovine calf serum (BCS), fetal bovine serum (FBS)는 Welgene (Korea)에서 구입하여 사용하였으며, ORO staining에 사용된 dimethyl sulfoxide (DMSO), 2-propanol은 Junsei Chemical (Japan)에서 구입하였다. Formaldehyde는 Bio Basic (USA)에서 구입하였으며, RT-PCR 분석에 사용한 TRIzolⓇ은 Invitrogen™, Thermo Fisher Scientific (USA), AccuPowerⓇ CycleScript RT PreMix는 Bioneer (Korea)에서 구매하여 사용하였다. 본 실험에서 사용된 3T3-L1 전지방세포는 한국세포주은행(Korea)에서 분양 받아 사용하였다.
2. DPPH 라디칼 소거활성CLE의 항산화 활성은 DPPH 라디칼 소거활성을 이용하여 평가하였다. DPPH 라디칼 소거능은 Chen et al. (1998)의 방법을 일부 변형하여 실험을 진행하였다. 190 μL의 DPPH (190 μM)에 농도별 CLE를 10 μL를 가하여 37℃ incubator에서 30 min 동안 반응시킨 후, microplate reader (VersaMax; Molecular Devices, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. 본 실험에서는 수용성 항산화제인 vitamin C를 양성 대조군으로 사용하였다. CLE를 처리하지 않은 DPPH를 대조군으로 하여 CLE의 DPPH 라디칼 소거활성을 계산하였다.
3. 3T3-L1 세포에서 CLE의 세포독성 평가CLE의 항비만 활성을 평가하기 전, 3T3-L1세포에 미치는 CLE의 세포독성을 알아보고자 MTT assay를 실시하였다. 100% 포화상태(confluent)가 된 3T3-L1의 세포에 CLE를 10, 50, 100, 200, 400, 800 μg/mL의 농도로 24 h 동안 처리한 후, 배지를 완전히 제거하고 BCS-DMEM에 희석한 MTT 시약 200 μg/mL을 처리하여 37℃ CO2 incubator에서 1 h 동안 배양하였으며, 반응 후 배지를 완전히 제거하고 300 μL의 DMSO를 이용하여 각 세포의 보라색 formazan을 녹여주었다. DMSO에 녹인 formazan을 96-well plate에 100 μL씩 분주하여 microplate reader를 이용하여 570 nm에서 흡광도를 측정하였다. CLE를 처리하지 않은 3T3-L1 전지방세포를 대조군으로 하여 CLE의 세포독성을 분석하였다.
4. 3T3-L1 세포배양 및 지방세포 분화3T3-L1 전지방세포는 10% (v/v) BCS와 1% (v/v) penicillin-streptomycin을 첨가한 DMEM에서 100% 포화상태가 될 때까지 37℃ CO2 incubator에서 배양하였다. 3T3-L1의 지방세포 분화 및 CLE 처리는 Figure 1과 같이 진행하였다. 본 실험에서는 3T3-L1 전지방세포가 100% 포화상태가 되었을 때를 day -2로 표기하였다. 지방세포 분화유도 배지로는 10% (v/v) FBS와 1% (v/v) penicillin-streptomycin을 첨가한 DMEM에 500 μM IBMX, 5.2 μM DEX, 167 nM insulin을 포함한 differentiation media (DM)을 이용하여 day 0부터 day 2까지 48 h 동안 처리하였고, 분화유도 후 post-differentiation media (Post-DM)은 10% (v/v) FBS와 1% (v/v) penicillin-streptomycin이 첨가된 DMEM에 167 nM insulin만을 첨가하여 day 2부터 day 4까지 처리하였다. Day 4부터 day 6까지는 10% (v/v) FBS와 1% (v/v) penicillin-streptomycin이 첨가된 DMEM으로만 48 h 동안 처리하였고, day 6에 지방세포 분화를 종료하였다.
5. Adipogenesis 억제활성 평가CLE의 항비만 활성을 평가하고자, 3T3-L1 전지방세포를 지방세포로 분화시키고 CLE의 adipogenesis 억제활성은 ORO 염색법을 이용하여 평가하였다. 3T3-L1 세포를 지방세포로 분화시키면서 CLE를 50, 100, 200, 400, 800 μg/mL의 농도로 지방세포 분화과정 동안 전 기간 처리하고, day 6에 ORO 염색을 실시하였다. 실온에서 배지를 모두 제거하고 phosphate buffered saline (PBS; pH 7.4)으로 세척 후, 3.7% (v/v) formaldehyde를 0.5 mL씩 첨가하여 분화종료한 3T3-L1 지방세포를 30 min 동안 고정시켰다. Formaldehyde를 제거하고 흐르는 물에 3번 세척 후 3 mg/mL 농도의 ORO 시약으로 shaker (D500; LaboGene, Korea)를 이용하여 15 min 동안 염색하였다. 현미경을 통하여 CLE 처리가 지방세포의 지방구 수와 크기에 영향을 미치는지 이미지 분석하였으며, 세포 내에 축적된 지방에 염색된 ORO는 DMSO를 300 μL씩 넣어 용해시킨 후 96-well plate에 100 μL/well씩 분주하여 510 nm에서 microplate reader를 이용하여 흡광도를 측정하였다. CLE를 처리하지 않은 지방세포(day 6)를 대조군으로 하여 지방 축적량을 계산하였다.
6. RT-PCR을 통한 유전자 발현 분석3T3-L1 세포를 adipogenesis 억제활성 평가방법과 동일하게 지방세포로 분화시키면서, CLE의 농도는 10, 100, 200, 400 μg/mL까지 지방세포분화 전 기간 동안 처리하였다. 총 RNA를 day 6에 TRIzolⓇ을 이용하여 추출한 후, chloroform을 100 μL씩 첨가하여 15 s 동안 잘 혼합하였다. Centrifuge (1580R; LaboGene)를 이용하여 17,000 rpm, 20 min의 조건에서 원심 분리하여 상층액을 얻은 후, 상층액에 250 μL 2-propanol을 첨가하고 17,000 rpm에서 15 min 동안 재 원심 분리하여 mRNA를 분리하였다. 분리한 mRNA는 RNase-free water로 용해하여 정량한 뒤 cDNA를 합성하였다. Thermal cycler (T100™; Bio-Rad Laboratories, USA)를 이용하여 합성된 cDNA로 PCR을 수행한 후에 1.5% (w/v) agarose gel에 DNA marker와 함께 조건의 시간 동안 전기영동 하여 유전자 발현수준을 분석하였다. RT-PCR 분석의 internal control로는 actin beta (ACTB)을 사용하였으며 본 실험에서 사용된 대상 유전자들의 primer sequences는 Table 1에 제시하였다. RNA 발현수준은 RT-PCR을 통하여 평가하였으며, 이를 정량적으로 알아보기 위해 Image J 프로그램(National Institutes of Health, USA)을 사용하였다.
Results and Discussion1. CLE의 DPPH 라디칼 소거활성DPPH 라디칼 소거법은 항산화 물질의 전자 및 수소공여능을 측정하는 방법으로 널리 이용된다. CLE의 항산화 활성을 평가하기 위하여 DPPH 라디칼 소거활성을 실험하였다. 양성 대조군으로는 수용성 항산화제로 잘 알려진 vitamin C를 사용하였다. Vitamin C는 1 mg/mL에서 DPPH 라디칼을 100.00% 소거하였다. CLE는 0.1, 0.5, 1, 2.5, 5, 10 mg/mL에서 각각 4.46%, 4.97%, 3.02%, 24.97%, 51.37%, 53.35%의 DPPH 라디칼 소거능을 나타내었다. CLE 2.5, 5, 10 mg/mL 처리는 CLE 0.1 mg/mL 농도와 비교하여 유의적으로 높은 DPPH 라디컬 소거활성을 나타냈다(Figure 2). DPPH 라디칼을 50% 저해하는 농도인 CLE의 half maximal inhibitory concentration (IC50)은 4.96 mg/mL로 나타났다. 이전 연구들을 보면 생강과 식물들이 DPPH 라디칼 소거활성을 나타냈으며(Jung et al., 2012), 고지방, 고콜레스테롤 식이를 한 쥐에서 울금이 조직의 산화적 스트레스를 감소시켜 항산화 활성을 나타낸다고 보고된 바 있다(Kim et al., 2013b). 따라서 울금 추출물은 체내 활성산소의 증가를 억제하여 산화적 스트레스를 감소시킬 수 있는 항산화 소재로 생각된다.
2. 3T3-L1 세포에서 CLE의 세포독성 평가CLE가 3T3-L1 전지방세포에 독성을 나타내는지 알아보기 위하여 MTT assay를 실시하여 세포생존율을 분석하였다. CLE를 10, 50, 100, 200, 400, 800 μg/mL의 농도범위로 전지방세포에 24 h 동안 처리하였을 때, CLE가 처리된 3T3-L1 전지방세포의 생존율은 각각 109.08%, 102.61%, 120.05%, 119.06%, 108.10%, 104.40%로 나타났다(Figure 3). 결과적으로 10–800 μg/mL 농도의 CLE는 유의적인 세포독성을 나타내지 않았으므로, 이후 실험에서는 800 μg/mL 이하의 농도에서 실험을 진행하였다.
3. 3T3-L1 전지방세포의 adipogenesis에 CLE가 미치는 영향
Figure 1과 같이 3T3-L1 전지방세포를 분화시키고 CLE를 8일 동안 처리한 후 day 6에 ORO 염색을 통해 지방 축적 정도를 측정하였다. 현미경을 통해 지방 축적 정도를 확인한 결과, 지방 유도를 시키지 않은 전지방세포에서는 지방구가 관찰되지 않았으며, 유도시킨 대조군의 지방세포에서는 다량의 큰 지방구가 관찰되었다. CLE 처리 농도 중 200, 400, 800 μg/mL에서는 대조군과 비교하여 지방구 크기 및 수가 농도 의존적으로 감소하는 모습이 관찰되었다(Figure 4A). CLE 처리를 한 지방세포를 대조군인 CLE를 처리하지 않은 지방세포와 비교하였을 때 50, 100 μg/mL의 농도처리에서는 지방 축적 감소가 일어나지 않았으나 200, 400, 800 μg/mL 농도의 CLE 처리 시, 대조군과 비교하였을 때 농도 의존적으로 79.35%, 73.43%, 13.17%의 수치만큼 지방 축적 함량을 감소시키는 모습을 관찰할 수 있었다. 또한 800 μg/mL에서는 유의적으로 지방 축적 함량을 감소시켰음을 확인할 수 있었다(Figure 4B). 비만은 전지방세포의 분화유도과정인 adipogenesis 과정에 의해 발생하는 것이며, 이 과정에 관여하는 여러 기전을 조절하는 것이 비만을 예방하는데 있어 중요한 요소임이 보고된 바 있다(Chen & Farese, 2005). 이전 연구에 따르면 고콜레스테롤 식이로 유도된 고콜레스테롤혈증 쥐에서 울금 추출물이 음성대조군에 비하여 콜레스테롤 농도가 감소하는 효과를 나타냈다(Kim et al., 2008). 본 실험 결과는 CLE가 3T3-L1 adipogenesis 과정 중 생성되는 지방 축적을 억제시킴으로써 항비만에 효과적일 것이라고 보여진다.
4. CLE가 adipogenesis 관련 유전자 발현에 미치는 영향3T3-L1 전지방세포가 지방세포로 분화되는 adipogenesis 과정에는 초기, 중기, 후기 세가지 단계별로 여러 분화 조절인자들이 관여한다. Adipogenesis 관련 유전자 발현은 분화 초기에는 CEBPB와 CEBPD가 관여하며, 중기분화에는 PPARG와 CEBPA를 중심으로 여러 인자들이 복합적으로 작용하여 분화가 시작된다. 이와 같이 CLE가 3T3-L1 세포의 adipogenesis에 관여하는 주요 인자들의 발현 조절 유무에 어떠한 영향을 미치는지 알아보기 위해 RT-PCR을 통해 mRNA 발현수준을 분석하였다. 세포분화 조건은 Figure 1과 동일하게 실시하였다. 대조군은 ACTB로 설정하였으며 CEBPB, PPARG, CEBPA, FASN, LPL 순서로 실험을 진행하였다. 전지방 세포에 비해 분화된 지방세포에서의 CEBPB, PPARG, CEBPA, FASN, LPL의 mRNA 발현수준은 크게 증가하였으며 10, 100, 200, 400 μg/mL의 농도로 CLE를 처리하였을 때 대조군인 지방 세포에 비해 mRNA 발현수준이 감소하는 경향을 나타냈다(Figure 5A). 초기 전사인자인 CEBPB가 대조군인 adipocyte의 ACTB 기준값과 계산하여 비교하였을 때 200, 400 μg/mL 농도에서 그 이하 농도에 비해 크게 감소하였으며, 초기 전사인자에 영향을 받는 중기분화 관련 전사인자인 PPARG와 CEBPA, 그리고 후기에 발현되는 대표적 유전자인 FASN과 LPL 역시 200 및 400 μg/mL CLE 처리에서 발현이 감소하는 것을 관찰하였다(Figure 5B).
Adipogenesis는 관련 전사인자의 발현되는 양, 시기, 그리고 전사인자간의 상호조절작용을 통하여 밀접하게 조절된다. 이중 CEBPB는 adipogenesis 초기단계에 발현되는 전사인자 중의 하나로 adipogenesis의 초기 전사활성화 과정에 있어서 중요하다. 이는 다음 단계의 분화과정을 촉진시키는 PPARG와 CEBPA의 발현을 유도한다고 알려져 있다(Attie & Scherer, 2009; Rosen & MacDougald, 2006). Adipogenesis 과정의 전사인자들에 관한 이전 연구에서는 발효 울금(fermented water extracts of Curcuma longa radix) 추출물에 의해 PPARG의 발현이 감소되었으며(Kang et al., 2015), 식방풍잎 물 추출물은 부고환 지방조직에서 PPARG, sterol regulatory element binding transcription factor 1 (SREBP1) 그리고 FASN의 발현을 감소시킴으로써 체지방 축적 감소에 효과가 있었다(Jung et al., 2016). 또한 머루근 추출물의 용매 분획물을 이용하였을 때 CEBPA, CEBPB, 그리고 PPARG의 adipogenesis 과정의 주요 핵심 조절인자의 발현 감소를 통하여 항비만 활성을 증명한 바 있다(Park et al., 2013). 이러한 선행연구는 천연물 처리를 통하여 지방세포 특이적 전사인자의 발현을 조절하는 것은 지방 조직의 축적과 밀접한 연관이 있음을 의미한다. 본 연구에서 CLE는 3T3-L1 지방세포에서 adipogenesis 과정에 있어 중요한 전사인자들의 발현을 감소시킴으로써 지방구 크기 및 수에 억제 효과를 나타내어 항비만 소재로 활용이 가능함을 알 수 있다.
Conclusion비만은 체내에 체지방이 과도하게 축적된 상태를 의미하며 정신적, 육체적, 그리고 사회적 요인의 영향을 받는다(Ji et al., 2012). 또한 비만은 고혈압, 심혈관, 그리고 당뇨병 등의 여러 대사증후군의 발병과 밀접한 관련이 있는 것으로 알려져 있다. 비만의 경우 지방세포에서 정상에 비해 매우 많은 양의 유리지방산이 기초 지방분해율에 의해 다량으로 만들어진다(Choi et al., 2013). 이러한 유리지방산이 증가하게 되면 활성산소종 생산이 증가하게 되어 세포에 독성을 일으키게 된다고 알려져 있으며, 결국 많은 질환의 발병과 밀접한 관련이 있다(Ward, 1991). 이러한 이유들로 항비만 연구에서 항산화 활성을 같이 평가하고 측정되어야 할 것으로 생각된다.
전지방세포가 지방세포로 분화되는 과정을 adipogenesis라고 하는데, 이 과정을 조절하는 것은 비만연구에 있어 중요한 목표이며, 그 기전을 정확히 규명하는 것은 향후 소재의 안전성을 확인하는데 중요한 부분으로 생각된다.
본 연구에서는 DPPH 라디칼 소거활성을 통하여 국내 진도산 울금 추출물(CLE)의 항산화 활성을 평가하였다. 또한, CLE를 3T3-L1 세포에 day -2에서 day 6까지 처리한 결과 CLE는 농도 의존적으로 지방 축적을 감소시키는 것을 관찰 할 수 있었으며, 이 과정 동안 CLE는 adipogenesis의 분화과정에 관여하는 주요 전사인자인 CEBPB, PPARG, CEBPA, FASN, 그리고 LPL 유전자 발현을 효과적으로 억제하였다. 이러한 연구결과는 CLE가 효과적으로 adipogenesis를 억제하고, 향후 항비만 미용 식품 소재로서의 가능성을 보여주는 결과로 생각된다. 향후 CLE의 항비만 활성이 어떠한 분자생물학적 신호전달체계를 통해 전사인자들을 조절하는지에 대한 추가연구가 요구된다.
Figure 1.Scheme of 3T3-L1 differentiation and CLE treatment.Two days post-confluency was designated as day 0. 3T3-L1 adipocytes were treated with CLE during day -2 to day 6. Two days after confluency (day 0), cells were cultured using a DM. After differentiation, the media was replaced with a post-DM. Thereafter, cells were cultured in normal media and the media was changed every 2 days. CLE, Curcuma longa L. extracts; Normal media, mixture media of 10% fetal bovine serum, 1% penicillin-streptomycin, and Dulbecco’s modified Eagle’s medium; DM, differentiation media comprising normal media, 500 μM 3-isobutyl-1-methylxanthine, 5.2 μM dexamethasone, and 167 nM insulin; Post-DM, post-differentiation media comprising normal media and 167 nM insulin.

Figure 2.DPPH radical-scavenging activity of CLE.The DPPH radical-scavenging activities of CLE were investigated. Vit. C (1 mg/mL) was used as a positive control. The CLE between 0.1 to 10 mg/mL dose-dependently scavenged DPPH radicals. IC50 of CLE against DPPH radicals was 4.96 mg/mL. Data are presented as the means of triplicate experiments with standard deviation. Different letters indicate significant differences by t-test (*p<0.05 and ***p<0.001). DPPH, 2,2-diphenyl-1-picrylhydrazyl; CLE, Curcuma longa L. extracts; Vit. C, vitamin C; IC50, half maximal inhibitory concentration.

Figure 3.Effects of CLE on the 3T3-L1 viability.3T3-L1 adipocytes viability was evaluated by MTT assay. 3T3-L1 adipocytes were treated with 10, 50, 100, 200, 400, and 800 μg/mL of CLE for 24 h and up to 800 μg/mL CLE for 24 h did not affect 3T3-L1 viability. Up to 800 μg/mL of CLE were used further experiment. Data are present means of triplicate experiments with standard deviation. CLE, Curcuma longa L. extracts; Control, CLE untreated group; NS, not significant; MTT, thiazolyl blue tetrazolium bromide.

Figure 4.Effects of CLE on the 3T3-L1 adipogenesis.The 3T3-L1 cells were treated with 50, 100, 200, 400, and 800 μg/mL of CLE from days –2 to 6. The level, number, and size of lipid droplets in 3T3-L1 adipocytes in the presence or absence of CLE were analyzed by photomicrographed method. The CLE treatment effectively decreased the size and number of lipid droplets in 3T3-L1 adipocytes (A). The level of lipid accumulation in 3T3-L1 adipocyte was quantified at 510 nm. The 800 μg/mL of CLE significantly inhibited intracellular lipid accumulation of 3T3-L1 adipocytes (B). Data are present means of triplicate experiments with standard deviation. Different letters indicate significant differences by t-test (**p<0.01). CLE, Curcuma longa L. extracts; Pre, 3T3-L1 preadipocyte at day 6; Adi, mature adipocytes at day 6; Control, mature adipocytes at day 6.
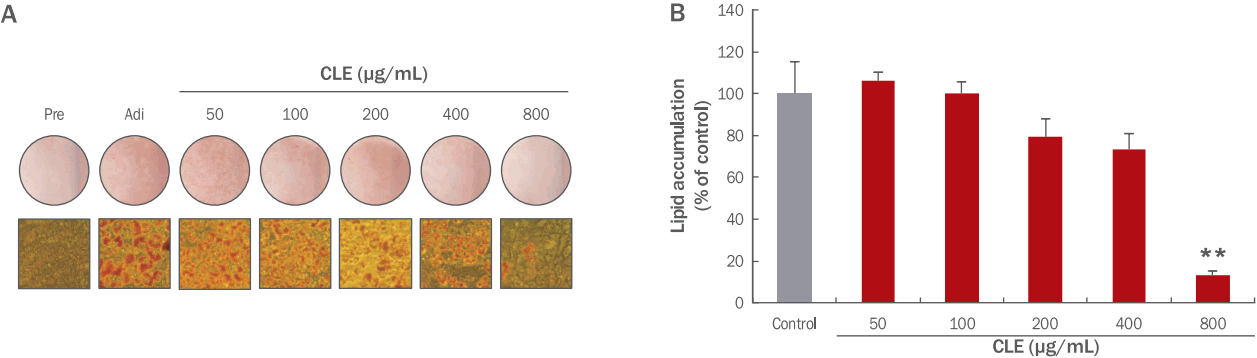
Figure 5.Effects of CLE on mRNA expression in 3T3-L1 adipocytes.Adipogenesis in 3T3-L1 adipocytes is accompanied by increased expression of transcriptional factors and adipocyte-specific genes. The mRNA expression levels of adipogenic transcriptional factors including CEBPB, PPARG, CEBPA, FASN, and LPL were analyzed by RT-PCR. Their expression levels were suppressed by CLE treatment (A). The mRNA expression was quantified using Image J program (B). Each value of the graph corresponds to the percent divided by ACTB, an internal control. CLE, Curcuma longa L. extracts; Pre, 3T3-L1 preadipocyte at day 6; Adi, mature adipocytes at day 6; CEBPB, CCAAT/enhancer binding protein β; PPARG, peroxisome proliferator activated receptor γ; CEBPA, CCAAT/enhancer binding protein α; FASN, fatty acid synthase; LPL, lipoprotein lipase; ACTB, actin beta; RT-PCR, reverse transcription-polymerase chain reaction.

Table 1.Primer sequences for RT-PCR analysis ReferencesAttie AD, Scherer PE. Adipocyte metabolism and obesity. The Journal of Lipid Research 50: 395-399. 2009.
Barry J, Fritz M, Brender JR, Smith PE, Lee DK, Ramamoorthy A. Determining the effects of lipophilic drugs on membrane structure by solid-state NMR spectroscopy: the case of the antioxidant curcumin. Journal of the American Chemical Society 131: 4490-4498. 2009.
Cao Z, Umek RM, McKnight SL. Regulated expression of three C/EBP isoforms during adipose conversion of 3T3-L1 cells. Genes & Development 5: 1538-1552. 1991.
Chen HC, Farese RV Jr. Inhibition of triglyceride synthesis as a treatment strategy for obesity: lessons from DGAT1-deficient mice. Arteriosclerosis Thrombosis, and Vascular Biology , 25: 482-486. 2005.
Chen HM, Muramoto K, Yamauchi F, Fujimoto K, Nokihara K. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein. Journal of Agricultural and Food Chemistry 46: 49-53. 1998.
Chen Z, Torrens JI, Anand A, Spiegelman BM, Friedman JM. Krox20 stimulates adipogenesis via C/EBPbeta-dependent and -independent mechanisms. Cell Metabolism 1: 93-106. 2005.
Choi JH, Park YH, Lee IS, Lee SP, Yu MH. Antioxidant activity and inhibitory effect of Aster scaber Thunb. extract on adipocyte differentiation in 3T3-L1 cells. Korean Journal of Food Science and Technology 45: 356-363. 2013.
Choi KM, Lee YS, Kim W, Choi YH, Kwak YG, Jung JC, Lee J, Yoo HS. Improvement of high-fat diet-induced obesity by xanthigen in C57BL/6N mice. Journal of Life Science 22: 1697-1703. 2012.
Chua S Jr, Leibel RL. Obesity genes: molecular and metabolic mechanisms. Diabetes Reviews 5: 2-7. 1997.
de Ferranti S, Mozaffarian D. The perfect storm: obesity, adipocyte dysfunction, and metabolic consequences. Clinical Chemistry 54: 945-955. 2008.
Evans JL, Goldfine ID, Maddux BA, Grodsky GM. Oxidative stress and stress-activated signaling pathways: a unifying hypothesis of type 2 diabetes. Endocrine Reviews 23: 599-622. 2002.
Holst D, Grimaldi PA. New factors in the regulation of adipose differentiation and metabolism. Current Opinion in Lipidology 13: 241-245. 2002.
Jakoby WB. The glutathione S-transferases: a group of multifunctional detoxification proteins. Advances in Enzymology and Related Areas of Molecular Biology 46: 383-414. 1978.
Jelodar GA, Maleki M, Motadayen MH, Sirus S. Effect of fenugreek, onion and garlic on blood glucose and histopathology of pancreas of alloxan-induced diabetic rats. Indian Journal of Medical Sciences 59: 64-69. 2005.
Ji HH, Jeong HY, Jin S, Kwon HJ, Kim BW. Inhibition of adipocyte differentiation by methanol extracts of Oenanthe javanica seed in 3T3-L1 preadipocytes. Journal of Life Science 22: 1688-1696. 2012.
Jung HK, Sim MO, Jang JH, Kim TM, An BK, Kim MS, Jung WS. Anti-obesity effects of Peucedanum japonicum Thunberg L. on 3T3-L1 cells and high-fat diet-induced obese mice. Korean Journal of Plant Resources 29: 1-10. 2016.
Jung YS, Park SJ, Park JH, Jhee KH, Lee IS, Yang SA. Effects of ethanol extracts from Zingiber officinale Rosc., Curcuma longa L., and Curcuma aromatica Salisb. on acetylcholinesterase and antioxidant activities as well as GABA contents. Journal of the Korean Society of Food Science and Nutrition 41: 1395-1401. 2012.
Kang YH, Kim KK, Kim TW, Yang CS, Choe M. Evaluation of the anti-obesity activity of Platycodon grandiflorum root and Curcuma longa root fermented with Aspergillus oryzae. Korean Journal of Food Science and Technology 47: 111-118. 2015.
Kim HO, Hwang YI, Kim GN. Anti-obese function of demethoxycurcumin through suppression of adipogenesis in 3T3-L1 cells. Asian Journal of Beauty and Cosmetology 11: 29-34. 2013a.
Kim MS, Chun SS, Choi JH. Effects of turmeric (Curcuma longa L.) on antioxidative systems and oxidative damage in rats fed a high fat and cholesterol diet. Journal of the Korean Society of Food Science and Nutrition 42: 570-576. 2013b.
Kim TH, Son YK, Hwang KH, Kim MH. Effects of Angelica keiskei Koidzumi and turmeric extract supplementation on serum lipid parameters in hypercholesterolemic diet or P-407-induced hyperlipidemic rats. Journal of the Korean Society of Food Science and Nutrition 37: 708-713. 2008.
Koutnikova H, Auwerx J. Regulation of adipocyte differentiation. Annals of Medicine 33: 556-561. 2001.
Lee JA, Ahn EK, Hong SS, Oh JS. Anti-obesity effect of ethyl acetate extracts from Agrimonia pilosa Ledeb. in 3T3-L1 preadipocytes. Journal of the Korean Society of Food Science and Nutrition 41: 161-167. 2012a.
Lee KJ, Ma JY, Kim YS. Identification of curcuminoids from turmeric (Curcuma longa ) using ultrasonic wave and dipping method. Korean Society for Biotechnology and Bioengineering Journal 27: 33-39. 2012b.
Morrison RF, Farmer SR. Hormonal signaling and transcriptional control of adipocyte differentiation. The Journal of Nutrition 130: 3116S-3121S. 2000.
Mudduluru G, George-William JN, Muppala S, Asangani IA, Kumarswamy R, Nelson LD, Allgayer H. Curcumin regulates miR-21 expression and inhibits invasion and metastasis in colorectal cancer. Bioscience Reports 31: 185-197. 2011.
Park JA, Jin KS, Oh YN, Hyun SK, Choi YH, Kwon HJ, Kim BW. Antiadipogenic effect of Vitis amurensis root methanol extract and its solvent fractions in 3T3-L1 preadipocytes. Journal of Life Science 23: 69-78. 2013.
Rosen ED, MacDougald OA. Adipocyte differentiation from the inside out. Nature Reviews Molecular Cell Biology 7: 885-896. 2006.
Rosen ED, Spiegelman BM. Molecular regulation of adipogenesis. Annual Review of Cell and Developmental Biology 16: 145-171. 2000.
Salla S, Sunkara R, Ogutu S, Walker LT, Verghese M. Antioxidant activity of papaya seed extracts against H2O2 induced oxidative stress in HepG2 cells. LWT-Food Science and Technology 66: 293-297. 2016.
Ward PA. Mechanisms of endothelial cell injury. Translational Research 118: 421-426. 1991.
|
|
|||||||||||||||||||||||||||||||||||