인삼열매 에탄올 추출물의 화장품 소재로서 항산화, 항염 효과
요약
목적
본 연구는 인삼열매의 화장품 소재로서 활용가능성을 평가하기 위하여 에탄올 70%로 추출하여 실험을 진행하였다.
방법
인삼열매 에탄올 추출물을 GC/MS로 분석하였고, 총 폴리페놀, 플라보노이드 함량과 2,2-diphenyl-1-picrylhydrazyl (DPPH) 소거활성을 통한 항산화, 세포 생존율(MTT assay) 확인을 통한 독성 평가를 하였다. 또한 nitric oxide (NO) 생성 저해 측정을 통해 항염효과를 알아보았다.
결과
총 폴리페놀 함량은 152±12.4 μg/mL, 총 플라보노이드는 50.16±1.48 μg/mL로 나타났다. DPPH 소거활성은 추출물 농도 0.25 mg/mL에서 59.21±4.20%, 0.5mg/mL에서 69.27±2.38%, 1 mg/mL에서89.30±1.25%로 소거능이 증가함을 확인하였다. 세포 생존율 평가는 세포 생존율을 0.125-1 mg/mL의 농도범위까지 평가하였을 때, 최고 농도 1 mg/mL에서 80.92±5.77%의 생존율을 확인하였다. LPS로 염증반응이 유도된 RAW 264.7 세포를 통해 nitric oxide (NO) 생성 저해효과 측정에서는 추출물의 농도가 0.25 mg/mL일 때 25.58±3.11 μM, 0.5 mg/mL일 때 13.91±3.86 μM, 1 mg/mL일 때 3.91±1.55 μM 로 농도가 증가함에 따라 감소하여 항염 효과가 있음을 확인하였다.
결론
인삼열매 에탄올 추출물은 항산화 및 항염 효과가 우수하였으며, 천연 기능성 화장품 소재로서의 가능성이 있는 것으로 사료되었다.
핵심용어: 인삼열매, 항산화, 항염, 폴리페놀, 화장품
Abstract
Purpose
This study was conducted to evaluate the applicability of ginseng berry in cosmetics.
Methods
Ethanol extract of ginseng berry was analyzed using gas chromatography-mass spectrometry (GC-MS). 2,2-Diphenyl-1-picrylhydrazyl (DPPH) scavenging was used to determine the antioxidant activity, total polyphenol, and flavonoid content. Cell viability (MTT assay) confirmation was conducted to determine the toxicity, while the anti-inflammatory effect was investigated by measuring the inhibition of nitric oxide (NO) production.
Results
The total polyphenol and flavonoid contents were 152±12.4 μg/mL and 50.16±1.48 μg/mL, respectively. DPPH scavenging activity in the extract with a concentration of 0.25 mg/mL increased to 59.21±4.20%, 0.5 mg/mL to 69.27±2.38%, and 1 mg/mL to 89.30±1.25%. Cell viability evaluation showed a survival rate of 80.92±5.77% for 1 mg/mL concentration range for cell viability evaluation—0.125–1 mg/mL. The inhibitory effect of nitric oxide (NO) production through RAW 264.7 cells induced by inflammatory response with lipopolysaccharide (LPS) resulted in an extract concentration of 25.58±3.11 μM (0.25 mg/mL), 13.91±3.86 μM (0.5 mg/mL), and 3.91±1.55 μM (1 mg/mL). The increase in concentration confirms an antiinflammatory effect.
Conclusion
Ethanol extract of ginseng berry has excellent antioxidant and anti-inflammatory effects and can be a functional cosmetic material.
Keywords: Ginseng berry, Antioxidant, Anti-inflammation, Polyphenol, Cosmetics
中文摘要
方法
采用气相色谱-质谱法(GC-MS)分析人参浆果乙醇提取物。使用2,2-diphenyl-1-picrylhydrazyl (DPPH)消除能力以及测总多酚和类黄酮含量来确定抗氧化剂活性;进行细 胞生存力(MTT分析)确认毒性,同时通过测量对一氧化氮(NO)产生的抑制作用来确认抗炎作用。
结果
总多酚和类黄酮含量分别为152±12.4 μg/mL和50.16±1.48 μg/mL。DPPH消除活性在浓度为0.25,0.5,1 mg/mL时,分别为59.21±4.20%,69.27±2.38%,89.30±1.25%。0.125–1 mg/mL 浓度范围内测量细胞活力 时,显示在最大浓度 1 mg/mL时,存活率为80.92±5.77%。在通过LPS诱导炎症反应的RAW 264.7细胞中产生 一氧化氮(NO)的抑制作用的测量中,浓度为0.25,0.5,1 mg/mL时,NO生成量分别为25.58±3.11 μM,13.91±3.86 μM和3.91±1.55 μM,随着浓度增加而降低了NO的生成量从而证实了抗炎作用。
结论
人参浆果乙 醇提取物具有优良的抗氧化和抗炎作用,可作为功能性美容原料。
关键词: 人参浆果, 抗氧化剂, 消炎, 多酚, 化妆品
Introduction
최근 화장품 유해성분에 대한 위험성 문제와 친환경적인 제품을 선호하는 소비자로 인해 천연 화장품 시장이 세계적으로 증가하고 있다. 국내에서도 천연화장품 개발이 꾸준히 증가 추세에 있으며 국내산 천연화장품 소재의 효능( Kim et al., 2018; Hwang et al., 2020)이 검증되어 다양한 제품으로 출시되고 있다. 특히 해외에서 한국 화장품의 구매가 증가하면서 해외 소비자에게 인지도가 높은 국내산 천연물을 소재로 한 화장품 연구도 활발히 진행되고 있다. 한국을 대표하는 약리성분을 함유한 약재 중 인삼 ( Panax ginseng C.A. meyer)은 약, 건강식품, 뿐만 아니라 화장품으로도 만들어지고 있다. Park (1996)의 연구에서 1957년 소련의 Brekhman에 의해 사포닌 배당체가 약효성분임이 밝혀졌고, 1960-1980년대 일본의 Shibata( Shibata et al., 1966), Tanaka ( Matsuura et al., 1984) 그룹에 의해 인삼 사포닌(3-6%)의 성분이 Dammarane-Saponin으로 확인되었다. 오가피과인 인삼은 약효 성분으로 알려진 ginsenoside가 인삼 뿌리뿐 아니라 잎( Lee et al., 2015)과 열매에도 다양하게 존재하고 있음이 많은 연구를 통해 밝혀지고 있다. Jeon et al., 2011의 연구에서 유산균으로 발효시킨 후 인삼열매 추출물에서는 항산화 활성이 높고 피부 주름 및 염증 예방에 효과적으로 활용 가능한 소재가 될 수 있을 것이라는 보고도 있었다. 진세노이드의 일부 성분의 경우, 뿌리보다 열매에 더 많은 함량을 지니고 있는 것으로 확인되었다. 인삼열매에는 항당뇨 효과, 항암효과, 항알러지 효과 등이 있는 것으로 알려져 있으며그에 따른 연구도 진행되어지고 있다. 또한 인삼 열매 추출물은 자외선을 원인으로 하는 광노화와 세포 활성이 떨어지는 자연 노화에 적용 가능한 소재가 될 수 있을 것이며 피부노화를 지연하고 개선시킬 수 있는 새로운 한방 소재로도 활용( Yeom et al., 2010) 가능하다. 그러나 현재는 그에 대한 연구가 아직 미비한 상황이다. 따라서 본 연구에서는 인삼근에 집중되어 왔던 연구에서 인삼의 부산물인 인삼열매를 화장품 소재로 활용할 수 있도록 인삼열매의 항산화( Song et al., 2014), 항독성, 항염 효과 등을 평가하고 연구문헌을 고찰하여 그 가능성을 검토하고자 한다.
II. Methods
1. 실험재료
1) 시약 및 기기
본 연구에 사용된 시약은 2,2-diphenyl-1-picrylhydrazyl (DPPH), butylated hydroxytoluene (BHT), dimethyl sulfoxide (DMSO), ascorbic acid, lipopolysaccharide (LPS), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT)는 Sigma Aldrich (USA)에서 구입하여 사용하였다. Gas Chromatograph-Mass Spectrometry (GC-MS, QP-2010; Ultra, Shimadzu co., Japan), UV/VIS 분광 광도계 (UV-2450; Shimadzu Co.), Microplate reader (BioTek, US), CO2 incubator, Rotary Evaporator (EYELA N-1110; Tokyo Rikakikai, Japan) 를 사용하였다.
2) 추출물 제조
본 실험에 사용한 인삼열매는 강원도 정선군에서 재배되어 정선군 농업기술센터에서 분말 제조하여 판매되는 것을 구입하여 사용하였다. 건조된 인삼열매 분말 10%을 70%에탄올 수용액에 침지 시키고, 초음파추출법을 이용하여 25℃에서 추출시간을 6 h으로 하여 인삼열매의 유효성분을 추출하였다. 추출물을 4℃에서 원심분리기(CS150NX; Hitachi Ltd., Japan) 4000 rpm으로 20 min 작동시키고, 분리한 상층액을 공극이 0.22 μm인 멤브레인(ADVANTEC Co. Ltd, Japan)으로 여과한 후 감압 농축(Evaporator; Tokyo Rikakikai co. Ltd., Japan)하고, 완전이 동결 건조하여 최종적인 인삼열매 초음파 추출물 분말을 제조하였으며, 분석시료로 사용하였다.
3) 총 폴리페놀 함량
농도별로 제조한 인삼열매 초음파 추출물을 1 mg/mL 농도로 제조한 용액에 folin-ciocalteau's phenol reagent 1 mL를 가하고 암실에서 5 min간 반응시킨 뒤에 10% 탄산 소듐(Na2CO3) 1 mL을 넣고 실온에서 1 h 반응시킨 후 UV/VIS 분광 광도계(UV-2450; Shimadzu Co., Japan)로 700 nm에서 흡광도를 측정하였다. 이때, gallic acid (GA; Sigma-Aldrich)는 0-200 μg/mL의 농도로 제조하여 시료와 동일한 방법으로 분석한 뒤 얻은 표준 검량선으로 추출물의 총 페놀 함량을 산출하였으며, gallic acid equivalents (mg GAE/g extract)로 나타내었다.
4) 총 플라보노이드 함량
에탄올 농도별로 제조한 인삼열매 초음파 추출물을 200 μg/mL 농도로 제조한 용액에 di-ethylene glycol (Sigma-Aldrich) 2 mL, 1N NaOH (Sigma-Aldrich) 0.02 mL를 첨가한 다음 37℃ 항온수조에서 1 h 동안 둔 후 UV/VIS 분광광도계(UV-2450; Shimadzu Co.)로 420 nm에서 흡광도를 측정하였다. 이때 총 플라보노이드 함량은 루틴(Sigma-Aldrich)을 표준물질로 사용하여 보정곡선을 작성하고 그것으로부터 총 플라보노이드 함량을 구하였다.
2. 성분 분석(GC/MS)
인삼열매의 에탄올 추출물의 성분 분석을 위해 GC-MS 장비(QP-2010 Ultra; Shimadzu Co.)를 이용하였으며 추출물을 DMSO에 교반 한 후, 원심분리기를 사용하여 부유물을 제거한 뒤 마이크로 필터(ADVANTEC Co Ltd, Japan) 0.45 μm로 여과하였다. Column 은 Elite-5ms (30 m×0.25 mm I.D, 0.25 μm film thickness), Carrier gas는 He 1.0 mL/min, Injection temp 250℃, Split ratio (10:1), GC oven temp. program 50-300℃/3℃/min, injection volume은 1.0 mL, MS Ion source temp. 220℃, MS Interface temp., 250℃ 조건으로 성분을 분석하였다.
3. 인삼열매 에탄올 추출물의 항산화 측정 (DPPH radical scavenging activity)
인삼열매의 항산화 측정실험은 시료 2 mL에 0.2 mM의 DPPH 1 mL를 넣고 교반 한 후 37℃, 30 min 반응 후 spectrophotometer, 517 nm에서 흡광도를 측정하였다. 대조군은 1 mg/mL의 ascorbic acid를 사용하였고, DPPH radical 소거활성은 다음과 같이 계산하였다.
DPPH radical scavenging activity (%)=[1-(B/A)]×100
A: 대조군의 흡광도(DPPH용액), B: 샘플 자체 흡광도
4. 세포독성 시험(MTT assay)
소재의 안정성 시험으로 세포독성시험인 MTT assay를 사용하였다. 세포독성 시험에 사용한 세포는 대식세포인 RAW 264.7 cell (한국 세포주 은행 생물자원센터, 한국)을 사용하였다. Raw 264.7 cell을 96 well plate 1×104 cell/mL씩 분주하여 24 h 배양 후 희석한 추출물을 각 well에 처치하여 24 h 동안 배양하였다. 세포 병변을 확인한 후 배양액 100 μL씩을 제거한 후, MTT 용액 10 uL 씩을 각 well에 가하여 5% CO2, 37℃ 배양기에서 4 h 동안 정치하였다. MTT용액을 완전히 제거하여 배양 plate를 건조한 후 200 uL dimethyl sulfoxide (DMSO; Sigma-Aldrich)로 세포 내에 형성된 formazan 결정체를 용해하여 ELISA plate reader (BioTec Ex800, USA)로 570 nm에서 흡광도를 측정하였다. 세포생존율(cell viability)은 다음과 같은 식으로 계산되었다.
Cell viability (%)=[(Exp.-Blank)/Control]×100
5. 항염증 평가(NO assay)
항염증 평가는 lipopolysaccharide (LPS)에 의해 유도된 nitric oxide (NO)생성억제 활성을 측정하였다. 항염증 실험에는 면역세포를 사용해야 하므로 대식세포인 Raw 264.7 cell (mouse monocyte macrophage)을 한국 세포주 은행 생물자원센터에서 분양 받아서 사용하였다.
Raw 264.7 cell을 3×104 cell/mL씩 분주하여 24 h 배양하였다. 희석한 추출물을 각 well에 처리하고 동시에 LPS 1 μL/mL를 처리하여 24 h 동안 재배양하였다
RAW 264.7 cell에서 생성된 NO의 양을 griess 시약을 사용하여 측정하였다. 세포배양 상등액 100 μL와 griess시약 100 μL을 혼합 후 실온에서 10 min 반응시킨 뒤에 540 nm에서 Microplate reader (BioTek, US)로 흡광도를 측정하였다. 표준곡선은 NaNO2를 적정하여 작성하였다.
6. 통계처리
통계처리 실험결과는 3회 반복해서 실시하였고, 통계분석 데이터는 평균±표준편차(Mean±Standard Deviation. SD)로 표현하였다. 데이터의 통계처리을 위해 Statistical Package for Social Science (SPSS; USA)를 이용하여 분석하였으며, Student's t-test로 p value가 0.05 미만일 경우에 통계적으로 유의한 것으로 판정하였다. (*p<0.05, **p<0.01)
Results and Discussion
1. 총 폴리페놀 및 플라보노이드 함량
천연 식물의 추출물에 다량 존재하는 폴리페놀과 폴라보노이드는 항산화 성분을 다량 함유하고 있다( Ko, 2012). 본 연구에서는 인삼열매를 70%에탄올 추출물에 존재하는 총 폴리페놀과 플라보노이드 함량을 측정하였다. 인삼열매 에탄올 추출물의 함량측정 결과 총 폴리페놀은 152±12.4 μg/mL, 총 플라보노이드는 50.16±1.48 μg/mL로 나타났다( Table 1).
2. 성분 분석(GC/MS)
인삼열매 에탄올 추출물을 GC-MS로 성분을 분석한 결과( Table 2) 다량의 산류(22.08%)와 알코올류, 알데히드류(decanal 2.88%, benzaldehyde 0.97%), 에스테르류(methyl salicylate, 2.61%)등 45종의 성분이 검출되었다. 본 연구에서 Table 2와 Figure 1의 결과와 같이 화장품 생산에 사용 가능한 올레산 혼합물인 octadecanoic acid (stearic acid, 6.7%)와 hexadecanoic acid(1.31%), 다당류(sucrose 7.3%, glyceraldehyde 4.47%, beta-D-glucopyranose1.09%), 페놀 화합물(phenol 2.91%, vinylphenol 2.84%, methoxyphenol 4.36%)등이 추출된 것을 확인하였다. 또한 benzofuran이 7.99% 추출되었는데 벤조퓨란 화합물은 항 종양, 항균, 항산화 및 항 바이러스 활성과 같은 강력한 생물학적 활성을 가지고 있어 화학 및 제약 연구에서도 관심을 갖고 있는 천연 화합물이다( Miao et al., 2019). 항노화 효과가 있는 항산화 생리활성 성분인 stigmasterol (1.09%)과 .gamma.-sitosterol (3.41%), catechol (3.4%)이 확인되었고, 항염(암세포 증식 억제)과 지방 축적 억제 생리활성 성분인 pyrrolidone (1.58%)과 같은 알칼로이드 성분은 고려홍삼( Hyun et al., 2020) 연구에서도 확인된 바 있다. 인삼열매 성분은 항산화, 항염( Lee et al., 2014) 효과가 있는 유효 성분을 다량 함유하고 있으므로 노화 방지 기능성 화장품의 소재로서의 가능성이 있음을 확인하였다.
3. DPPH free radical 소거능
DPPH 측정법은 활성산소의 제거능을 알아보는 방법으로 Figure 2와 같이 양성대조군인 ascorbic acid (100 μM)를 처리한 군에는 97.2±0.12%의 소거능을 보였으며, 인삼열매 에탄올 추출물은 0.25 mg/mL에서 59.21±4.20%, 0.5 mg/mL에서 69.27±2.38%, 1 mg/mL에서 89.30±1.25%로 농도가 증가함에 따라서 소거능도 증가함을 확인하였다. 이러한 높은 소거능은 10년, 15년 산 산양삼의 DPPH radical 소거능이 각각 72.24±1.19, 80.17±1.64%로 나타난 것과 비슷한 결과이다( Lee et al., 2018). 이것은 인삼열매 추출물이 피부노화를 방지하는 항산화 효과가 우수함을 나타내고 있다( Figure 2).
4. 세포독성 시험(MTT assay)
인삼열매 추출물의 세포독성 시험결과를 Figure 3에 나타냈다. 0.125-1 mg/mL의 농도범위까지 평가하였을 때, 세포독성은 각 농도에서 모두 80% 이상의 생존율을 관찰하였으며 최고 농도인 1mg/mL에서 80.92±5.77%의 생존율을 확인하였다. 인삼열매의 또 다른 연구( Jeon et al., 2011)에서 인삼열매 추출물과 유산균 발효 인삼열매 추출물에서 0.50 % 이하의 농도에서 독성이 전혀 없으며, 1.00 % 이상에서는 세포생존율이 약간 감소하였다는 결과보다는 낮은 생존율이지만 독성이 강하지 않은 안전한 소재임을 확인하였다.
5. 항염증 평가(NO assay)
LPS에 의해 유도된 nitrite oxide (NO)의 생성 억제 활성을 측정한 결과, 대조군의 경우 1.2 μM이었다. LPS에 의해 46.83 μM 농도로 생성된 NO가 인삼열매 추출물의 농도 0.25 mg/mL에서 25.58±3.11 μM로 염증유발 물질을 45.36% 감소시켰으며, 0.5 mg/mL일 때 13.91±3.86 μM (70.28%), 1 mg/mL일 때 3.91±1.55 μM (91.63%) 저하시켜 농도가 증가함에 따라 Figure 4와 같이 농도 의존적으로 NO 생성량이 감소하였다. 따라서 인삼열매 추출물이 염증을 완화시키는 항염증 효과가 있는 것으로 확인되었다.
Conclusion
본 연구에서는 인삼열매 에탄올 추출물의 화장품 소재로서의 항산화, 항염 효과를 알아보기 위해 성분분석과 총 폴리페놀과 플라보노이드 함량을 알아보았다. 또한 항산화 활성을 DPPH free radical 소거능을 통해 확인하고, 세포 생존률 평가와 항염증 평가를 실시하였다.
그 결과 인삼열매 총 폴리페놀 함량은 152±12.4 μg/mL, 총 플라보노이드 함량은 50.16±1.48 μg/mL로 나타났다. DPPH free radical 소거능은 인삼열매 에탄올 추출물 0.25 mg/mL에서 59.21±4.20%, 0.5 mg/mL에서 69.27±2.38%, 1 mg/mL에서 89.30±1.25%로 농도가 증가함에 따라서 라디컬 소거능도 함께 증가함을 확인하였다. 세포 생존률 평가 결과에서는 세포 생존률이 0.125-1 mg/mL의 농도범위까지 평가하였을 때, 최고 농도인 1 mg/mL에서 80.92±5.77%의 생존률을 확인하여 각 농도에서 모두 80% 이상의 생존률을 관찰하였다. 또한 항염증 평가를 위한 NO assay에서 인삼열매 추출물의 농도가 0.25 mg/mL일 때 25.58±3.11 μM, 0.5 mg/mL일 때 13.91±3.86 μM, 1 mg/mL일 때 3.91±1.55 μM로 농도가 증가함에 따라 농도 의존적으로 NO생성량이 감소하였음을 확인하였다.
이를 통해 인삼열매 추출물이 화장품 소재로서 항산화, 항염 효과가 있는 독성이 없는 안전한 소재로 평가되었다. 더불어 뛰어난 항산화 활성과 피부 주름 및 염증 예방에 적용 가능한 소재( Jeon et al., 2011)로서의 연구도 계속된다면 한국을 대표할 수 있는 천연 기능성 화장품 소재로 활용 가능할 것으로 사료된다.
Figure 1.
GC-MS graph of ethanol extract of ginseng berry.
Bioactive compounds were identified in 70% ethanol extracts of ginseng berry. Comparison of standard computer software data (GC-MS system data) and spectrum: a, glyceraldehyde (4.47%); b, catechol (3.4%); c, benzofuran, 2,3-dihydro-(7.99%); d, 2-Methoxy-4-vinylphenol (2.84%); e, sucrose (7.3%); f, beta-D-glucopyranose (1.09%); g, phenol (2.91%); h, hexanoic acid (1.31%); I, methoxyphenol (4.36%); j, octadecanoic acid (6.7%); k, stigmasterol (1.09%); l, gamma-sitosterol (3.41%), GS-MS, gas chromatography-mass spectrometry.
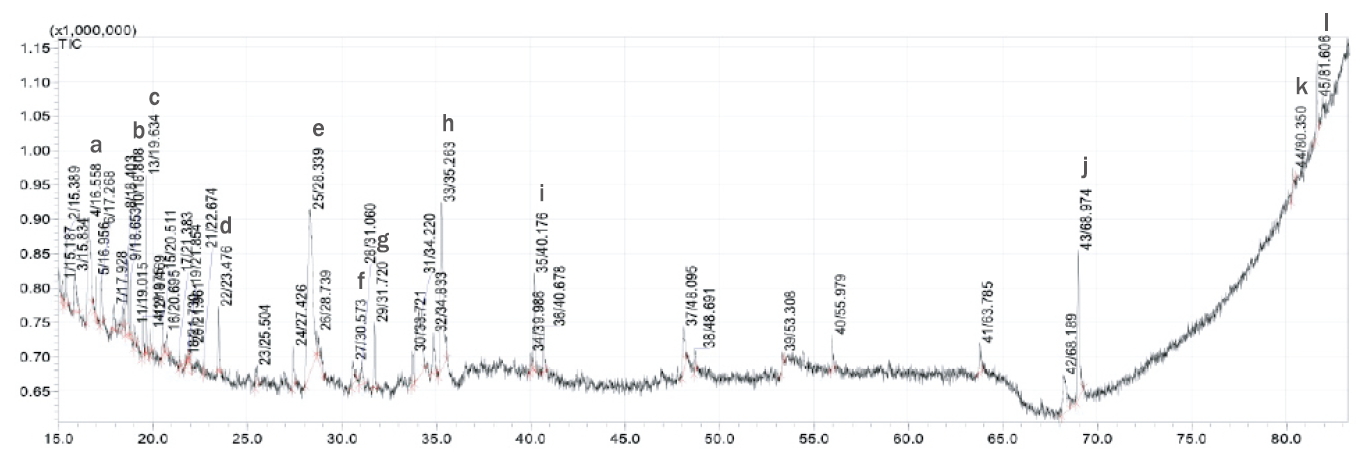
Figure 2.
DPPH radical scavenging activity of ethanol extract of ginseng berry.
DPPH radical scavenging analysis was performed to investigate the antioxidant effects of ethanol extract of ginseng berry at varying concentrations of 0.25, 0.5, and 1 mg/mL. EE, 70% ethanol extracts; Vit C, ascorbic acid;. Each value is represented as M±SD (n=3). Statistically significant differences are marked with an asterisk (*p<0.05, **p<0.01); DPPH, 1,1-diphenyl-2-picrylhydrazyl; M±SD, mean ± standard deviation.

Figure 3.
Cytotoxicity of ethanol extracts of ginseng berry in RAW 264.7 cells using MTT assay.
RAW 264.7 cells were incubated with 70% ethanol extracts of ginseng berry at varying concentrations of 0.125, 0.25, 0.5, and 1 mg/mL. Absorbance was measured at 570 nm. Results are represented as M±SD of three independent experiments. Statistically significant differences are marked with an asterisk (**p<0.01). MTT, 3-(4,5-dimethylthiazol2-yl)-2,5-diphenyl tetrazolium bromide; M±SD, mean±standard deviation.
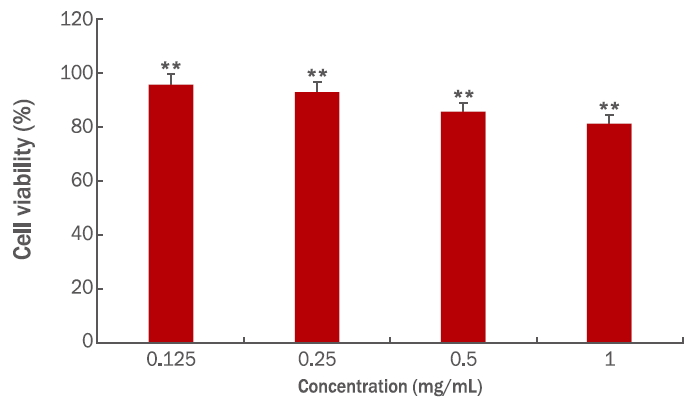
Figure 4.
Effects of ethanol extract of ginseng berry on NO production levels in LPS-induced RAW 264.7 cells.
RAW 264.7 cells were treated with various concentrations of 70% ethanol extracts of ginseng berry for 2 h, followed by LPS (1 μg/mL) for 24 h. The amount of NO was measured using Griess assay. Results are represented as M±SD of three independent experiments. Statistically significant differences are marked with an asterisk (*p<0.05). NO, nitric oxide; LPS, lipopolysaccharide; M±SD, mean ± standard deviation.
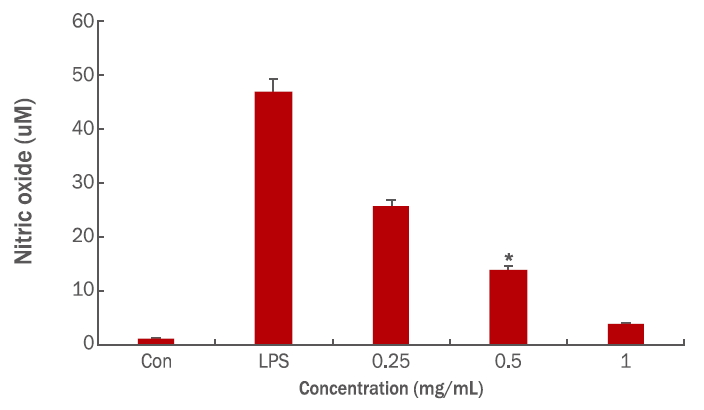
Table 1.
Total polyphenol and flavonoid contents of 70% ethanol extracts of ginseng berry by ultrasonication
|
Total polyphenol contents (GAE mg/g) |
Total flavonoid contents (TA/100g) |
|
Ginseng berry |
152±12.4 |
50.16±1.48 |
Table 2.
Chemical composition of ethanol extract of Ginseng berry using GC-MS analysis
|
Peak |
Compound name |
Time (min) |
Content (%) |
|
Solvent |
|
|
|
1 |
Mequinol |
15.187 |
0.97 |
|
2 |
2(3H)-Furanone, dihydro-4-hydroxy- |
15.389 |
3.06 |
|
3 |
(S)-(-)-2-Chloropropionic acid |
15.834 |
1.80 |
|
4 |
Glyceraldehyde |
16.558 |
4.47 |
|
5 |
1,3-Dioxolane, 2,4,5-trimethyl- |
16.957 |
1.84 |
|
6 |
2(3H)-Furanone, dihydro-4-hydroxy- |
17.268 |
2.04 |
|
7 |
Aziridine, 2-methyl-3-(1-methylethyl)-, trans- |
17.928 |
1.15 |
|
8 |
4-Methoxycarbonyl-4-butanolide |
18.403 |
0.95 |
|
9 |
Catechol |
18.653 |
3.40 |
|
10 |
Methyl salicylate |
18.808 |
2.61 |
|
11 |
2,4(1H,3H)-Pyrimidinedione, 5-hydroxy- |
19.015 |
1.05 |
|
12 |
1,4:3,6-Dianhydro-.alpha.-d-glucopyranose |
19.469 |
1.85 |
|
13 |
Benzofuran, 2,3-dihydro- |
19.634 |
7.99 |
|
14 |
5-Hydroxymethylfurfural |
19.875 |
1.14 |
|
15 |
1,2,3-Propanetriol, 1-acetate |
20.511 |
1.57 |
|
16 |
Benzene, 1,3-bis(1,1-dimethylethyl)- |
20.696 |
0.99 |
|
17 |
1H-Tetrazol-5-amine |
21.383 |
0.85 |
|
18 |
6-Aminotetrazolo(b)pyridazine |
21.730 |
0.47 |
|
19 |
4-Methyltetrahydro-1,3-oxazine-2-thione |
21.854 |
0.39 |
|
20 |
Sulfurous acid, hexyl octyl ester |
21.961 |
0.94 |
|
21 |
m-Aminophenylacetylene |
22.674 |
0.65 |
|
22 |
2-Methoxy-4-vinylphenol |
23.476 |
2.84 |
|
23 |
Benzaldehyde, 3-hydroxy- |
25.504 |
0.97 |
|
24 |
Tridecane, 1-iodo- |
27.426 |
1.85 |
|
25 |
Sucrose |
28.339 |
7.30 |
|
26 |
(3-Nitrophenyl) methanol, n-propyl ether |
28.739 |
1.19 |
|
27 |
.beta.-D-Glucopyranose, 1,6-anhydro- |
30.573 |
1.09 |
|
28 |
Octadecane, 6-methyl- |
31.060 |
1.05 |
|
29 |
Phenol, 2,4-bis(1,1-dimethylethyl)- |
31.720 |
2.91 |
|
30 |
3',5'-Dimethoxyacetophenone |
33.721 |
1.53 |
|
31 |
Decanal |
34.220 |
2.88 |
|
32 |
Diethyl phthalate |
34.833 |
1.78 |
|
33 |
Hexanoic acid, 2-ethylhexyl ester |
35.263 |
7.51 |
|
34 |
4-Hydroxy-2-methoxycinnamaldehyde |
39.986 |
0.89 |
|
35 |
4-((1E)-3-Hydroxy-1-propenyl)-2-methoxyphenol |
40.176 |
4.36 |
|
36 |
Pyrrolo[1,2-a]pyrazine-1,4-dione, hexahydro- |
40.678 |
2.01 |
|
37 |
n-Decanoic acid |
48.095 |
1.99 |
|
38 |
Benzenepropanoic acid, 2,5-dimethoxy- |
48.691 |
1.06 |
|
39 |
Dodecanoic acid, 3-hydroxy- |
53.308 |
0.77 |
|
40 |
5-Pyrrolidino-2-pyrrolidone |
55.979 |
1.58 |
|
41 |
Hexadecanoic acid, 2-hydroxy-1-(hydroxymethyl)ethyl ester |
63.785 |
1.31 |
|
42 |
Z,Z-8,10-Hexadecadien-1-ol |
68.190 |
1.75 |
|
43 |
Octadecanoic acid, 2-hydroxy-1-hydroxymethyl)ethylester |
68.974 |
6.70 |
|
44 |
Stigmasterol |
80.350 |
1.09 |
|
45 |
.gamma.-Sitosterol |
81.606 |
3.41 |
|
|
85 |
100 |
References
Hwang JU, Yang YH, Choe TB. Physiological characteristics of germinated oat ( Avena sativa) extract as raw material for cosmetics. Asian Journal of Beauty and Cosmetology 18: 137-148. 2020.   Hyun SH, Kim SW, Seo HW, Youn SH, Kyung JS, Lee YY, In G, Park CK, Han CK. Physiological and pharmacological features of the non-saponin components in Korean red ginseng. Journal of Ginseng Research 44: 527-537. 2020.    Jeon JM, Choi SK, Kim YJ, Jang SJ, Cheon JW, Lee HS. Antioxidant and antiaging effect of ginseng berry extract fermented by lactic acid bacteria. Journal of the Society of Cosmetic Scientists of Korea 37: 75-81. 2011.
Kim GW, Choi YH, Kim BL, Kim YU, Seong RS, Han MH, Kim GA, Choi MJ, Jeong YG. Determination of anti-oxidative and whitening effects of complex extracts obtained from sprout Panax ginseng C.A. Meyer and Cassia nomame (Sieb.) Honda on skin. Asian Journal of Beauty and Cosmetology 16: 309-320. 2018.   Ko KS. A study on antioxidant effect of methanol extract from Viola mandshurica. Journal of the Korean Society of Cosmetology 18: 1082-1086. 2012.
Lee JH, Cho SH, Yun MY, An Sk, Jang HH, Lee SN, Song GY. Anti-wrinkle effect of rare ginsenosides, produced from ginsenoside Rd. Asian Journal of Beauty and Cosmetology 13: 909-916. 2015.
Lee KS, Kim GH, Seong BJ, Kim SI, Han SH, Lee SS, Yang H, Yoo YC. Anti-inflammatory activity of solvent fractions from ginseng berry extract in LPS-induced RAW2647 cells. Korean Journal of Medicinal Crop Science 22: 449-456. 2014.   Lee SW, Choi HI, Kim AJ, Han JS. Applicability of Sunsik with cultivated wild ginseng powder as a beauty food. Asian Journal of Beauty and Cosmetology 16: 201-210. 2018.   Matsuura H, Kasai R, Tanaka O, Saruwatari Y, Kunihiro K, Fuwa T. Further studies on dammarane-saponins of ginseng roots. Chemical and Pharmaceutical Bulletin 32: 1188-1192. 1984.  Miao YH, Hu YH, Yang J, Liu T, Sun J, Wang XJ. Natural source, bioactivity and synthesis of benzofuran derivatives. RSC Advances 47: 27510-27540. 2019.  Park JD. Recent studies on the chemical constituents of Korean ginseng (Panax ginseng C.A. Meyer). Journal of Ginseng Research 20: 389-415. 1996.
Shibata S, Tanaka O, Ando T, Sado M, Tsushima S, Ohsawa T. Chemical studies on oriental plant drugs. XIV. protopanaxadiol, a genuine sapogenin of ginseng saponins. Chemical and Pharmaceutical Bulletin 14: 595-600. 1966.   Song JH, Shon MS, Kim HO, Kim JS, Kim ES, Kim GN. Antioxidant activity of oil extracted from ginseng seed. Asian Journal of Beauty and Cosmetology 12: 235-240. 2014.
Yeom MH, Lee JY, Kim JS, Park CW, Kim DH, Kim HK. The anti-aging effects of Korean ginseng berry in the skin. Korean Journal of Pharmacognosy 41: 26-35. 2010.
|
|