Introduction
20세기부터 상처 등 인체 질환을 치료 관리하는 방법을 위하여 광조사기를 사용한 예가 보고되고 있는데 그 중의 하나는 레이저를 광원으로 사용하는 방법이다(Cheon et al., 2007). 주로 사용 될 수 있는 레이저로서는 헬륨-네온을 기반으로 하는 632 nm 파장대를 갖는 것과 GaAlAs을 기반으로 하는 660-950 nm에 해당하는 레이저를 사용할 수 있는데 이는 상처의 종류 및 깊이, 또한 파장의 종류에 따라 세포의 증식도를 조절하고, 통증억제, 항염증 기능을 가지며, 상처 치유를 돕는 효과 등이 있다고 보고된 바 있다(Baxter et al., 1991; Sakurai et al., 2000). 그러나 레이저는 에너지가 커서 세포손상의 우려가 있어 저출력 레이저를 사용 할 수 있다. 이 경우 특정 세포에서 높은 증식을 보일 수 있음이 보고되었고, 세포배양, 당뇨쥐 그리고 사람에서 LED를 조사함으로 세포 증식이 증가하고 상처치유에 효과가 있음을 보고한 바 있다(Cheon, 2008; Whelan et al., 2004).
LED는 사용자와 피 사용자의 다양한 상황과 사용목적에 따라서 적절한 광 출력과 특정 파장을 선택함으로써 유해한 자외선이나 불필요한 적외선 등이 방출되지 않는 장점으로 부작용의 위험이 적다. 그리고 사용하는 에너지가 낮음으로 조직이나 눈을 손상시키지 않는 장점이 있어서 가시광선과 근적외선 영역의 LED 광원을 이용한 치료를 인간에게 사용할 수 있도록 미국 FDA에서 허가하고 있다(Kim et al., 2010). LED의 또 다른 특징으로는 수명이 길고, 소비전력이 적으며 부피를 최소화 할 수 있는 장점이 있어서 환경 친화적인 장점도 가지고 있다(Kim et al., 2010).
현재까지 밝혀진 LED를 이용한 치료분야로서는 상처치유, 여드름치유, 피부재생, 피부 각화증 치료, 알러지 비염, 항염증(Kim et al., 2013; Lim et al., 2007), 신생아 황달, 구강점막염증, 정맥 궤양 등으로 알려져 있다. 이렇게 LED의 다양한 특장점을 과학적으로 분석과 입증을 통해 임상 치료영역에서 활용되어지고 있는 반면, 아직까지 미용영역 중 피부 미백 활성 연구 분야는 아직도 더 밝혀 내야 할 미진한 분야가 많은 것이 현실이다(Kime t al., 2010).
또한 최근 LED를 이용한 건강관련 산업이 대두 되고 있고 살균기기, 공기정화기능, 식물 생장촉진기능, 피부활성화기능(Lee et al., 2007), 항염기능, 피부노화억제(Barolet et al., 2009), 자외선차단 및 과 색소침착 감소(Barolet & Boucher, 2008) 등의 많은 연구 성과가 제시되고 있고, 피부의 재생은 기술도입단계로 비침습성, 부작용 없음, 환자의 순응성, 사용의 편리성, 만족할만한 효과 등 자가 미용 치료기로서 시장에서 각광을 받을 것으로 판단된다. 특히 피부의 재생 및 피부질환을 효과적으로 치료 관리할 수 있는 기기의 개발은 의료비용 절감, 치료 및 관리의 물리적 소요시간의 절감, 환자의 만족도 증가 등 국민생활의 질을 개선하는데 그 필요성과 중요성이 있다. 그러나 이러한 기술은 외국을 비롯한 국내에서도 응용분야를 확장하고 있으며 활발하게 연구되고 있으나, 국내에서는 세부 기술 개발 및 제품 개발 지원이 부족하고 향후 피부관련 치료기의 개발의 중요성이 대두되고 있다. 외국의 경우 관련 병원용 대형의 고가 의료기기들을 출시하고 있고 많은 연구가 지속적으로 이루어지고 있다.
이와 같이 LED의 경제성 및 레이저와 같은 고 에너지의 광 조사 기구의 단점에 관한 연구를 대체하기 위한 다양한 파장에서의 LED의 탐색 및 중요성에 관한 제안은 많았지만 대부분의 연구는 동물 세포쥐를 이용한 연구에 머무르고 있어 체계적인 연구를 위해서는 다양한 LED 광원을 활용 하여 동물 세포에서의 확실한 파장을 선별하는 것은 매우 중요하다 할 것이다. 그러나 다양한 파장의 혼합체인 빛을 파장별로 분리하고 조사함으로써 세포수준에서 멜라닌의 합성 조절 기능에 관한 연구는 미흡하였다.
본 연구는 가시광선(630, 470, 525 nm) LED 조사장치를 활용하여 mouse 유래 B16 melanoma cell에서 멜라닌의 합성 및 조절 기전을 규명하여 피부노화 및 피부미백 미용기기로 개발될 수 있는 가능성을 제시하고자 한다.
Methods
1. LED광원 및 조사
LED 조사장치의 광원은 다양한 파장의 가시광성을 방출하는 고휘도 LED 램프를 사용하였다. 가시광선 조사량은 조사시간과 조사거리로 결정하였으며, 세포를 가시광선 조사용 박스에 넣은 후 15 min 점등/15 min 소등을 반복하여 조사하였다.
멜라닌 함량과 타이로시나아제 활성을 촉진시키기 위하여 세포 배양액에 α-MSH 등의 자극원을 사용할 수 있으며, 그 농도는 별도로 정한다.
미용 LED 보드의 제작은 본 연구자의 실험 디자인 및 설계 내용에 따라서 주문제작을 실시하였고 제작 및 공급 회사는 (주)엠아이테크 이며, 제원은 1.1와트 (W), 12볼트, 0.1 암페어 (A)의 규격을 사용하였으며, 50×50 mm 크기의 기판에 3×3열의 배열로 LED조사기판을 제작하였다. 구체적인 LED 조사장치의 파장 및 조합은 Table 1과 같다.
LED 조사를 위해서 20×30×15 cm (W×L×H) 크기의 빛이 투과하지 못하는 종이 재질의 박스를 제작하고 고압멸균을 실시하였다. 제작된 LED는 박스의 상단 중앙에 동일한 크기의 구멍을 내어 3M 테이프로 고정하였고 내부로 조사되는 광선이 다른 박스 내부로 들어가지 못하도록 인큐베이터 각층은 차폐를 실시하였다. 각 LED의 조사시간을 통일시키기 위하여 전원부에는 24 h 타이머를 설치하여 15 min 점등/15 min 소등이 반복되도록 하였다.
2. B16 melanoma cell
B16 melanoma cell은 American Type Culture Collection (ATCC)로부터 구입하여 사용하였고, 배지는 10% fetal bovine serum (FBS)을 포함한 DMEM배지를 사용하였으며, 온도 37℃와 5%의 CO2를 유지하는 incubator에서 배양하였다. 배지는 매2일마다 교환하였으며, 세포의 밀도가 90%가 도달하기 이전에 계대배양하였다. 냉동 보관한 세포를 해동한 후 내지 5-6 passage 까지만 사용하였으며, 사용 후 세포는 고압멸균 후 폐기하였다.
3. 시약 및 기기
1) 시약
시약으로 dimethyl sulfoxide (DMSO; Sigma Chem. Co., USA), fetal bovine serum (FBS; Wellgene, Korea), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide (MTT; Sigma Chem), Dulbecco's Modified Eagle's Medium (DMEM; Invitrogen, USA), tyrosinase (mushroom; Sigma Chem), L-3,4-dihydroxy-L-phenylalanine (L-DOPA; Sigma Chem), α-melanocyte stimulating hormone (α-MSH; Sigma Chem)을 사용하였고, 이외 실험 중 사용한 buffer 및 시약들은 시판되는 특1급 이상의 시약으로 직접 조제하였다.
4. MTT assay
본 실험에서 B16 melanoma cell에 대한 sample들의 처리 농도를 결정하기 위해 MTT assay를 사용하였는데, 이 정량법은 Mosmann(1983)의 방법을 변형하여 실시하였다. 이 분석법은 노란색의 수용성 기질인 MTT를 진청색의 비수용성인 formazan 질로 변화시키는 살아있는 세포의 mitochondria dehydrogenase의 능력을 이용한 방법이다. 생성된 formazan의 양은 살아있는 세포 수에 비례한다.
세포를 배양하여 96 well plate에 각 well당 세포를 105개 정도 되게 배지와 함께 180 μL를 넣고 LED를 설치하여 조사할 수 있도록 제작된 박스에 plate를 넣고 배양기(37℃, 5% CO2)에서 표시된 시간동안 배양 후 MTT용액(0.5mg/ml) 50 μL를 넣어 4시간 동안 다시 배양한다. 상층액을 제거하고 formazan 침전물에 150 μL의 DMSO를 넣어 15 min 실온에서 방치하여 formazan을 녹이고 570 nm의 파장에서 ELISA reader로 흡광도를 측정하여 세포 생존율을 계산한다. 결과는 control에 대한 %로 나타낸다.
Viability (% of control)= (A570 sampls/A570 control)×100
A570: absorbance at 570 nm
5. B16 melanoma cell내의 tyrosinase 활성도 및 melanin생성량 측정
1) Tyrosinase 활성도 측정
세포를 배양하여 96 well plate에 각 well당 세포를 105개 정도씩 넣고 반응군으로 LED를 설치하여 조사할 수 있도록 제작된 박스에 plate를 넣고 배양기(37℃, 5% CO2)에서 표시된 시간 동안 배양 후 각 well의 세포를 10 mM phosphate buffered saline (PBS)으로 세척하였으며, Triton X-100 1%를 함유한 10 mM PBS 100 μL에 현탁시켰다. 현탁된 이 액을 vortexing한 후 원심분리하여 상층액을 활성측정 용액으로 사용하였다.
96 well plate에 이 효소액을 40 μL 넣고 기질인 L-DOPA (2 mg/mL) 100 μL를 첨가하였다. 37℃에서 1 h 동안 반응을 진행시킨 뒤, ELISA reader를 이용하여 405 nm에서 흡광도를 측정하였다. Tyrosinase의 활성도는 아래와 같은 식으로 계산하였다.
활성도(%) = (A405 반응군/A405 control)×100
A405: absorbance at 405 nm
2) Melanin 생성량 측정
세포를 배양하여 96 well plate에 각 well당 세포를 105개씩 넣고 반응군으로 LED를 설치하여 조사할 수 있도록 제작된 박스에 plate를 넣고 배양기(37℃, 5% CO2)에서 표시된 시간 동안 배양 후 표기된 시간동안 배양한 후 각 well의 세포를 10mM PBS으로 세척한 후 0.2N NaOH용액 400 μL를 첨가하고 60℃에서 1 h 동안 용해하였으며, ELISA reader를 이용하여 405 nm에서 흡광도를 측정하였다. 멜라닌 양은 합성 멜라닌을 사용하여 작성된 표준 직선에서 구할 수 있고, 실험군의 멜라닌 양은 대조군의 멜라닌 양에 대한 백분율로 구한다.
6. α-MSH에 의한 tyrosinase 활성 및 과생성 melanin에 미치는 영향
외부자극에 따른 B16 melanoma cell내 tyrosinase의 활성 및 과생성 멜라닌에 각 sample들이 어떤 영향을 미치는지를 알아보기 위해 외부자극제로 α-MSH를 사용하였다. α-MSH는 멜라닌 세포의 표면에 존재하는 특이적인 수용체와 결합하고, α-MSH와 그 수용체의 복합체가 세포내의 cAMP를 증가시킴으로써 멜라닌 합성이 증가되는 것으로 알려져 있다(Cha, 2018; Shim, 2019). 약물농도는 α-MSH 100 mM로 정하였다. Tyrosinase 활성도와 과생성 멜라닌의 생성량 측정은 Choi et al. (1995)의 방법을 그대로 이용하여, 농도별로 조제한 각 sample, arbutin, 외부자극제(α-MSH)를 세포에 처리한 후 tyrosinase 활성도 및 과생성 멜라닌 양을 측정하였다.
Results and Discussion
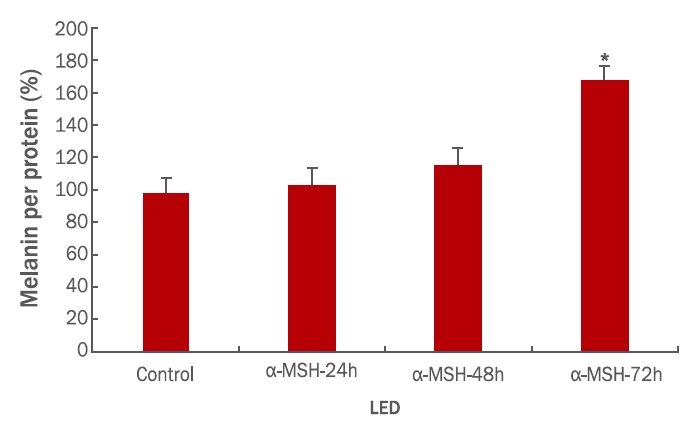
1. α-MSH 에 의한 멜라닌 생합성량 확인
B16 melanoma cell에 멜라닌의 생합성을 증가시키는 대표적인 호르몬인 α-melanine synthesis hormone (α-MSH)을 처리함으로써 멜라닌 합성능이 최고에 달하는 시간지점을 설정하기 위하여 실험을 실시한 후 그 결과를 Figure 1에 나타내었다. 10 nM의 α-MSH를 24, 48, 그리고 72 h 동안 B16 세포에 처리한 후 세포 내 멜라닌 함량을 colormetry 법으로 측정한 결과 배양 시간 의존적으로 멜라닌 함량이 증가되는 것을 확인할 수 있었다. 특히 72 h 배양세포에서는 대조군에 비하여 70% 가까이 멜라닌의 함량이 증가되는 것을 확인함으로써(p<0.01), 향후 시험에 72 h의 배양 조건이 최적임을 제시하는 결과를 획득하였다.
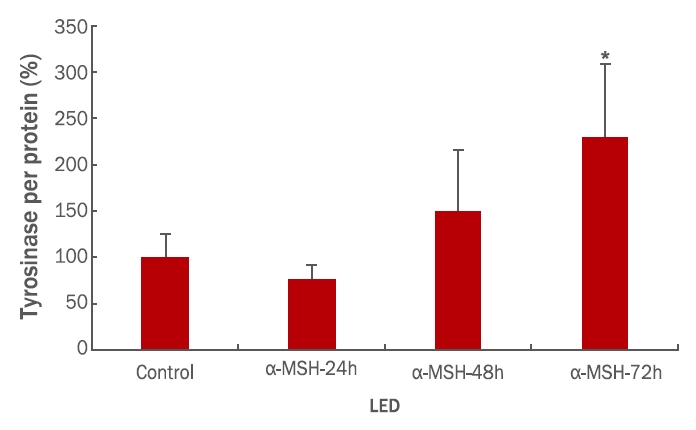
2. α-MSH 에 의한 tyrosinase 활성 변화 확인
B16 melanoma cell에 tyrosinase의 활성을 증가시키는것으로도 알려진 α-MSH을 처리함으로써 tyrosinase의 활성이 최고에 달하는 시간지점을 설정하기 위하여 실험을 실시한 후 그 결과를 Figure 2에 나타내었다. 10 nM의 α-MSH를 24, 48, 그리고 72 h 동안 B16 melanoma cell에 처리한 후 세포 내 tyrosinase의 활성을 DOPA를 이용한 colormetry 법으로 측정한 결과 배양 시간 의존적으로 tyrosinase의 활성이 유의하게 증가되는 것을 확인할 수 있었다. 특히 72 h 배양 세포에서는 대조군에 비하여 125% 이상 tyrosinase 활성이 증가되는 것을 확인함으로써(p<0.05), 향후 시험에 72 h의 배양 조건이 최적임을 제시하는 결과를 획득하였다. 그러나 효소 활성측정 시 소요되는 세포의 생리학적 특성으로 인해 오차 범위가 큰 것을 확인하였으나 유의성 평가 결과 72 h 배양 조건은 향후 실험에서 최적의 조건으로 활용할 수 있음을 알 수 있다.
3. 가시광선(green, red, blue)조사에 의한 세포 독성 확인
가시광선 파장 중 대표적인 색상인 녹색, 적색, 청색 계열 LED를 조사함으로써 B16 melanoma cell에 발생할 수 있는 독성을 평가하기 위하여 본 시험을 실시한 후 그 결과를 Figure 3에 나타내었다. 상기에 명시된 호르몬 처리에 의한 세포 내 멜라닌의 형성능과 tyrosinase 활성을 비교한 조건과 동일한 조건인 72 h동안 15 min 점등/15 min 소등을 반복하여 세포에 조사하였고 MTT assay를 통하여 세포 생존율을 비교하였다. 그 결과, 72 h동안 녹색, 적색, 청색 계열 LED를 B16 melanoma cell에 조사함으로써 세포의 유의한 증감은 관찰되지 않았고, 이는 녹색, 적색, 청색 계열 LED를 조사는 세포의 증식 또는 사멸에 직접적인 관여는 하지 않는 것으로 판단되었다. 이러한 결과는 녹색, 적색, 청색 계열 LED의 조사는 세포 독성을 갖고 있지 않음을 증명하는 것이라 할 수 있다.
그러나 Cheon (2008)은 633 nm LED 광원을 단독으로 사용할 경우 세포증식율을 높인다는 결과를 보고하여 이를 종합해보면 광 조사 시 특정 파장의 선별적 사용이 효과적임을 시사한다.
4. 가시광선(green, red, blue)조사에 의한 melanin 생합성도 변화 확인
녹색, 적색, 청색 계열 LED를 조사함으로써 B16 melanoma cell의 내부에서 α-MSH에 의해 유도된 멜라닌의 생합성 증가를 억제하는지 확인하는 실험을 진행한 후 그 결과를 Figure 4에 나타내었다. Figure 2에서 확인한 바와 같이 α-MSH의 처리는 B16세포의 멜라닌 생합성을 유의하게 증가시키는 것을 확인하였다. 그러나 녹색, 적색, 청색 계열 LED를 조사를 통해 멜라닌의 함량을 조절하는지를 확인하였을 때 각 파장의 광원 조사는 멜라닌 함량의 유의한 변화를 보이지 않았다. 이러한 결과는 녹색, 적색, 청색 계열 LED의 조사는 멜라닌의 생합성 및 축적에 영향을 미치지 않는 것으로 판단된다. 이처럼 가시광선 조사는 멜라닌 합성에는 영향을 미치지 않았지만 이와 반대로 레드(630 nm)와 그린(520 nm) 파장이 섬유아세포에 영향을 미쳐 세포의 증가가 보고되어졌고(Kim et al., 2015), 레드(633 nm) 파장에서는 세포증식이 보고되어졌다(Cheon, 2008).
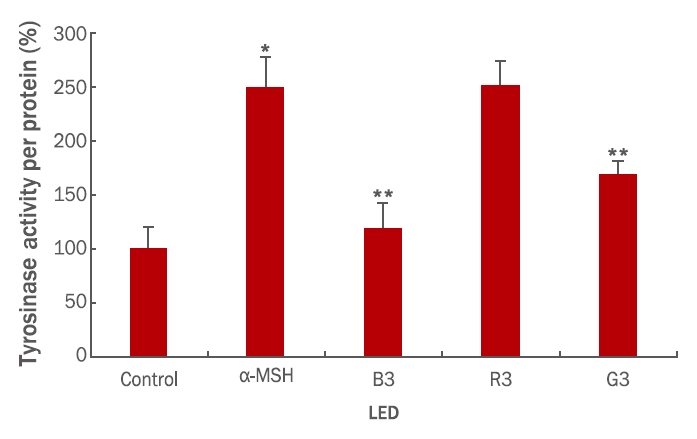
5. 가시광선(green, red, blue)조사에 의한 tyrosinase 활성 변화 확인
녹색, 적색, 청색 계열 LED를 조사는 멜라닌 함량을 변화시키지 않았으나 멜라닌의 생합성에 중요한 기전으로 작용하는 tyrosinase 활성의 변화를 측정한 후 그 결과를 Figure 5에 나타내었다. α-MSH를 처리한 후 녹색, 적색, 청색 계열 LED를 72 h동안 처리하였고, tyrosinase 활성을 측정하였다. 동시에 96 well plate에서 단백질 양을 측정함으로써 단백질 당량당 tyrosinase 활성으로 환산하여 백분율로 표시한 결과 α-MSH 처리에 의한 tyrosinase 활성은 앞의 그림과 마찬가지로 150% 가량의 증가를 관찰할 수 있었다. 이에 반해 녹색, 적색, 청색 계열 LED를 조사한 결과, 청색 파장 LED를 조사한 경우 tyrosinase 활성은 거의 음성대조군 수준으로 감소된 것을 확인할 수 있었고(p<0.01), 그 다음으로 녹색 계열의 파장이 유의하게 tyrosinase 활성이 감소된 것을 확인할 수 있었다. 이에 반해, 적색 계열의 가시광선 파장의 조사는 α-MSH 에 의해 유도된 tyrosinase 활성의 증가의 변화가 관찰되지 않았다. 이러한 결과는 청색 계열의 파장과 녹색 계열의 파장은 α-MSH에 의해 유도된 tyrosinase 활성 증가를 일으키는 세포 내 신호전달 기전을 차단하였다는 것을 증명하고 있다. 특히 청색 계열의 가시광선 파장은 음성대조군 수준까지 효소 활성을 감소시키는 것으로 보아 광 조사 시간의 조절 및 구체적인 연구가 필요할 것으로 판단된다. 그러나 적색 가시광선 파장은 α-MSH 에 의해 유도된 tyrosinase 활성을 변화시키지 않는 것으로 보아 특정 파장만이 세포에 작용하여 효소 활성을 변화시키는 것으로 판단할 수 있었다. 이 결과는 660 nm LED가 B16F10 세포에서 α-MSH에 의해 유도된 tyrosinase 활성을 억제했다고 보고한 Oh et al. (2017)와 830 nm와 850 nm LED에서 멜라닌생성 및 tyrosinase 활성을 억제했다고 보고한 Kim et al. (2012)의 결과와는 반대의 결과가 나왔다. 그러나 이 결과는 저장식품의 갈변 현상을 막기 위해 파랑, 초록 빨강색 LED를 조사한 연구에서 파란색 LED에서 강도가 증가할수록 tyrosinase 활성 저해효과가 증가하였고, 빨강 LED에서는 tyrosinase 활성변화 없다는 연구 결과와 일치한다(Jung et al., 2015).
6. 가시광선(green, red, blue)조사에 의한 세포내 cAMP 수준 변화 확인
녹색, 적색, 청색 계열 LED를 조사는 멜라닌의 함량은 변화시키지 않고 단지 tyrosinase의 활성만을 변화시키는 것을 확인한 후 Figure 6에 나타내었다. 멜라닌의 생합성은 세포내 cAMP를 증가시킴으로 다양한 단백질을 인산화시키고 cAMP-response element binding protein (CREB)을 경유하여 microphthalmia-associated transcription factor (MITF) 활성화를 통한 tyrosinase의 gene regulation에 참여하는 것으로 알려져 있다(Smith et al., 2000). 그렇기 때문에 세포 외부 자극에 의한 가장 상위 기전인 cAMP의 활성화를 측정하는 것이 중요하고 세포 내 cAMP함량을 측정하였다. 그 결과, α-MSH 를 72 h 동안 처리한 B16 세포는 30% 이상의 cAMP 함량이 증가되는 것을 확인할 수 있었다. 이에 반해, 청색, 녹색 계열 LED를 조사하였을 때 α-MSH에 의해 상승된 세포내 cAMP의 함량은 유의하게 감소되었음을 확인하였다. 그러나, 적색 계열 LED의 조사는 세포내 cAMP의 수준을 변화시키지 않았으며 이는 적색 가시광선 파장은 궁극적으로 tyrosinase 활성을 변화시키지 않으며 멜라닌의 생합성에 영향을 미치지 않았던 이유로 설명된다. 하지만, 앞서 제시한 멜라닌 함량변화 결과에서 본 것과 달리, 청색 또는 녹색계열 LED 조사에 의해 tyrosinase 활성과 cAMP 함량을 변화시키는 것을 확인하였는데 이러한 결과를 볼 때 일반적인 멜라닌 합성 메커니즘과 다른 기전을 통해 조절됨을 암시하고 있다.
Conclusion
가시광선(green, red, blue)조사를 위하여 세가지 단일 파장(630, 470, 525 nm)의 LED 조사장치를 활용하여 mouse 유래 B16 melanoma cell에서 멜라닌의 합성 및 조절 기전을 규명한 결과 B16 melanoma cell에서 α-MSH에 의한 멜라닌의 합성은 72 h 배양 시간에서 멜라닌의 함량 및 tyrosinase 활성이 최고로 나타났다.
녹색, 적색, 청색 계열 LED 조사는 기존의 전구와 달리 발열이 광원자체에서는 발생하지 않고 에너지 소비 효율이 월등히 높아 열에 의한 손상은 없었음을 확인하였고, 각 파장에 의한 내재적인 세포 독성은 관찰되지 않았다.
녹색, 적색, 청색 계열 LED를 조사를 통해 멜라닌의 함량을 조절하는지를 확인하였을 때 각 파장의 광원 조사는 멜라닌 함량에 유의한 변화를 보이지 않았으나. 청색 계열 및 녹색 계열의 파장은 tyrosinase 활성 감소를 일으켜 청색 계열 및 녹색 계열의 파장이 α-MSH에 의해 유도된 tyrosinase 활성 증가를 일으키는 세포 내 신호전달 기전을 차단하였다는 것을 알 수 있었다.
녹색, 적색, 청색 계열 LED를 조사가 tyrosinase의 활성 조절 및 멜라닌 합성에 관여하는 protein kinase A에 관여하는 인자인 cAMP의 형성에도 청색 및 녹색 파장이 억제 효과를 가지는 것으로 확인되었다. 이 결과는 청색 계열의 파장과 녹색 계열의 파장은 α-MSH에 의해 유도된 tyrosinase 활성 증가를 일으키는 세포 내 신호전달 기전인 protein kinase A cascade를 cAMP를 억제함을 통해 차단하였다는 것을 증명하고 있다.
본 연구는 에너지 효율이 높고 파장 선택성이 우수한 LED를 사용하여 B16 melanoma cell에서 멜라닌의 합성에 미치는 다양한 신호전달 기전을 조절하는 것을 확인하였고, 향후 미백 및 향장 미용 산업에서 응용 가치가 높은 기초적인 지식과 심도 깊은 응용 분야를 제공할 수 있을 것으로 기대한다.