요약목적본 연구에서는 화장품 소재로서 Brassica juncea L. Czern.의 잎과 종자 추출 혼합물의 생리활성을 확인하고, 반응표면분석법(RSM)을 이용하여 최적혼합비율을 도출하고자 하였다.
방법항산화, 미백, 항주름 효능이 최대로 발현되는 최적혼합비를 도출하기 위해 잎(X1)과 종자(X2) 추출물의 함량을 독립변수로, 총 폴리페놀 함량, 총 플라보노이드 함량, DPPH radical 소거능, ABTS radical 소거능, tyrosinase 저해활성 및 elastase 저해활성을 종속변수로 설정하였다.
AbstractPurposeThis study aimed to investigate the physiological activity of mustard (Brassica juncea L. Czern.) leaf and seed extracts as a cosmetic material, and optimization the mixing ratio using response surface methodology (RSM).
MethodsOptimal conditions for RSM were determined the ratio of mustard leaf (X1) and seed (X2) extracts as the independent variable, and total polyphenol content, total flavonoid content, DPPH radical scavenging activity, ABTS radical scavenging activity, tyrosinase inhibitory activity and elastase inhibitory activity was determined as the dependent variable.
ResultsOptimal mixing ratio with maximum antioxidant, whitening, and anti-wrinkle effects was determined as 3.28 (4.10 mg/mL) for leaves and 4.21 (5.26 mg/mL) for seeds. The DPPH radical and ABTS radical scavenging activities, tyrosinase and elastase inhibitory activities was predicted to be 80.01%, 58.50%, 22.11%, 53.88%, respectively. In addition, when the mixture was treated in LPS-induced RAW264.7 cells, NO production was inhibited by about 41% compared to the control group, and no cytotoxicity was observed.
中文摘要方法 确定RSM的最佳条件,以芥菜叶(X1)和种子(X2)提取物的比例为自变量,以总多酚含量、总黄酮含量、DPPH自由基清除活性、ABTS自由基清除活性、酪氨酸酶抑制活性和弹性蛋白酶抑制活性被确定为因变量。
Introduction갓(Brassica juncea L.)은 십자화과(Brassicaceae)에 속하는 경엽채소류 중 하나로 겨자의 잎(mustard leaf)을 말하며, 백겨자(white mustard), 황겨자(yellow mustard) 및 흑겨자(brown-black mustard) 3종이 있다. 그 중 흑겨자는 배당체 sinigrin이 myrosinase에 의해 가수분해되어 방향성 물질인 allyl isothiocyanate와 glucose 및 potassium hydrogen sulfate를 생성하는데, isothiocyanate는 강한 항균성이 있는 것으로 알려져 있다(Seo et al., 1996).
Brassica 속 식물은 α-tocopherol, ascorbic acid, carotenoids, phenolic acids 및 flavonoids가 풍부하여 면역체계를 보호하고, reactive oxygen species (ROS)를 중화하는 등 항산화 효능이 우수한 것으로 알려져 있다(Ayadi et al., 2022). 또한 Brassica 속 식물의 glucosinolate 및 polyphenol 성분들은 생리활성 물질로 많이 연구되었으며, 이외에 함황 성분들이 풍부하여 항산화, 항암, 항균 및 면역 등 다양한 연구를 통해 그 효능이 입증된 바 있다(Kumar et al., 2011; Jang et al., 2016; Yahaghi et al., 2018).
십자화과에 속하는 브로콜리, 양배추, 청경채, 케일 및 콜라비를 대상으로 한 tyrosinase 억제 효능 뿐만 아니라 최근에는 화합물 phytoalexins에 속하는 brassinin의 tyrosinase 억제 및 tyrosinase 발현조절 등 피부 색소침착을 예방하기 위한 천연 tyrosinase inhibitor로 사용될 수 있는 가능성이 연구된 바 있다(Jung et al., 1995; Lee et al., 2023).
또한 십자화과 채소에서 생산되는 황 함유 식물 화학물질인 7-methylsulfinylheptyl isothiocyanate 화합물이 마우스 흑색종(B16-F1) 세포에서 멜라닌 생성을 억제하고, 멜라닌 생성 관련 단백질 발현을 하향 조절하는 것으로 보고되었고, 브로콜리(B. oleracea. var. italica) 종자와 sulforaphane과 같은 화합물의 항산화 효능 등 십자화과 채소 유래 화합물의 기능성에 대한 연구도 강조되고 있다(Kim et al., 2021; Ayadi et al., 2022).
이처럼 브로콜리, 콜라비, 콜리플라워 등 십자화과 채소의 항산화, 항균, 항암 및 면역 등의 생리활성 연구가 꾸준히 진행되어왔을 뿐만 아니라 분리 화합물의 tyrosinase 억제 및 멜라닌 생성 억제 등 화장품 소재로서 충분한 가능성이 확인된 바 있으나, 현재까지 기능성 화장품 소재로서 국내 돌산 갓의 잎과 종자에 대한 생리활성 연구는 미비하다. 따라서 본 연구는 Lee & Kim (2020)의 잎과 종자 추출물의 생리활성 연구를 바탕으로 반응표면분석법(response surface methodology, RSM)의 central composite design (CCD)을 이용하여 항산화, 미백, 항주름 활성이 최대로 발현되는 최적혼합비율을 도출하고, 세포독성 및 항염증 효능을 평가하여 화장품 소재로서 이용가치를 규명하고자 하였다.
Materials & Methods1. 실험재료본 연구에 사용된 갓(mustard leaf, Brassica juncea L. Czern.)은 전라남도 여수시 돌산읍에 위치한 재배지에서 2018년 9월 28일 파종(늦동이 종자: Neujdongi)하여 2019년 1월 25일에 수확한 신선한 갓을 선별하여 재료로 사용하였다.
2. 추출물 제조갓의 잎과 종자 시료를 각각 70% ethanol에 50 g/L이 되도록 하여 72 h 동안 상온에서 추출 후, 흡인여과기에 3회 여과(No. 2, Whatman, Maidstone, England)하여 추출액을 얻었다. 얻어진 추출액은 vacuum rotary evaporator (진공감압농축기; N-1110, EYELA, Tokyo, Japan)로 추출 용매를 제거 후 농축하였으며, 최종 농도가 1.25 mg/mL인 시료를 실험에 사용하였다.
3. 실험 디자인잎과 종자 추출물의 최적 혼합비율을 도출하기 위한 실험설계는 Design Expert 10 (Stat-Ease Inc., Minneapolis, MN, USA) 프로그램을 사용하였으며, 반응표면분석법(RSM)의 중심합성계획법(central composite design, CCD) 설계에 따라 12개의 실험점을 설정하였다. 독립변수는 잎(A, X1), 종자(B, X2) 추출물의 함량으로 하여, 각 요인의 최소 및 최대 범위를 1-4 (ratio)로 설정하였다. 종속변수는 총 폴리페놀 함량, 총 플라보노이드 함량, DPPH radical 소거능, ABTS radical 소거능, tyrosinase 저해활성, elastase 저해활성으로 설정하였다. 실험설계에 따른 실험점은 Table 1에 제시된 바와 같다.
4. 총 폴리페놀 함량 측정총 폴리페놀 함량 측정에는 Singleton & Rossi (1965)의 방법을 참고하여 측정하였다. 시료 350 µL에 50% Folin-Ciocalteu 시약 70 µL를 가하여 3 min간 정치 후, 2% (w/v) sodium carbonate 350 µL를 첨가하여 1 h 반응시켰으며, ELISA microplate reader (Infinite M200 pro Nanoquant; Tecan Austria GmbH, Austria)를 이용하여 750 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 tannic acid를 표준물질로 하여 얻은 표준 검량선(R2=1)을 기준으로 시료의 총 페놀 함량을 tannic acid equivalents (mg TAE/mL)로 나타냈다.
5. 총 플라보노이드 함량 측정총 플라보노이드 함량 측정에는 Davis (1947)의 방법을 참고하여 측정하였다. 시료 70 µL에 diethylene glycol 700 µL와 1N-sodium hydroxide 7 µL를 첨가하여 37℃에서 1 h 반응시킨 후, microplate reader (Tecan, Austria)를 이용하여 420 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 quercetin을 표준물질로 하여 얻은 표준 검량선(R2=0.9989)을 기준으로 시료의 총 플라보노이드 함량을 quercetin equivalents (mg QE/mL)로 나타냈다.
6. DPPH radical 소거능 측정DPPH (1,1-diphenyl-2-picrylhy-drazyl; Sigma-Aldrich, USA) radical 소거능은 Blois (1958)의 방법을 참고하여 측정하였다. 시료 100 µL와 1.5×10-4 M DPPH 용액 100 µL를 혼합하여 실온의 암실에서 30 min간 정치한 후, microplate reader (Tecan, Austria)를 이용하여 517 nm에서 흡광도를 측정하였으며, 소거활성은 다음의 식을 이용하여 산출하였다.
DPPH radical scavenging activity (%)=(Ac-As)/Ac×100
Ac: DPPH용액의 흡광도
As: DPPH용액과 시료를 혼합한 반응용액의 흡광도
7. ATS radical 소거능 측정ABTS (2,2'-azino-bis-3-ethylbenzo-thiazoline-6-sulfonicacid; Sigma-Aldrich) radical 소거능은 Pellegrin et al. (1998)의 방법으로, ABTS 7.4 mM과 potassium persulfate 2.6 mM을 혼합하여 암실에서 24 h 반응시킨 후, 732 nm에서 흡광도가 0.70±0.03이 되도록 phosphate-buffered saline (PBS)로 희석하였다. 이후 시료 10 µL와 ABTS 용액 190 µL를 혼합하여 60 min간 정치한 후 microplate reader (Tecan)를 이용하여 732 nm에서 흡광도를 측정하였으며, 소거활성은 다음의 식을 이용하여 산출하였다.
ABTS radical scavenging activity (%) = (Ac-As)/Ac×100
Ac: ABTS용액의 흡광도
As: ABTS용액과 시료를 혼합한 반응용액의 흡광도
8. Tyrosinase 저해활성 측정Tyrosinase 저해활성은 Tomita et al. (1990)의 방법을 참고하여 측정하였다. L-tyrosine으로부터 tyrosinase 효소작용에 의해 생성되는 DOPA 생성을 측정하는 방법으로 100 mM PBS (pH 6.8) 115 µL와 mushroom tyrosinase (300 U/mL) 20 µL을 혼합하여 37℃에서 15 min preheating 하였다. 이후 10 mM L-tyrosine 15 µL와 시료 40 µL을 가하여 37℃에서 25 min간 반응 후 DOPA chrome의 생성여부를 통해 tyrosinase 효소에 대한 저해활성을 확인하였다. Tyrosinase 저해활성은 microplate reader (Tecan)를 이용하여 흡광도 475 nm에서 측정하였으며, 다음의 식을 이용하여 산출하였다.
Tyrosinase inhibitory activity (%)=[1-{[(As-AsB)/(Ac-AcB)]}×100
As: 효소와 시료를 혼합한 반응용액의 흡광도
AsB: 시료만 첨가한 반응용액의 흡광도
Ac: 효소만 첨가한 반응용액의 흡광도
AcB: 효소와 시료를 혼합하지 않은 용액의 흡광도
9. Elastase 저해활성 측정Elastase 저해활성은 Kraunsoe et al. (1996)의 방법을 참고하여 측정하였다. 200 mM Tris-HCl buffer (pH 8.0) 25 µL에 procine pancreatic elastase (PPE) 30 µL를 혼합하여 15 min간 preheating하였다. 이후 Tris-HCl buffer 1 mL에 N-succinyl-ala-ala_ala-p-nitroanilide 5 mg을 첨가한 기질액 25 µL 및 시료 40 µL를 혼합하여 25℃에서 25 min간 반응시켜 elastase 효소에 대한 저해활성을 확인하였다. Elastase 저해활성은 microplate reader (Tecan, Austria)를 이용하여 흡광도 410 nm에서 측정하였으며, 다음의 식을 이용하여 산출하였다.
Elastase inhibitory activity (%)=[1-[(As-AsB)/(Ac-AcB)}]×100
As: 효소와 시료를 혼합한 반응용액의 흡광도
AsB: 시료만 첨가한 반응용액의 흡광도
Ac: 효소만 첨가한 반응용액의 흡광도
AcB: 효소와 시료를 혼합하지 않은 용액의 흡광도
10. 세포배양한국세포주 은행(Korea Cell Line Bank: KCLB, Seoul, Korea)으로부터 분양받은 RAW 264.7 세포를 사용하였다. RAW 264.7세포는 dulbecco's modified eagle's medium (DMEM)에 10% fetal bovine serum, 100 unit/mL penicillin, 100 µg/mL streptomycin을 첨가하여 37℃, 5% CO2 조건의 humidified incubator에서 배양 후 사용하였으며, 세포배양에 사용한 모든 시약은 Hyclone (Logan, USA)에서 구입하여 사용하였다.
11. Cell viability 측정시료 첨가에 따른 세포생존율 측정은 CellTiter 96 AQueous One Solution Cell Proliferation Assay kit (CTB169; Promega, USA)를 사용하여 측정하였다. MTS [(3-(4,5-dimethylthia-zol-2- yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium)]분석은 mitochondrial dehydrogenase에 의하여 MTS가 formazan으로 전환되는 것을 이용한 방법으로 Desai et al. (2008)의 방법을 이용하여 확인하였다. RAW 264.7 세포를 96 well plate에 3.0×104 cell/well로 분주하고 24시간 동안 CO2 배양기에서 안정화하여 동일한 양의 시료를 각각의 well에 1 h 처리하였다. 이후, LPS (lipopolysaccharide, Sigma) 500 ng/mL을 처리 후 24 h 배양하였으며, MTS를 각 well에 첨가하여 37℃에서 2 h 반응시킨 후 microplate reader (Tecan, Austria)를 이용하여 490 nm에서 흡광도의 변화를 측정하여 세포생존율을 확인하였다.
12. Nitric oxide 생성억제 측정Nitric oxide 생성억제는 Ryu et al. (2003)의 방법을 참고하여 측정하였다. DMEM 배지가 포함된 24 well plate에 RAW 264.7 세포를 5.0×104 cell/well로 분주하여 24 h배양 후, 시료를 처리하였으며, 이후 500 ng/mL의 LPS를 처리하여 24 h 동안 배양한 후 상등액 100 µL에 Griess reagent (Sigma-Aldrich) 100 µL를 첨가하여 10 min간 상온에서 반응시킨 후 microplate reader (Tecan)를 이용하여 540 nm에서 흡광도를 측정하여 NO 생성량을 확인하였다.
Results & Discussion1. 모델의 적합성갓(Brassica juncea L. Czern.)의 잎(A, X1), 종자(B, X2) 추출물 함량을 독립변수로 하여, 혼합물의 생리활성 평가에 대한 회귀분석 결과를 Table 2에 제시하였다. 생리활성 측정값은 p값이 0.1 이상인 인자들은 10% 유의수준에서 후방 소거법(backward elimination)을 실시하여 제거하였다. 회귀식의 적합성을 나타내는 총 폴리페놀과 총 플라보노이드 함량의 결정계수(R2)는 각각 0.9987, 0.9949, DPPH radical 소거능과 ABTS radical 소거능은 각각 0.9852, 0.9907, tyrosinase 저해활성과 elastase 저해 활성은 각각 0.9265, 0.6449로 나타나, elastase 저해활성을 제외한 5가지 종속변수에서는 실험값에 대한 높은 신뢰도를 보여 적합성이 확인되었다. 반면, elastase 저해활성은 R2 값이 0.6449로 65% 수준의 신뢰도를 나타냈다. 표준화 잔차의 정규 확률 그래프(normal plot of residuals)에서 오차는 정규 분포를 따르므로 선택모델의 적합성이 높은 것으로 볼 수 있으며, 예측 값과 표준화 잔차의 산점도(residuals vs. predicted)에서는 ±3.5이내의 수평 밴드 내에 대체적으로 퍼져 있어 오차가 등분산성을 만족하기 때문에 선택된 모형은 적절하다고 볼 수 있다(Figure 1-3). 또한 p-value는 모두 p<0.01로 통계적으로 유의한 결과가 나타나 유의성이 인정되었다.
2. 총 폴리페놀 및 총 플라보노이드 함량RSM에 의해 설계된 12개의 갓의 잎(A, X1), 종자(B, X2) 추출 혼합물의 총 폴리페놀 및 총 플라보노이드 함량 측정 결과는 Table 3과 같다. 총 폴리페놀 함량은 10.02-26.41 mg TAE/g 범위의 값을 보였으며, 잎(X1)과 종자(X2) 추출물을 각각 5 mg/mL로 한 혼합물에서 26.41 mg TAE/g으로 가장 높은 수치가 나타났다. 도출된 회귀식(19.18+2.58A+5.65B-0.60B2)은 p<0.01로 확인되어 통계적으로 유의하였고, R2는 0.9987로 적합성이 인정되었다.
총 플라보노이드 함량은 34.67-113.89 mg QE/g 범위의 값을 보였으며, 잎(X1) 추출물 3.13 mg/mL, 종자(X2) 추출물 5.78 mg/mL로 혼합한 샘플에서 가장 높은 수치가 나타났다. 도출된 회귀식(75.93+11.27A+27.18B) 또한 p<0.01로 확인되어 통계적으로 유의한 결과를 보였으며, R2는 0.9949로 적합성이 인정되었다.
회귀식(equation)을 통해 독립변수 잎(X1)과 종자(X2) 추출 혼합물의 변화에 따른 총 폴리페놀 및 총 플라보노이드 함량의 변화는 perturbation plot과 3D response surface model graph로 확인하였고, 3차원 그래프를 Figure 4에 나타내었다. 결과적으로 잎(X1)과 종자(X2) 추출 혼합물의 함량이 많아질수록 총 폴리페놀 및 총 플라보노이드 함량이 높아지는 양의 상관관계를 보이며, Figure 4 (a)와 Figure 4 (b)의 perturbation plot을 통해, 잎(X1)보다 종자(X2) 추출물의 함량에 더 영향을 받는 것을 알 수 있다.
페놀 화합물은 추출농도, 용매 및 추출방식 뿐만 아니라 재배방식 및 수확시기 등 환경적 요인에도 달라질 수 있으나(Kim et al., 2014), 선행된 돌산 갓의 잎과 종자 추출물의 페놀함량 및 플라보 노이드 함량 결과와 비교하였을 때, 본 연구결과와 유사한 것으로 확인되었다(Oh et al., 2016; Lee, 2017).
3. DPPH radical 및 ABTS radical 소거능12개의 갓의 잎(X1), 종자(X2) 추출 혼합물의 DPPH radical 소거능 및 ABTS radical 소거능 결과는 Table 3에 제시하였다. 혼합물의 DPPH radical 소거능은 47.63-82.68% 범위의 값을 보였으며, 잎(X1)과 종자(X2) 추출물을 각각 5.78 mg/mL, 3.13 mg/mL로 한 혼합물에서 82.68%로 가장 높은 소거능을 보였다. 도출된 회귀식(68.59+6.02A+10.79B-2.40AB+1.74A2-2.36B2)은 p<0.01로 확인되어 통계적으로 유의하였고, R2는 0.9852로 적합성이 인정되었다.
ABTS radical 소거능은 24.60-60.80% 범위의 값을 보였고, 잎(X1)과 종자(X2) 추출물을 각각 3.13 mg/mL, 5.78 mg/mL로 한 혼합물에서 60.80%로 가장 높은 소거능이 확인되었다. 도출된 회귀식(44.51+6.02A+10.62B-2.12AB) 또한 p<0.01로 확인되어 통계적으로 유의하였고, R2는 0.9907로 적합성이 인정되었다.
회귀식을 통해 독립변수 잎(X1)과 종자(X2) 추출 혼합물의 변화에 따른 free radical 소거능의 3차원 그래프를 Figure 5에 나타내었다. 혼합물은 ABTS radical 소거능보다 DPPH radical 소거능이 더 우수한 것으로 나타났고, 총 폴리페놀 및 총 플라보노이드 함량의 결과와 유사하게 Figure 5 (b)의 perturbation plot을 통해, 잎(X1)보다 종자(X2) 추출물의 함량에 더 영향을 받는 것을 확인하였다.
결과적으로 잎과 종자 추출 혼합물의 양이 많을수록 총 폴리페놀 및 총 플라보노이드 함량이 높아지고 DPPH radical 소거능 및 ABTS radical 소거 효과가 높은 것으로 나타났으며, 잎보다 종자 추출물의 비율이 혼합물의 항산화 활성에 더 많은 영향을 주는 것을 알 수 있었다. Oh et al. (2016)은 잎과 종자를 acetonitrile 용매 추출하였을 때, 잎과 종자 모두 16.67%의 DPPH radical 소거능을 보고하였고, ABTS radical 소거능은 잎 50.07±0.90%, 종자 48.67±0.58%로 보고하였다. 선행연구 결과와 본 연구결과를 비교하였을 때, 혼합물에서 활성 산소를 더 효과적으로 제거할 수 있는 것으로 생각된다.
4. Tyrosinase 및 elastase 저해활성Melanin의 생합성 경로는 피부 내 melanosome의 melanocyte에서 tyrosinase가 촉매역할을 하여 L-tyrosine이 L-DOPA로 산화되고, L-DOPA는 DOPA quinone으로 전환되어 멜라닌으로 합성되면서 eumelanin과 pheomelanin 색소가 생성된다(Jung et al., 1995). 따라서 tyrosine에서 L-DOPA, L-DOPA에서 DOPA quinone의 합성을 억제하는 tyrosinase inhibitor를 통해 피부 색소침착을 예방할 수 있다(An et al., 2007; Lee et al., 2013). 또한 피부의 탄력섬유를 구성하는 성분인 elastin이 분해될 경우, 탄력이 저하되어 주름이 생성되는데, elastase는 동물의 결합조직에서 불용성 탄력섬유 elastin을 분해하는 유일한 효소로 알려져 있어 elastase inhibitor는 주름 및 피부노화를 예방할 수 있다(Lee et al., 2013; Song et al., 2017).
본 연구에서는 갓의 잎(X1)과 종자(X2) 추출물의 첨가량에 따른 혼합물의 효소 저해 활성 효능을 알아보기 위해 tyrosinase 저해 활성, elastase 저해 활성을 측정하였다. 혼합물의 tyrosinase 저해 활성은 6.82-34.79% 범위의 값을 보였다(Table 4). 잎(X1)과 종자(X2) 추출물을 각각 3.13 mg/mL로 한 혼합물에서 34.79%로 가장 높은 tyrosinase 저해활성을 보였다. 도출된 회귀식(34.18+0.50A+2.40B-11.07A2-9.27B2)은 p<0.01로 확인되어 통계적으로 유의하였고, R2는 0.9262로 적합성이 인정되었다.
Elastase 저해 활성은 25.48-54.82% 범위의 값을 보였으며(Table 4), 잎(X1)과 종자(X2) 추출물을 각각 5.00 mg/mL로 한 혼합물에서 54.82%로 가장 높은 elastase 저해활성을 보였다. 도출된 회귀식(44.74+4.55A+5.22B)은 p<0.01로 확인되어 통계적으로 유의하였고, R2는 0.6449로 다소 낮게 확인되었다.
회귀식을 통해 독립변수 잎(X1)과 종자(X2) 추출 혼합물의 변화에 따른 tyrosinase 및 elastase 저해활성의 3차원 그래프를 Figure 6에 나타내었다. 혼합물의 tyrosinase 저해활성 측정결과, 일정농도 이상의 혼합물에서는 저해활성이 감소하는 경향을 보이며, Figure 6 (a)의 perturbation plot을 통해 확인한 결과, 잎(X1)과 종자(X2) 추출물 모두 첨가량이 증가할수록 저해활성이 높아졌다가 일정수준 이상이 되면 저해활성이 감소하는 것을 확인하였다. 이러한 결과는 Jung et al (1995)이 보고한 바와 같이 tyrosinase 효소 활성에 식물 자체 내 기질이 되는 성분에 기인한 것으로 추정된다.
혼합물의 elastase 저해활성 측정결과, 위의 free radical 소거능의 결과와 유사하게 잎과 종자 추출물 모두 농도 의존적으로 저해활성이 높아지는 양의 상관관계임을 알 수 있었으며, 잎(X1) 보다 종자(X2) 추출물의 비율이 elastase 저해 활성에 상대적으로 더 많은 영향을 주는 것을 확인할 수 있었다.
본 연구 결과로 갓의 잎과 종자 추출 혼합물은 tyrosinase 저해활성 및 elastase 저해활성이 우수하여 피부 미백, 주름 예방하고 개선하는 데 도움을 주는 기능성 소재로서 가치가 있을 것으로 생각된다.
5. 추출물의 최적혼합비율 도출본 연구의 목적은 화장품 기능성 소재로서 갓의 잎과 종자 추출물의 항산화, 미백 및 항주름 효능이 우수한 최적 혼합비율을 도출하기 위함으로 본 연구의 결과를 최적혼합비율을 도출하는 데에 활용하였다(Table 3, 4). 항산화 활성 관련 지표로 총 폴리페놀 함량, 총 플라보노이드 함량, DPPH radical 소거능, ABTS radical 소거능을, 미백 활성 관련 지표로 tyrosinase 저해활성을, 항주름 관련 지표로 elastase 저해활성을 활용하였으며, 모델방정식 중 p-value가 0.01 이상이면서 R2값이 0.6이상인 항목들을 종속변수로 활용하였다. 잎(A)과 종자(B)의 범위는 0.38-4.62로 설정하였고, 6가지 종속변수 모두 goal을 maximize로 하여 항산화·미백·항주름 활성이 최대로 발현되는 최적혼합비율을 예측하고자 하였으며, 최고의 desirability를 만족하는 최적점을 선택 후, 최적 혼합 비율을 산출하였다.
Desirability 값이 최대인 0.87에서 항산화·미백·항주름 활성의 최적비율은 잎(A) 3.28, 종자(B) 4.21로 확인되었으며(Figure 7), 이때의 농도는 각각 4.10 mg/mL, 5.26 mg/mL로 산출되었다. 도출된 최적혼합비율의 총 폴리페놀 함량은 26.18 mg TAE/g, 총 플라보 노이드 함량은 112.82 mg QE/g, DPPH radical 소거능은 80.01%, ABTS radical 소거능은 58.50%로 예측되었고, tyrosinase 저해 활성은 22.11%, elastase 저해 활성은 53.88%로 예측되었다(Figure 8).
6. Cell viability본 연구결과에서 도출한 잎과 종자 최적혼합물의 안전성을 확인하기 위해 세포독성을 측정하여 세포생존율(cell viability)로 제시하였다. 잎과 종자 추출물을 각각 4.10 mg/mL, 5.26 mg/mL로 혼합한 혼합물을 농도별로 처리하였을 때, 저농도 부터 각각 102.4±4.82%, 109.4±7.17%, 107.2±6.14%로 확인되었으며(Figure 5), LPS만 단독처리한 대조군과 비교하여(108.0±9.14%) 혼합물 처리에 따른 세포독성은 관찰되지 않았다. 이와 같은 결과는 본 연구 시료인 갓의 잎과 종자 추출 혼합물을 화장품 소재로 활용하기에 안전할 것으로 판단된다.
7. Nitric oxide 생성 억제Nitric oxide (NO)는 인체의 염증 유발에 관여하는 물질로 nitrite oxide synthase (NOS)에 의해 생성된다. 세포독성이 없음을 확인한 혼합물을 RAW 264.7 세포에 처리하고 염증 유발물질인 LPS를 처리하여, 세포로부터 생성되는 NO에 대한 혼합물의 억제효과를 확인하고자 하였다. 잎과 종자 추출물을 각각 4.10 mg/mL, 5.26 mg/mL로 혼합한 혼합물(1)을 처리하였을 때 NO level은 9.43±1.16 µM로 확인되어, 약 41.17%의 NO 생성억제를 보였다(Figure 10). 따라서 본 연구 시료인 갓의 잎과 종자 추출 혼합물은 NO 생성을 효과적으로 억제하여 항염증 효능이 우수할 것으로 판단된다.
Conclusion본 연구에서는 화장품 소재로서 갓(Brassica juncea L. Czern.)의 잎과 종자 추출 혼합물의 생리활성을 확인하고, 반응표면분석법(RSM)을 이용하여 항산화·미백·항주름 효능이 최대로 발현되는 최적 혼합비를 도출하였다. 최적혼합비는 잎 3.28, 종자 4.21로 확인되었고, 이때의 농도는 각각 4.10 mg/mL, 5.26 mg/mL로 산출되었다. 도출한 최적혼합물의 총 폴리페놀 함량은 26.18 mg TAE/g, 총 플라보노이드 함량은 112.82 mg QE/g, DPPH radical 소거능은 80.01%, ABTS radical 소거능은 58.50%로 예측되었고, tyrosinase 저해 활성은 22.11%, elastase 저해 활성은 53.88%로 예측되었다. 또한 LPS로 염증을 유발시킨 RAW264.7 세포에 혼합물을 처리하였을 때, 대조군 대비 약 41%의 NO 생성을 억제하였으며, 세포독성은 없는 것으로 나타나 안전할 것으로 판단된다. 따라서, Brassica juncea L. Czern.의 잎과 종자 추출 혼합물은 항산화, 미백, 항주름 및 항염증 효능이 우수하여 피부미백과 주름을 예방하고 개선하는 데에 도움을 주며, 본 연구는 화장품 소재 연구에 기초자료로 활용될 수 있을 것으로 생각된다.
NOTESAuthor's contribution
JEL as the first author, contributed to all aspects of analysis and experimental design, and wrote the manuscript. AJK as the second author, contributed to all the experimental design in detail and correcting the errors directly.
Author details
Jeong-Eun Lee (Graduate student), Department of Alternative Medicine, Kyonggi University, 24, Kyonggidae-ro 9 gil, Seodaemun-gu, Seoul 03746, Korea; Ae-Jung Kim (Professor), Department of Nutrition Therapy, Graduate School of Alternative Medicine, Kyonggi University, 24, Kyonggidae-ro 9 gil, Seodaemun-gu, Seoul 03746, Korea.
Figure 1.Normal plot of residuals and residuals vs. predicted plot on total polyphenol content (a) and total flavonoid content (b) of mustard (Brassica juncea L.) leaf (X1) and seed (X2). 
Figure 2.Normal plot of residuals and residuals vs. predicted plot on DPPH radical scavenging activity (a) and ABTS radical scavenging activity (b) of mustard (Brassica juncea L.) leaf (X1) and seed (X2). 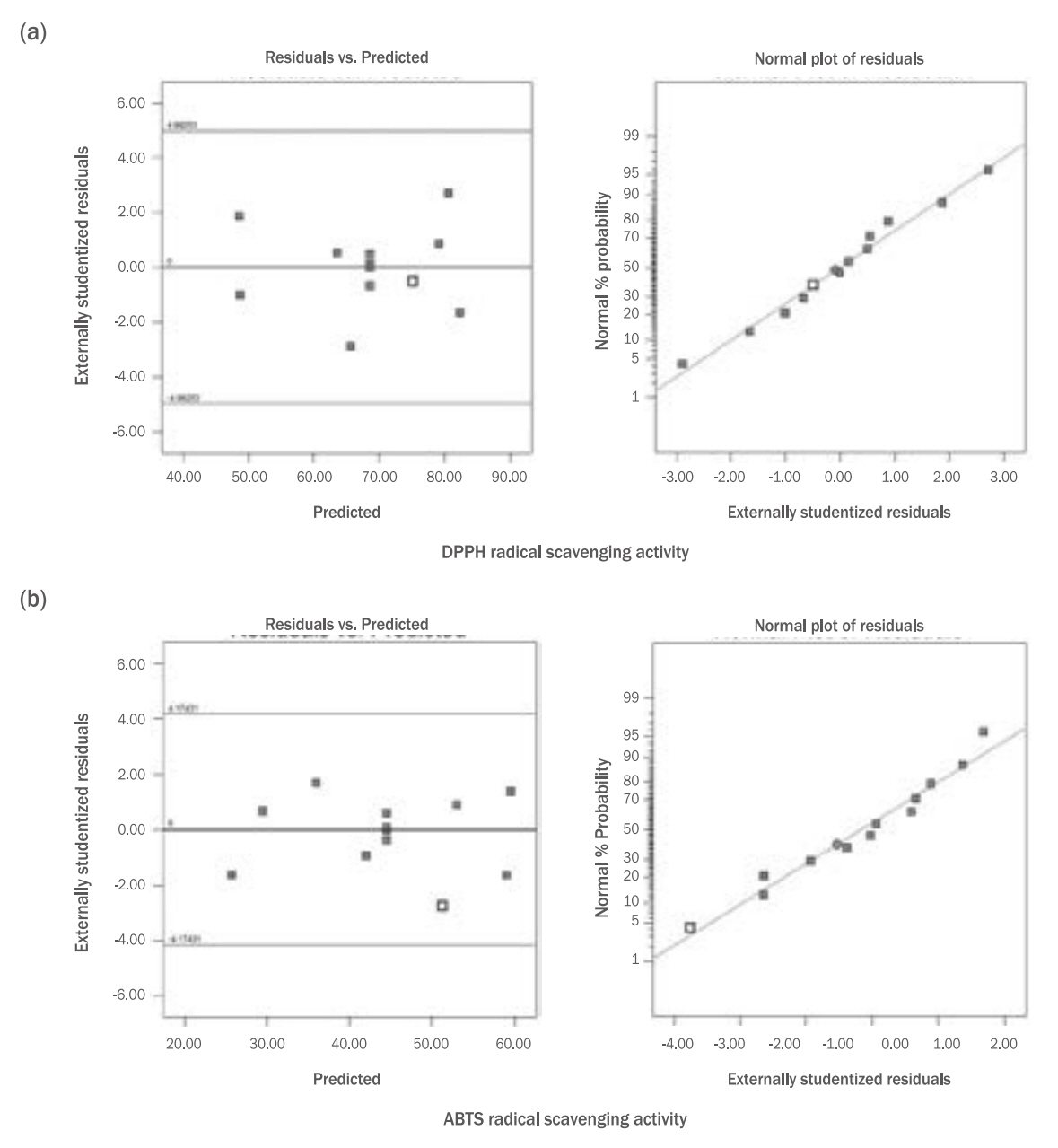
Figure 3.Normal plot of residuals and residuals vs. predicted plot on tyrosinase inhibitory activity (a) and elastase inhibitory activity (b) of mustard (Brassica juncea L.) leaf (X1) and seed (X2). 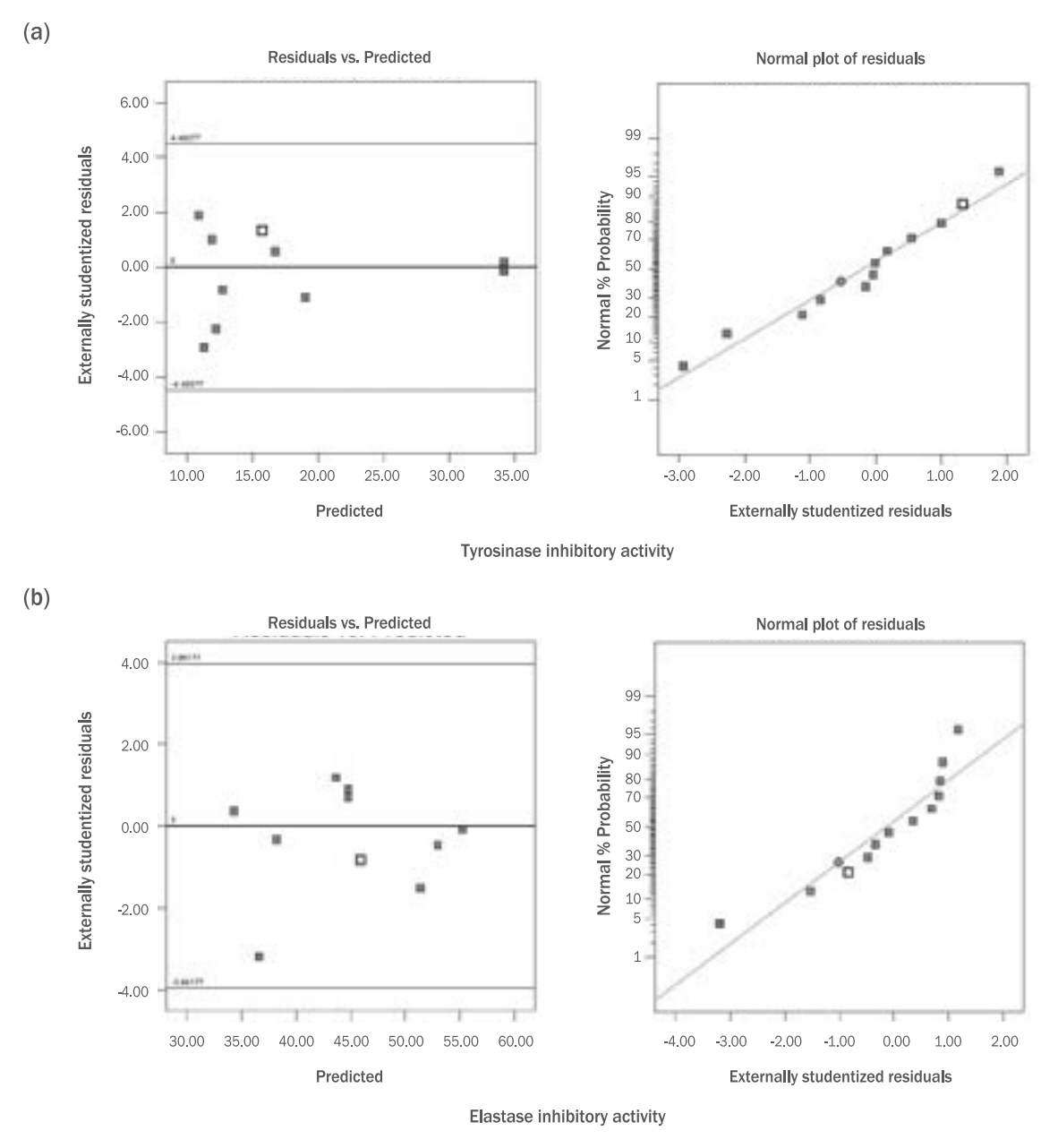
Figure 4.Perturbation plot and 3D response surface model graphs on total polyphenol content (a), total flavonoid content (b) of mustard (Brassica juncea L. Czern.) leaf (X1) and seed (X2). 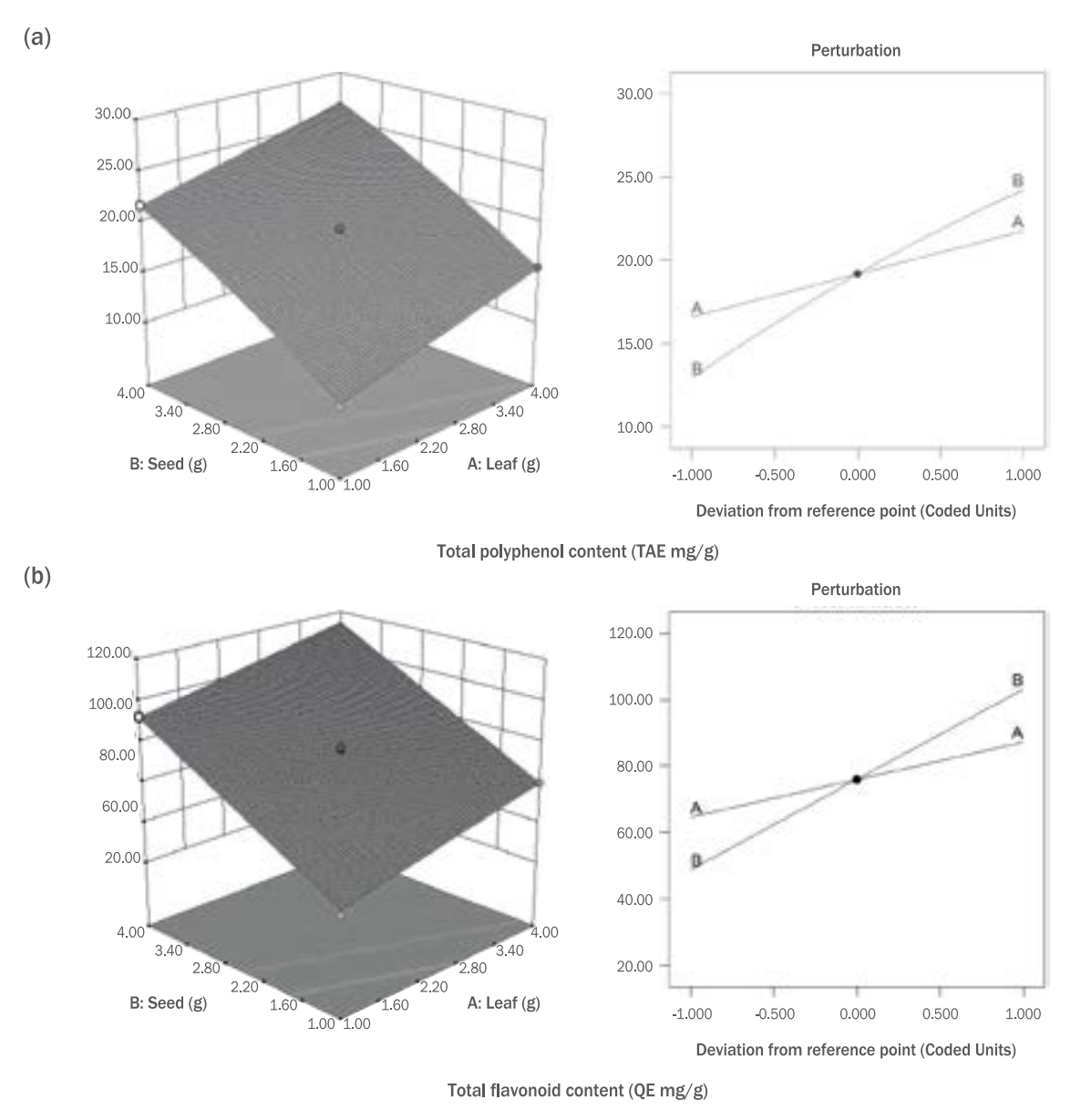
Figure 5.Perturbation plot and 3D response surface model graphs on DPPH radical scavenging activity (a), ABTS radical scavenging activity (b) of mustard (Brassica juncea L. Czern.) leaf (X1) and seed (X2). 
Figure 6.Perturbation plot and 3D response surface model graphs on tyrosinase inhibitory activity (a), elastase inhibitory activity (b) of mustard (Brassica juncea L. Czern.) leaf (X1) and seed (X2). 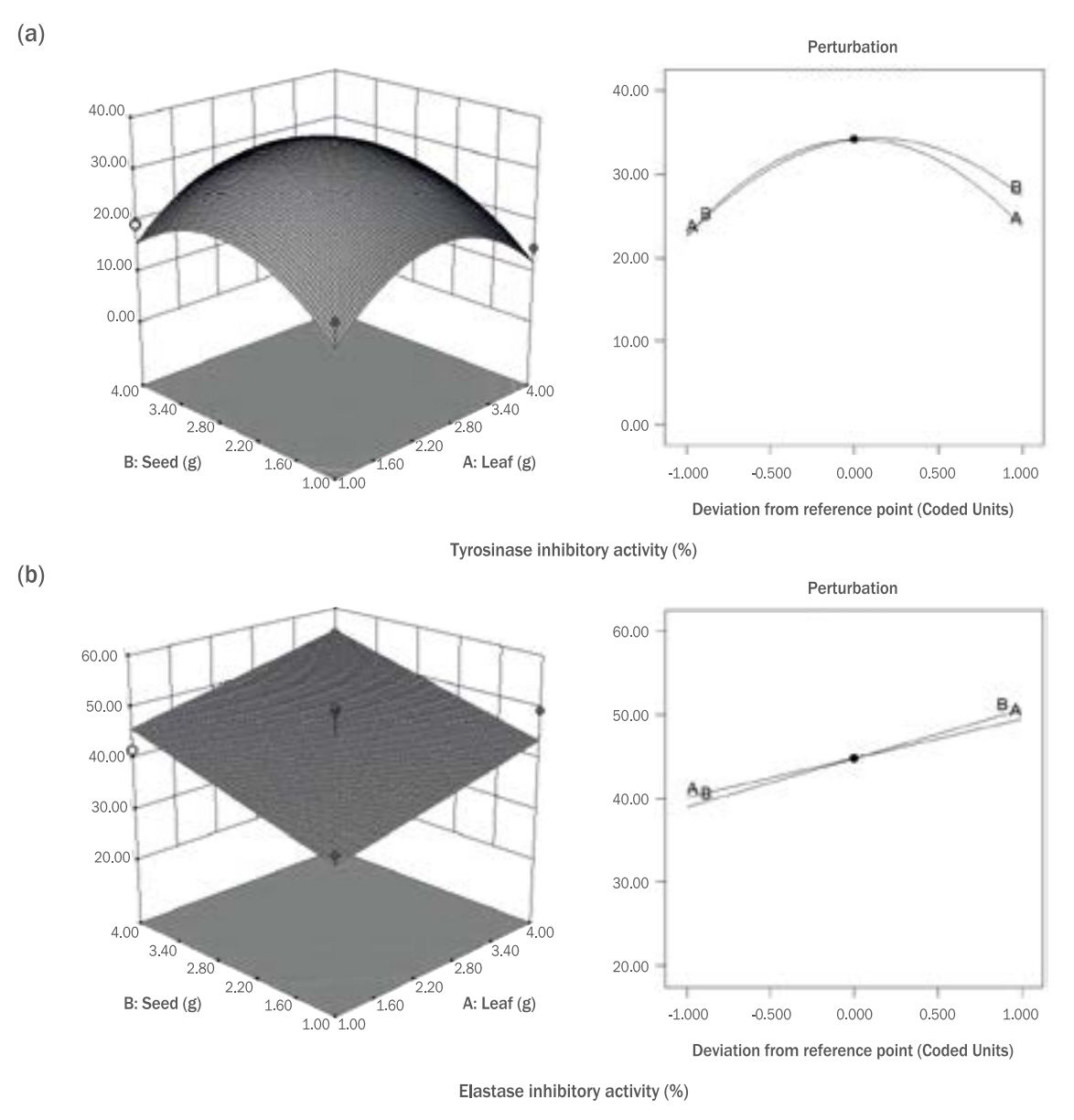
Figure 7.Perturbation plot and 3D response surface model graphs on the antioxidant, tyrosinase inhibitory activity and elastase inhibitory activity of mustard (Brassica juncea L. Czern.) leaf (X1) and seed (X2). 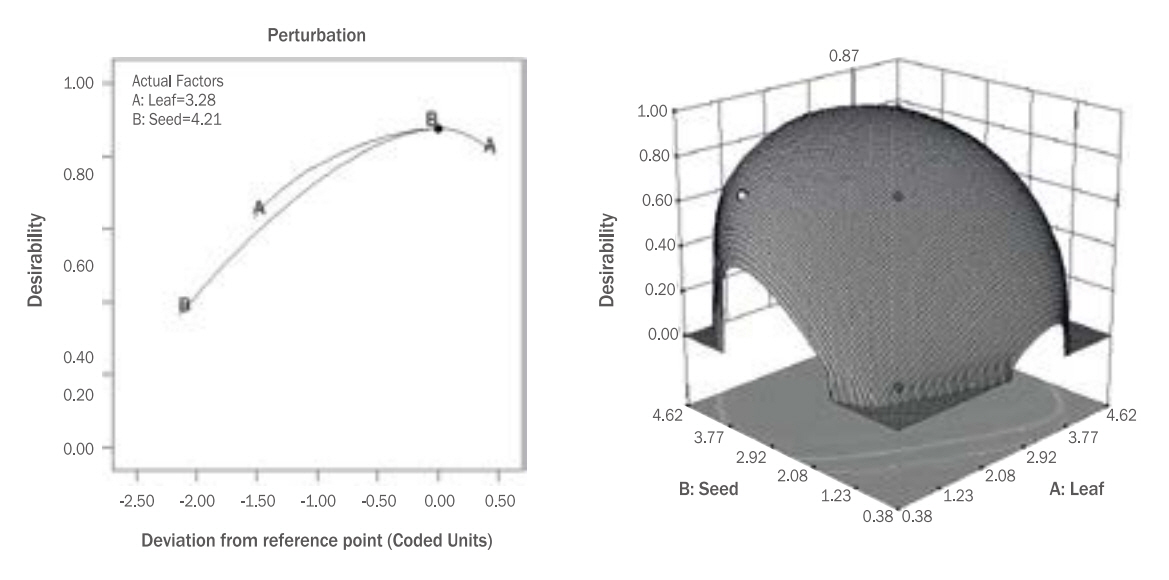
Figure 8.Overlay plot of optimized of mustard (Brassica juncea L. Czern.) leaf (X1) and seed (X2) on the antioxidant, tyrosinase inhibitory activity and elastase inhibitory activity. 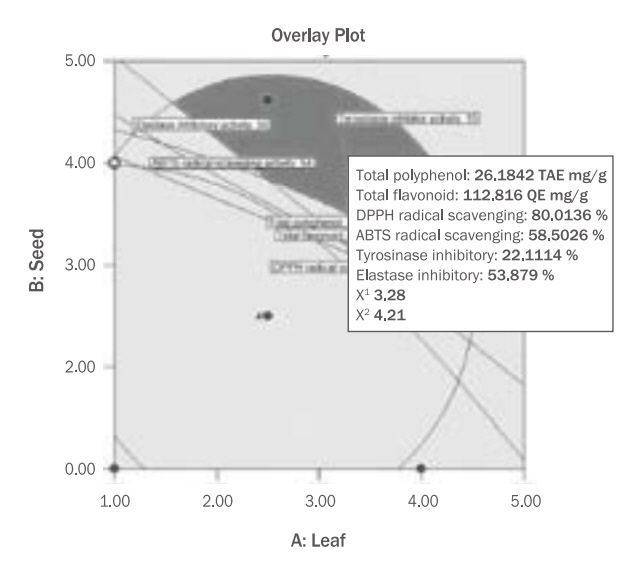
Figure 9.Cell viability effects of mustard (Brassica juncea L. Czern.) leaf and seed mixture extract in RAW 264.7
Brassica juncea leaf and seed mixture extracts were treated with different concentrations. Data are presented as means±SD (n=3). NS, not significant.
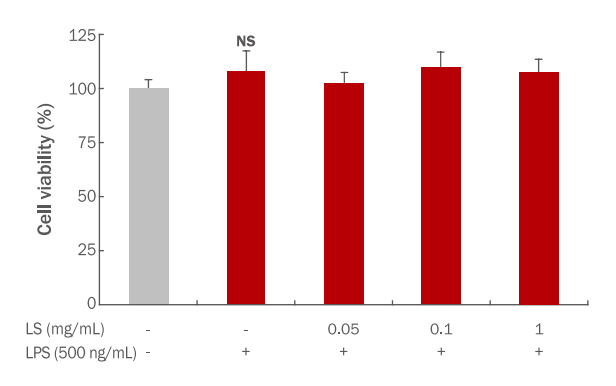
Figure 10.Inhibitory effect of nitric oxide production of mustard (Brassica juncea L. Czern.) leaf and seed mixture extract in RAW 264.7 cells.
Brassica juncea leaf and seed mixture extracts were treated with different concentrations. Data are presented as means±SD (n=3). **p<0.01, significant difference between control and LS by student’s t-test.

Table 1.The experimental design for physiological activities prepared with different mixture ratio of mustard (Brassica juncea L.) leaf (A, X1) and seed (B, X2) by response surface method
Table 2.Analysis of predicted model equation for physiological activities of mustard (Brassica juncea L.) leaf (X1) and seed (X2)
Table 3.Antioxidant activities of mustard (Brassica juncea L.) leaf (X1) and seed (X2) according to the different ratio
Table 4.Tyrosinase and elastase inhibitory activities of mustard (Brassica juncea L.) leaf (X1) and seed (X2) according to the different ratio
ReferencesAn IS, Kim JH, Yoo HS, Zhang R, Kang SM, Choe TB, Kwon TJ, An SK, Kim GY. The inhibition effect of L-cysteine on melanogenesis in B16F10 mouse melanoma cells. Asian Journal of Beauty and Cosmetology 5: 247-254. 2007.
Ayadi J, Debouba M, Rahmani R, Bouajila J. Brassica genus seeds: A review on phytochemical screening and pharmacological properties. Molecules 27: 6008. 2022.
Blois MS. Antioxidant determination by the use of a stable free radical. Nature 181: 1199-1200. 1958.
Desai A, Vyas T, Amiji M. Cytotoxicity and apoptosis enhancement in brain tumor cells upon coadministration of paclitaxel and ceramide in nanoemulsion formulations. Journal of Pharmaceutical Sciences 97: 2745-2756. 2008.
Jang HL, Park SY, Lee JH, Hwang MJ, Choi Y, Kim H, Hwang J, Seo D, Kim S, Nam JS. Changes in nutritional composition and physicochemical properties of mustard leaf (Brassica juncea) kimchi during fermentation. The Korean Journal of Food and Nutrition 29: 706-715. 2016.
Jung SW, Lee NK, Kim SJ, Han D. Screening of tyrosinase inhibitor from plants. Korean Journal of Food Science and Technology 27: 891-896. 1995.
Kim JY, Cho JY, Lee KD, Choi GC, Kim SJ, Ham KS. Change of phenylpropanoic acid and flavonol contents at different growth stage of glasswort (Salicornia herbacea L). Food Science and Biotechnology 23: 685-691. 2014.
Kraunsoe JA, Claridge TD, Lowe G. Inhibition of human leujocyte and porcine pancreatic elastase by homologues of bovine pancreatic tyrosinase inhibitors. Biochemistry 35: 9090-9096. 1996.
Kumar V, Thakur DA, Barothia ND, Chatterjee SS. Therapeutic potentials of Brassica juncea: an overview. TANG Humanitas Medicine 1: 1-17. 2011.
Kim AJ, Park JE, Cho YH, Lim DS, Lee JS. Effect of 7-Methylsulfinylheptyl isothiocyanate on the inhibition of melanogenesis in B16-F1 cells. Life 11: 162. 2021.
Lee JE, Kim AJ. Antioxidant activity, whitening and anti-wrinkle effects of leaf and seed extracts of Brassica juncea L. Czern. Asian Journal of Beauty and Cosmetology 18: 283-295. 2020.
Lee JH, Kim MG, Lee SN, Leem KH. Effects of Bletillae rhizoma on the elastase, collagenase and tyrosinase activities and the procollagen synthesis in Hs68 human fibroblasts. The Korea Journal of Herbology 28: 9-14. 2013.
Lee JM. Physicochemical characteristics and antioxidant effects of red mustard (Brassica juncea Lleaf using different drying methods. The Korean Journal of Community Living Science 28: 515-524. 2017.
Lee MK, Ryu HY, Jeong HH, Lee BG. Brassinin abundant in Brassicaceae suppresses melanogenesis through dual mechanisms of tyrosinase inhibition. Foods 12: 121. 2023.
Oh SK, Kim KW, Choi MR. Antioxidant activity of different parts of Dolsan leaf mustard. Food Science and Biotechnology 25: 1463-1467. 2016.
Pellegrin N, Roberta R, Min Y, Catherine RE. Screening of dietary carotenoids and carotenoid-rich fruit extracts for antioxidant activities applying 2,2'-azinobis(3- thylenebenzothiazoline-6-sulfonic acid) radical cation decolorization assay. Method in Enzymology 1999: 379-389. 1999.
Ryu JH, Ahn H, Kim JY, Kim YK. Inhibitory activity of plant extracts on nitric oxide synthesis in LPS-activated macrophages. Phytotherapy Research 17: 485-489. 2003.
Seo KI, Park SK, Park JR, Kim HC, Choi JS, Shim KH. Changes in antimicrobial activity of hydrolyzate from mustard seed (Brassica juncea). Journal of the Korean Society of Food Science and Nutrition 25: 129-134. 1996.
Singleton VL, Rossi JA. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture 16: 144-158. 1965.
Song BJ, Cho JY, Ma SJ, Park KJ, Park HJ, Choi GC, Ha H, Na HS. Antioxidant, anti-tyrosinase and anti-elastase activities of alternative tea materials (mugwort, bower actinidia, arrowroot) by harvest time and region: a comparative in vitro study. Journal of the Korean Tea Society 23: 65-73. 2017.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||