요약방법괭생이모자반 추출물의 항산화 효능을 확인하기 위하여, 추출물내 총 플라보노이드 및 총 페놀의 함량, ABTS 및 DPPH 라디칼 소거능 활성을 확인하였다. 진피섬유아세포내 괭생이모자반 추출물의 항염증 효능을 확인하기위하여 LPS 투여를 통한 염증 유도 질환 모델에 추출물 투여를 통해 염증성 cytokine인 IL-6의 mRNA 및 발현양을 측정하였으며, 그 상위 기전인 MAPK의 단백질 발현을 확인하였다. 진피섬유아세포내 괭생이모자반 추출물의 콜라겐 분해 억제능의 경우 MMP1 및 procollagen type 1의 발현양과 collagenase및 elastase의 억제능을 확인하였다.
결과괭생이모자반의 DPPH 및 ABTS 라디칼 소거능이 최고 농도인 1000 μg/mL에서 각각 86.87±12 %, 76.49±2.94 % 자유 라디칼 소거능 효과를 확인하였으며, 항산화 효능이 있는 것으로 밝혀져 있는 총 폴리페놀 및 총 플라보노이드 함량이 각각 51.62±1.945 및 79.65±4.732 mg/g이 함유되어 있음을 확인하였다. 진피섬유아세포내 함염증 효능을 확인하고자 IL-6의 발현양을 확인한 결과 대조군 대비 최대 56.8% 감소하는것을 확인하였으며, 그 상위 기전인 MAPK 또한 유의하게 감소하는 것을 확인하였다. 콜라겐 분해능 억제능은 collagenase 및 elastase의 유의적인 감소를 통해 확인하였으며, 진피섬유아내 pro-collagen type 1의 증가 및 MMP1의 감소를 통해 콜라겐의 생성이 증가되었음을 확인하였다.
AbstractPurposeThis study mainly aimed to confirm the antioxidant activity, antiinflammatory, and collagen production enhancement effects of the Sargassum horneri (SH) extract.
MethodsThe measurement of the total flavonoid and total polyphenol content, 2,2′-azino-bis-3-ethylbenzthiazoline-6-sulphonic acid (ABTS), and 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activities confirmed the antioxidant efficacy of the SH extract. The expression level of interleukin 6 (IL-6) and its upstream mechanism pathway, mitogen-activated protein kinases (MAPK), were evaluated for anti-inflammatory efficacy in human dermal fibroblast (HDF) cells. The collagenase and elastase levels were measured in terms of the ability to inhibit collagen degradation. On the contrary, collagen type 1 (COL1) and matrix metallopeptidase 1 (MMP1) were conducted to confirm the collagen production ability.
ResultsThe DPPH and ABTS radical scavenging abilities of the SH extract were 86.87%±12% and 76.49%±2.94%, respectively, at the highest concentration of 1000 μg/mL, confirming 51.62±1.945 and 79.65±4.732 mg/g of total polyphenol and total flavonoid, respectively, which are known to have antioxidant effects. The anti-inflammatory effect of SH in HDF cells was reduced by up to 56.8% compared to the control group due to a significant decrease in MAPK. The SH extract significantly reduced collagenase and elastase, thereby inhibiting collagen degradation. On the contrary, increasing COL1 and decreasing MMP1 in HDF cells confirmed collagen production.
中文摘要方法 测定总黄酮和总多酚含量、2,2′-连氮基-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)和1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除活性证实了SH提取物的抗氧化功效。评估人真皮成纤维细胞 (HDF) 中白细胞介素 6 (IL6) 及其上游机制 mitogen-activated protein kinases (MAPK) 的表达水平的抗炎功效。根据抑制胶原蛋白降解的能力来测量胶原酶和弹性蛋白酶水平。相反,进行1型胶原蛋白(COL1)和基质金属肽酶1(MMP1)以确认胶原蛋白产生能力。
Introduction오래전부터 사람들의 외모에 대한 관심은 과거부터 현재까지 지속되고 있으며, 최근 급격한 의료기술 발전으로 인해 외모를 관리하는 사람이 증가하고 있다. 외모 관리는 다양한 영역에서 영향을 받지만 그 중 피부관리 분야가 가장 중요한 것으로 인식된다. 최근 다양한 매체를 통해 피부에 효능을 나타내는 아이템들이 주목받고 있다. 이를 계기로, 피부에 효능이 나타내는 천연물 소재에 대한 연구가 늘어나고 있으며, 이를 활용한 제품들이 개발되고 있다. 최근 피부 노화에 영향을 주는 고령화, 미세먼지, 자외선 등의 외부 환경적 요인이 증가함에 따라, 해당 원인으로 인한 피해를 줄이기 위해 관련 기능성 제품들의 니즈가 급증하고 있다. 이러한 현상은 피부 노화의 치료보다 사전 예방에 대한 관심이 높음을 확인할 수 있으며, 이에 따라 젊은 세대부터 안티에이징에 효과 있는 기능성 제품에 대한 요구가 증가하고 있다.
피부 노화는 내재적 노화와 외재적 노화로 구분된다. 내재적 노화는 시간이 흐르면서 나타나는 생물학적 노화이며, 이는 피부 상의 수분, 표피 두께 및 지방량 등이 감소하면서 주름이 형성된다(Lim et al., 2002; Eklouh-Molinier et al., 2015). 외재적 노화는 주로 자외선에 의한 광노화를 의미하나 최근 연구에 의하면 미세먼지, 담배 등 피부 노화를 촉진시키는 다양한 요인이 포함되어 내재 요인과 연계하여 피부의 노화를 촉진하는 것을 의미한다(Jenkins et al., 2002; Landau, 2007).
피부 노화의 대표적 내부 요인으로 호르몬 변화로 인한 콜라겐 합성 부족(Youn et al., 2012), 외부적 요인으로 인한 피부 세포에서의 산화적 스트레스(Poljšak & Dahmane, 2012) 및 염증 증가(Pillai et al., 2005) 등이 있다. 첫번째 내재적 요인의 대표적 기전으로 에스트로겐 감소 와 같은 호르몬 변화가 발생하고, 이는 피부의 주름, 건조, 탄력성 감소에 기여한다(Thornton, 2013). 내∙외재적 요인과 연계해서 활성 산소(reactive oxygen species, ROS)는 노화 현상에 주요한 원인으로 밝혀져 있다(Na et al., 2018). 자외선 및 미세먼지 등의 다양한 외부 요인인과 외부 자극으로 인해 생성된 활성산소는 receptor tyrosine kinase (RTK) 및 receptor protein tyrosine phosphatase (RPTP) 억제 능력을 저해하게 된다. RTK의 인산화는 mitogen-activated protein kinase (MAPK)와 nuclear factor Kappa B (NF-κB)의 활성화를 유도하고 이는 콜라겐의 생성을 저해하고, MMP 유전자 전사를 증가시켜, 피부 조직 내 콜라겐양을 감소시킨다(Kammeyer & Luiten, 2015). 따라서, 피부의 항노화 효능에 대한 평가는 콜라겐 분해(주름), 산화 스트레스, 염증 유발 등에 대한 복합적인 요소를 고려해야 한다.
괭생이모자반은 모자반목 모자반과에 속하는 갈조류로 한국 및 중국 등의 연안 해역에서 발견된다. 괭생이모자반은 아미노산, 무기질, 후코이단 등의 성분들을 함유하고 있으며, 특히 괭생이모자반의 주요 지표 물질인 후코이단은 항산화, 항염증, 피부 세포 재생 등에 효능이 있음이 밝혀 져 있다(Song et al., 2014; Lee et al., 2022). 최근 연구 결과에 따르면 괭생이모자반은 항염증(Sanjeewa et al., 2019; Dias et al., 2021; Kim et al., 2015), 면역기능 개선(Han et al., 2020), 항산화(Ko et al., 2021), 비만 개선(Murakami et al., 2021) 등에 대한 유용한 효과가 있음이 밝혀짐으로써 다양한 질환에서 효과를 보이는 기능성 원료로서의 가능성이 높음을 확인할 수 있다. 현재 괭생이모자반은 개인 건강 증진을 위한 재료로 인식되고 있으며, 이는 식용으로 가능한 원료로써 화장품 원료 등록 절차가 생략 가능한 천연소재이다. 이전에 밝혀진 괭생이모자반 및 괭생이모자반의 구성 성분들에 대한 효능 논문들을 바탕으로 피부에서의 항산화, 주름개선, 피부 재생 등에 대한 효능을 기대할 수 있으며, 이는 신규 기능성 화장품 원료로서 개발 가능할 것으로 예상된다. 따라서 본 연구에서는 괭생이모자반 추출물을 이용하여 항산화, 항염증 및 피부 재생에 대한 복합적인 효과를 입증하여, 기능성 화장품 소재를 개발하고자 하였다.
Material & Methods1. 시약 및 재료괭생이모자반 추출물을 얻기 위하여 건조 괭생이모자반 원물에 정제수 첨가하여 온도 90℃에서 4 h 동안 추출하였다. 추출이 끝난 추출물은 백필터(bag filter)를 활용하여 여과하였다. 이 후 원심박막농축기(CEP-20S; Okawara, Japan)를 이용하여 고형분 함량 20% brix가 되도록 농축하였고 분무건조(HKC-100-DJ; Gea Niro, Denmark)한 것을 괭생이모자반 추출물로 사용하였다.
단백질 분석을 위하여 본 실험에 사용된 p-p38, p38, p-ERK, 및 ERK 항체는 Cell Signaling Technology (CST, USA)에서 구입하였고, p-JNK, JNK 항체는 Santa Cruz Biotechnology Inc. (USA)에서 구입하여 사용하였다.
2.실험 방법1) 총 폴리페놀 함량총 폴리페놀 함량은 Folin-Ciocalteu's phenol 시약을 이용한 발색법으로 측정하였다. 괭생이모자반 추출물을 1 mg/mL로 제조하고 그 중 200 μL를 취한 뒤 100 μL 50% Folin-Ciocalteu's phenol 시약을 첨가하였다. 이들을 실온에서 30 min 반응시킨 후 Microplate Reader (Epoch; Bio-Rad, USA)을 이용하여 750 nm 파장에서 흡광도를 측정하였다. 측정한 값은 gallic acid 표준정량곡선을 이용하여 1 g의 추출물 중에 함유된 gallic acid의 양으로 제시하였다.
2) 총 플라보노이드 함량총 플라보노이드 함량은 괭생이모자반 추출물(1 mg/mL) 100 μL에 1 mL diethylene glycol을 첨가하고, 다시 1 N sodium hydroxide (NaOH; Sigma-Aldrich, USA) 100 μL 처리하여 37℃ water bath에 1 h 반응시킨 후 Microplate Reader을 이용하여 420 nm에서 흡광도를 측정하였다. 표준곡선은 naringin 농도를 0-300 μg/mL이 되도록 하여 작성하고 이로부터 총 플라보노이드 함량을 구하였다.
3) DPPH 라디칼 소거 활성괭생이모자반 추출물의 항산화 효과를 평가하기 위하여 DPPH의 자유 라디칼 소거능을 확인하였다. 메탄올에 용해한 200 μM DPPH 200 μL에 희석한 시료를 50 μL 첨가하여 37℃에서 30 min 동안 반응시킨 후, Microplate Reader를 이용하여 517 nm에서 흡광도를 측정하였다. Ascorbic acid를 양성대조군으로 사용하였으며 괭생이모자반 추출물 처리군와 무처리군의 흡광도 감소율로 나타내었다.
4) ABTS 라디칼 소거 활성ABTS와 potassium persulfate를 혼합하면 ABTS 라디칼이 생성되는데, 괭생이모자반 추출물의 항산화 물질과 반응하여 양이온이 소거됨으로써 특유의 청록색이 탈색되며 이의 흡광도를 측정하여 항산화 능력을 측정할 수 있다. 시험 용액은 증류수에 7 mM ABTS와 2.45 mM potassium persulfate를 첨가하여 상온에서 16 h 배양하여 ABTS 양 이온을 생성시킨 후 720 nm에서 흡광도의 값이 0.7 이하가 되도록 희석하여 제조하였다. 그 다음 ABTS 용액 100 μL에 시료 용액 100 μL을 가한 후 30 min 후에, Microplate Reader를 이용하여 720 nm에서 흡광도를 측정하였다. 음성대조군(2.45 mM potassium persulfate buffer)의 흡광도와 비교하여 흡광도를 감소시키는 정도를 %로 나타내었다.
5) Human dermal fibroblast cell 배양 및 약물 처리Human dermal fibroblast (HDF)는 한국세포주은행(Korean Cell Line Bank, KCLB, Korea)에서 분양 받아 10% fetal bovine serum (FBS; Gibco-BRL, USA)과 1% Penicillin-Streptomycin solution (P/S)을 첨가한 Dulbecco's Modified Eagle's Medium (DMEM; Gibco-BRL, USA) 배지에 37℃, 5% CO2 조건에서 배양하였다. 세포 배양배지는 세포가 80% 이상 자란 시점에서 2-3일마다 교환하였다.
6) MTT assay괭생이모자반 추출물의 세포독성을 확인하기 위해 HDF 세포를 96 well plate에 1×104 cells/well로 분주한 후 37℃, 5% CO2 incubator에서 24 h 동안 배양하면서 세포를 완전히 부착시키고, 괭생이모자반 추출물 농도에 따라 PBS에 용해하여 24 h 동안 처리하였다. Well당 20 μL의 3-(4,5-dimethylthiazol- 2-yl)-2,5-diphenyltetrazolium bromide (MTT; Sigma-Aldrich) 용액(1 mg/mL)을 첨가하여 4 h동안 반응시켰다. MTT 시약의 첨가로 생긴 formazan을 녹이기 위해 서 dimethyl sulfoxide (DMSO; SigmaAldrich)를 100 μL씩 첨가하고, 1 h 후 Microplate Reader를 이용하여 517 nm에서 흡광도를 측정하였으며, control (medium only)의 흡광도 값을 기준으로 세포독성을 비교하였다.
7) IL-6분비 억제능 평가48 well plate에 HDF 세포를 5×104 cells/well로 분주한 후 괭생이 모자반 추출물을 각각 맞는 농도로 처리하였고 24 h 후, LPS 1 μg/mL를 24 h 처리하여 배양하여 상등액을 분리하였다. 분리된 배양 상등액의 IL-6 함량은 ELISA kit (Thermo Fisher Scientific, USA)을 사용하여 측정하였으며, 이때 사이토카인의 농도는 kit에 포함되어 있는 표준용액으로부터 산출된 표준곡선으로부터 계산되었다.
8) Reverse transcription-polymerase chain reaction (RT-PCR)에 의한 mRNA 발현 분석HDF 세포에 대한 괭생이모자반 추출물의 mRNA 발현을 측정하기위해, HDF 세포를 6 well plate에 5×104 cells/well로 분주한 후 괭생이모자반 추출물을 각각 맞는 농도로 처리하였고 24 h 후, LPS 1 μg/mL를 24 h 처리하였다. 이후 상등액을 제거하고 trypsin (Gibco-BRL, USA) 용액을 이용하여 세포를 분리하였다. 분리된 세포를 PBS로 세척하고 RNeasy mini kit (QIAGEN, USA)를 사용하여 total RNA를추출하였고, total RNA에서 cDNA를 합성하는데 MaximeTM RT Pre-Mix (Intron, Korea)을 사용하였다. 합성된 cDNA에 primer를 넣고 real-time polymerase chain reaction (Real-time PCR) 방법으로 증폭시켜 mRNA를 합성하여 7500 fast system (Applied Bio-systems, USA)을 이용해 측정하였다. 측정하고자 하는 mRNA는 GAPDH로 수치를 정량화 하였고 7500 software (ver.2.3; Applied Bio-systems)을 사용하여 계산하였다. mRNA primer는 Cosmogenetech (Korea)에서 아래 표와 같이 만들어 사용하였다(Table 1).
9) Western blot 분석HDF 세포에 대한 괭생이모자반 추출물의 IL-6 단백질 발현을 측정하기 위해 HDF 세포를 6 well plate에 5×104 cells/well로 분주한 후 괭생이모자반 추출물을 각각 맞는 농도로 처리하였고 24 h 후, LPS 1 μg/mL를 24 h 처리하였다. MAPK 기전 분석을 위한 단백질 분리는 6 well plate에 5×104 cells/well로 분주한 후 괭생이모자반 추출물을 각각 맞는 농도로 처리하였고 24 h 후, LPS 1 μg/mL를 30 min 처리하였다. 이후 단백질 분석을 위해 상등액을 제거하고 trypsin (Gibco-BRL) 용액을 이용하여 세포를 분리하였다. 분리된 세포를 PBS로 세척한 다음, nuclear and cytoplasmic extraction reagents kit (Thermo Fisher Scientific)를 사용하여 세포질 내의 단백질을 분리하였고 BCA protein detection kit (Thermo Fisher Scientific)를 사용하여 정량하여 10% Tris-glycine mini gel (Thermo Fisher Scientific)에 well당 20 μg의 단백질을 loading하여 SDS-PAGE로 분리하였다. 이를 polyvinylidene difluoride (PVDF) membrane (Invitrogen)로 transfer한 후, membrane을 10 mL의 blocking solution에 2 h 동안 방치한 후 이를 제거하고 1차 항체를 1:1,000으로 5% skim milk에 희석하여 4℃에서 overnight 반응시켰다. 이후 TBST으로 10분씩 4회 세척하고, 2차 항체를 5% skim milk에 1:3,000으로 희석하여 2 h 동안 반응시키고, TBST로 10 min간 4회 세척하였으며, West Femto maximum sensitivity substrate와 LAS-4000 (GE healthcare life sciences, USA)을 이용하여 밴드를 분석하였다.
10) Immunofluorescent분석HDF 세포에 대한 괭생이모자반 추출물의 콜라겐 단백질 발현을 측정하기 위해, HDF세포를 4 well plate에 5×103 cell/well로 배양하였으며 괭생이모자반 추출물을 24 h 처리한 후, 상등액을 제거한 뒤 10% 포르말린으로 10 min 고정하였다. 이후 5% FBS가 포함된 PBS로 세척한 뒤, 5% BSA Blocking하였다. Collagen 1 (COL1; Santa Cruz, USA) 항체를 1:200 비율로 희석하여 처리하여 4℃에서 overnight 반응시켰다. 이후 TBST으로 5 min씩 3번 세척하고, 2차 항체를 1:1000으로 희석하여 1 h 동안 반응시키고, TBST로 5 min간 3회 세척하였다. DAPI 염색은 고정 용액이 포함된 VECTASHIELD® Antifade Mounting Medium with DAPI (Vector Laboratories)를 사용하였다. 형광이미지는 EVOS M7000 (Thermo Fisher Scientific)를 이용하여 분석하였다.
11) Collagenase 억제 활성 측정괭생이모자반 추출물의 주름개선 효과를 평가하기 위해 Collagenase 활성 억제능을 확인하였다. 괭생이모자반 추출물을 희석하여 1, 25, 50, 100, 250, 500 및 1000 μg/mL 농도로 만든 후, 0.1 M tris-HCl buffer (pH 7.5, Sigma-Aldrich)에 4 mM calcium chloride (Sigma-Aldrich)를 첨가하고 4-phenylazobenzyloxycarbonyl-Pro-Leu-Gly-Pro-DArg (0.3 mg/mL) (Sigma-Aldrich)를 녹인 액 0.5 mL에 검액 0.2 mL를 넣었다. 이 후 200 U/mL Collagenase type I (Sigma-Aldrich) 0.3 mL를 첨가하여 실온에서 20 min간 반응시켰다. 반응 정지액으로 5% citric acid 0.5 mL을 넣고 ethyl acetate 1 mL를 첨가하여 Microplate Reader를 이용하여 320 nm에서 흡광도를 측정하였다. 이때, 대조군과 비교하여 collagenase 저해율을 백분율(%)로 구하였다.
12) Elastase 억제 활성 측정괭생이모자반 추출물의 주름개선 효과를 평가하기 위해 elastase 활성 억제능을 확인하였다. 양성대조군은 adenosine을 사용하였으며 0.1 M Tris-HCl buffer (pH 8.0)에 25, 50, 100, 250, 500 및 1000 μg/mL 농도로 희석한 괭생이모자반 추출물 220 μL에 2 mg/mL N-succinyl-Ala-Ala-Ala-p-nitroanilide 20 μL를 첨가하여 25℃ 조건에서 20 min 반응시킨 다음, 얼음 위에서 반응을 종결시킨 후 Microplate Reader를 이용하여 405 nm에서 흡광도를 측정하였다.
Results and Discussion1. 괭생이모자반의 항산화 효과 확인1) ABTS, DPPH radical 소거활성 평가자유 라디칼은 세포 손상을 유발하는 요인으로, 산화적 스트레스를 유발하여 세포의 산화/환원의 불균형을 유도한다. 이는 암(Dreher et al., 1996), 심혈관 질환(Mimić-Oka et al., 1999), 피부 노화(Poljšak & Dahmane, 2012) 등의 다양한 질환에서 중요한 원인이 된다. 따라서 자유 라디칼 활성 여부는 피부 노화에 중요한 역할을 하며, 자유 라디칼의 소거능 활성은 항산화 효능을 위한 평가 도구로서 활용되고 있다. 본 연구 결과는 괭생이모자반 추출물의 항산화 효능을 확인하기 위해 0 μg/mL부터 1000 μg/mL까지 처리하여 항산화 활성을 확인하였다(Figure 1A, B). 양성대조군으로는 ascorbic acid를 처리하였다. DPPH 라디칼 소거능 시험에서 괭생이모자반 추출물 처리는 100 μg/mL부터 유의적인 항산화 효능을 확인할 수 있었으며, 최고 농도인 1000 μg/mL의 경우 86.87±12% 라디칼 소거능이 있음을 확인하였다. 이는 양성대조군인 ascorbic acid의 시험결과인 90.22±0.09% 라디칼 소거능과 유사함을 확인하였다(Figure 1A). ABTS 라디칼 소거능 시험에서 괭생이모자반 추출물 처리는 50 μg/mL부터 10.43±5.95% 자유칼 소거능 효과가 있는 것을 확인하였으며, 최고 농도인 1000 μg/mL에서는 76.49±2.94% 라디칼 소거능 효과가 있음을 확인하였다(Figure 1B). 본 연구 에서는 괭생이 모자반 추출물의 자유 라디칼 소거능이 양성대조군과 유사한 결과로 보아 항산화 효과가 매우 높을 것으로 판단된다.
2) 총 폴리페놀 및 총 플라보노이드 측정총 폴리페놀 및 총 플라보노이드는 체내의 활성 산소 제거에 중요한 역할을 하는 것으로 밝혀져 있으며, 또한 활성 산소에 의한 세포 손상 보호 효과로 인해 다양한 질병 유발에 대한 위험도가 감소되는 것으로 밝혀져 있다(Perron & Brumaghim, 2009). 괭생이모자반 추출물의 총 폴리페놀 및 총 플라보노이드 함량을 계산하여 Table 2에 나타내었다. 괭생이모자반 추출물은 총 페놀 51.62±1.945 mg/g, 총 플라보노이드는 79.65±4.732 mg/g가 함유되어 있음을 확인하였다. 본 연구 결과에서 괭생이모자반 추출물의 총 폴리페놀 및 총 플라보노이드 함유 결과와 더불어 DPPH, ABTS 소거능 활성 결과를 통해 항산화 효능이 있을 것으로 판단된다.
2. 괭생이모자반 추출물의 항염증 및 주름개선 효과 확인1) 세포 독성 평가괭생이모자반 추출물에 의한 세포 독성을 평가하기 위해, Human Dermal Fibroblasts (HDF) 세포에 0-1000 μg/mL 농도까지 처리하여 24 h 배양한 후, MTT assay 시험법을 통해 결과를 확인하였다. 그 결과, 괭생이모자반 추출물은 250 μg/mL부터 유의적으로 독성이 있음을 확인하였으며, 최고 무독성 농도가 100 μg/mL임을 확인하였다(Figure 2). 이후, HDF 세포에 대한 괭생이모자반 추출물 효능 시험은 최고 농도 100 μg/mL으로 선정하여 진행하였다.
2) 항염증 효능 평가피부에서 염증의 유발은 콜라겐 및 엘라스틴과 같은 피부 구조 성분의 제거 (Granstein et al., 1989), 산화스트레스 증가(Kim et al., 2012), 피부 노화의 촉진(Fuller, 2019) 등의 피부 질환 유발의 원인으로 밝혀 져 있다. 따라서 피부노화 억제에 있어서 항염증 효능은 기능성 천연물 원료 개발에 있어서 중요한 지표 중 하나로 알려져 있으며, IL-6와 같은 대표적인 염증성 cytokine의 변화를 통해 확인이 가능하다. Mitogen-activated protein kinases (MAPK)s는 ERK1/2, JNK, p38 등의 단백질을 포함하는 신호전달 경로로, 염증, 산화스트레스, 세포 손상 등 과 같은 자극에 반응하여 활성화된다(Corre et al., 2017). MAPKs의 주요 기능 중 하나로 대식 세포에서 염증을 조절하는 것으로 알려 져 있으며, ERK1/2, JNK, p38의 활성화는 염증성 cytokine 인 IL-6 및 TNF-α의 생성 촉진을 유도할 수 있다(Kim et al., 2023). 따라서 항염증 조절 연구에 있어서 MAPKs 활성은 중요 기전으로 인식되고 있다. 본 연구는 HDF 세포에서 괭생이모자반 추출물 처리가 항염증 효능 확인과 더불어 MAPKs 기전 억제와의 연관성을 확인하기 위하여, Elisa 시험법 및 mRNA 발현양 시험법을 통해 IL-6의 발현양과, 단백질 발현량 시험법을 통해 인산화된 p38, JNK, ERK을 측정하였다. 염증유발을 통한 피부 노화 모델을 유발하기 위해 HDF 세포에 염증을 유발하는 대표적인 물질인 LPS를 처리하였으며, 그 결과 HDF 세포에 LPS 처리는 유의적으로 IL-6 발현양이 증가하였음을 확인하였다(Figure 3A, B). 괭생이모자반 추출물의 항염증 효능을 확인하기 위하여, 염증이 유발된 모델인 LPS 처리 군에 괭생이모자반 추출물을 처리하여 결과를 확인하였다. 그 결과, 괭생이모자반 추출물 처리군에서 IL-6의 생산량은 LPS 단독 처리 군 대비 각각 28.76%, 52.09%, 56.8% 감소함을 확인하였다(Figure 3A). 또한 괭생이모자반 추출물 처리는 IL-6 mRNA level 발현양을 LPS 단독 처리 군 대비 각각 52.35%, 53.85%, 62.6% 감소함을 확인하였다(Figure 3B). HDF 세포에서 염증성 cytokine의 대표적 인자인 IL-6의 발현과 밀접한 관계가 있는 기전인 MAPK는 LPS 처리를 통해 활성화 되는 것으로 알려져 있다(Cen et al., 2021). 따라서, 본 연구 결과는 괭생이모자반 추출물이LPS처리에 의해 활성화된 MPAK 기전에 영향을 주는지 확인하기 위해 MAPK의 단백질 발현 변화를 통해 효능을 확인하였다. HDF 세포에 LPS 처리는 p38, JNK, ERK의 인산화가 정상군과 비교하여 유의적으로 증가됨을 확인하였다(Figure 3C, 3D). 괭생이모자반 추출물 처리는 LPS 단독 처리 군과 비교하여, p38, JNK, ERK의 인산화가 유의적으로 감소함을 확인하였다(Figure 3C, D). 본 연구 결과는 괭생이모자반 추출물의 항염증에 대한 기전 및 효과를 확인함으로써, 항염증을 통한 피부 노화 개선에 유의미한 효과가 있을 것으로 판단된다.
3) 주름개선 효능 평가피부의 탄력과 장력을 조절하는 진피층은 타입 I 콜라겐(type I collagen)과 타입 III 콜라겐 type III collagen)이 8:2 비율로 존재하며, 피부의 노화는 진피섬유아세포의 이상 작용으로 세포의 활성이 저해되어 나타나는데 일반적으로 collagen 및 elastin의 생성 저하 또는 collagenase, elastase 및 MMP 등의 활성 등의 현상이 나타난다(Joo et al., 2022).
MMPs는 세포내의 특정 단백질을 분해 및 재구성 외에 혈관 신생, 세포의 전이 등에 중요한 역할을 하는 것으로 밝혀 져 있다(Malemud, 2006).
MMPs 중 MMP1, MMP2, MMP8, MMP9 및 MMP13 효소의 발현은 콜라겐 단백질 분해를 촉진하여, 콜라겐 섬유의 감소를 촉진할 수 있다(Pittayapruek et al., 2016). 이는 피부의 탄력과 강도를 감소시켜 피부의 주름 증가, 탄력 감소, 피부의 노화 등의 증상이 유발된다. 따라서 피부의 건강 및 노화를 방지하기 위해 MMP 단백질의 발현 조절이 매우 중요한 것으로 알려 져 있다. 본 연구 결과는 괭생이모자반 추출물이 주름개선에 미치는 영향을 밝히기 위하여, MMP1 mRNA 발현 및 collagen type 1 (COL1) 단백질 발현을 측정하였다. 세포독성이 없는 용량에서 MMP-1 mRNA level은 괭생이모자반 추출물 처리에 의해 유의적으로 감소하였다(Figure 4A). 또한 COL1 단백질의 발현은 괭생이모자반 추출물 처리에 의해 증가함을 확인하였다(Figure 4B).
Elastase 및 collagenase 억제능은 주름 개선의 지표로 사용되며 다양한 외부자극 요인에 의해 elastase 및 collagenase의 활성이 높아지는 것으로 알려져 있다(Kim et al., 2020). 피부 주름억제에 elastase 및 collagenase억제능에 따라 주름을 개선할 수 있음을 확인할 수 있다. 괭생이모자반 추출물의 elastase 및 collagenase 억제능에 대해 확인하기 위해 PBS만 처리한 음성대조군과 비교하여 괭생이모자반 추출물은 1 μg/mL부터 1000 μg/mL까지 처리하였다. Elastase에서 양성 대조군으로는 ascorbic acid를 사용하였으며, collagenase에서는 phenanthroline을 사용하였다. 그 결과, collagenase 억제 시험에서 괭생이모자반 추출물 처리는 25 μg/mL부터 유의적인 억제 효과가 있음을 확인하였으며, 최고 농도인 1000 μg/mL 19.39±1.75%의 억제 효과가 있음을 확인하였다(Figure 4C). Elastase 억제 시험에서 괭생이모자반 추출물 처리는 1 μg/mL 유의적인 억제 효과가 있음을 확인하였으며, 최고 농도인 1000 μg/mL에서 42.68±6.22%의 억제 효과가 있음을 확인하였다(Figure 4D). 따라서 본 연구 결과를 통해 괭생이모자반 추출물이 elastase 및 collagenase 억제를 통한 주름개선에 효과가 있다고 판단된다.
Conclusion최근 해양에 서식하는 해양생물 중 하나인 해조류는 다양한 종류의 다당류 및 무기질 등을 함유하고 있어, 기능을 나타내는 생리활성을 가지는 천연 자원으로써 가능성이 높음이 밝혀 지고 있다. 그 중 모자반과에 속하는 갈조류인 괭생이모자반은 중국에서 번식하여 북서풍 및 조류를 통해 우리나라 동해안 및 일본 전 연안에 나타나고 있다. 중국으로부터 유입된 괭생이모자반은 해안가 및 양식시설에 부착되어 악취 유발 및 양식 해양생물의 생산량 감소 및 품질 저하 등으로 인해 막대한 금전적 피해를 유발하여 현재 유해 해양생물로 지정되어 있다. 따라서, 우리나라에서는 괭생이모자반을 활용하여 건축(Lee et al., 2019), 농업(Madhavaraj et al., 2020), 의약품 분야에서 재활용하여 고부가가치 원료로써 개발하고 있다. 괭생이모자반은 선행연구를 통해 항염, 항암, 면역 증진, 항산화 등에 대한 효과가 있는 것으로 알려 져 있으나, 기존 연구는 대식 세포, 면역 세포, 암세포 등에 국한되어 실험이 진행되어 있는 한계점이 있다. 따라서 본 연구는 괭생이모자반 추출물을 활용하여, 아직 연구가 되어 있지 않은 피부세포에서의 항염증, 콜라겐 합성 효과와 콜라겐 분해 억제 효과를 통해 신규한 기능성 화장품 원료를 개발하고자 하였다.
본 연구에서는 괭생이모자반 추출물을 이용한 항산화, 피부 항염증 및 콜라겐 합성 저해 억제 효능을 확인하고자 하였다. 괭생이모자반 추출물의 항산화 효과를 확인하기 위하여 이전 연구에서 항산화 효과가 있는 것으로 밝혀 져 있는 성분인 총 폴리 페놀 및 총 플라보노이드의 함량 측정하였으며, 또한 항산화 효능의 직접적 효과를 확인하기 위하여 ABTS 및 DPPH 자유 라디칼 소거능 효과를 확인하였다. 그 결과 괭생이모자반 추출물내 총 폴리 페놀 및 총 플라보노이드는 각각 51.62±1.945 mg/g, 79.65±4.732 mg/g이 함유되어 있으며, ABTS 및 DPPH 자유 라디칼 소거능은 최대 1000 μg/mL 농도에서 각각 86.87±12%, 76.49±2.94% 증가되는 것을 확인하였다. 괭생이모자반 추출물에 대한 항산화 효과에 대한 이전 연구에 의하면(Ko et al., 2021), 추출용매에 따라 항산화 효능의 정도가 유의적으로 차이가 남을 확인할 수 있었으며 그 중 괭생이모자반 열수추출물이 가장 낮은 효과가 있음을 확인 하였다. 하지만 이전 연구결과는 우리의 연구 결과와 비교하여 괭생이모자반 추출물 1 mg/mL 기준 같은 열수 추출물임에도 불구하고 DPPH 및 ABTS 시험에서 우리의 샘플보다 효과가 낮음을 확인하였다. 이는 원물의 비소저감 방법, 가공 방식 및 채취 시기 따른 차이가 있을 것으로 예상된다. 향후 원물 가공 및 채취 시기에 따른 항산화 효과 비교가 필요 할 것으로 판단된다. 피부 항염증 효능을 확인하고자 진피섬유아세포(HDF)에서 LPS를 통한 염증 유발 모델에 괭생이모자반 추출물을 처리하였으며, 염증성 cytokine 인 IL-6의 발현과 IL-6의 발현을 조절하는 상위 기전인 MPAK를 확인하였다. 그 결과, 괭생이모자반 추출물 투여는 LPS가 투여된 대조군 대비 IL-6의 발현량을 최대 56.8%까지 유의적으로 감소시켰다. 또한 MAPK 기전의 대표적 인자인 p38, JNK, ERK의 인산화가 대조군 대비 단백질 발현이 유의적으로 감소하였다. 피부 주름개선 효능을 확인하고자 주름을 유발하는 콜라겐 합성 저해 요소인 collagenase 및 elastase의 억제율과 콜라겐의 발현양을 측정하였다. 그 결과, collagenase 및 elastase의 억제 율이 최대 1000 μg/mL 농도에서 각각 19.39±1.75% 및 42.68±6.22%의 감소를 확인하였다. 또한 HDF에서 괭생이모자반 추출물 처리는 콜라겐 생성에 관여하는 인자인 collagen type-1 (Col1) 생성이 증가하였으며, 반대로 콜라겐 분해에 관여하는 인자인 MMP1은 유의적으로 감소하였다. 따라서 본 연구에서 사용된 괭생이모자반 추출물은 향후 항산화, 항염증 및 주름개선의 효능을 포함하는 기능성 화장품 소재로의 가능성을 확인하였다.
향후, 괭생이모자반 추출물의 피부내 항산화, 항염증 및 주름개선에 대한 활성에 대한 규명을 위해 추가적인 성분 분석 연구가 필요 할 것으로 사료되며, 기능성 화장품 원료로써 개발을 위하여 원료의 안전성 및 기능성을 인체적용시험의 추가적인 연구를 통해 밝혀야 될 것으로 판단된다.
Acknowledgements이 논문은 2021년도 해양수산부 재원으로 해양수산과학기술진흥원의 지원을 받아 수행된 연구임(20210656, 빅데이터 기반 바이오헬스케어 유효성 소재 실증 지원).
NOTESAuthor's contribution
Conceptualization: DSK, NYS, and YJ; Methodology: GK, MJK, and YJ; Validation: YJ, DSK, NYS, and CSK; Formal analysis: YJ and NYS; Investigation: GK and MJK. Resources: IJH, CSK, NYS, and DSK; Writing-original draft preparation: DSK, NYS, and YJ; Writing, review, and editing: DSK, NYS, and YJ; Project administration: DSK, NYS, IJH, and YJ; Funding acquisition: DSK and CSK. All authors have read and agreed to the published version of the manuscript.
Author details
Dong-Sub Kim (Principal Researcher Engineer), Division of Natural Product Research, Korea Prime Pharmacy Co., LTD, 147, Gwanggyo-ro, Yeongtong-gu, Suwons-i, Gyeonggi-do 16229, Korea; Geon Kim (Associate Research Engineer), Division of Natural Product Research, Korea Prime Pharmacy Co., LTD, 147, Gwanggyo-ro, Yeongtong-gu, Suwon-si, Gyeonggi-do 16229, Korea; Nak-Yun Sung (Senior Research Engineer), Division of Natural Product Research, Korea Prime Pharmacy Co., LTD, 147, Gwanggyo-ro, Yeongtong-gu, Suwon-si, Gyeonggi-do 16229, Korea; In-Jun Han (Senior Research Engineer), Division of Natural Product Research, Korea Prime Pharmacy Co., LTD, 147, Gwanggyo-ro, Yeongtong-gu, Suwon-si, Gyeonggi-do 16229, Korea; Minjee Kim (Associate Research Engineer), Division of Natural Product Research, Korea Prime Pharmacy Co., LTD, 147, Gwanggyo-ro, Yeongtong-gu, Suwon-si, Gyeonggi-do 16229, Korea; Chun Sung Kim (Professor), Department of Oral Biochemistry, College of Dentistry, Chosun University, 146, Chosundaegil, Dong-gu, Gwangju 61452, Korea; Yunu Jung (Research Engineer), Division of Natural Product Research, Korea Prime Pharmacy Co., LTD, 147, Gwanggyo-ro, Yeongtong-gu, Suwon-si, Gyeonggi-do 16229, Korea.
Figure 1.DPPH and ABTS radical scavenging activity of Sargassum horneri (SH) extracts.(A) Radical scavenging activities of 1,1-diphenyl-2-picrylhydrazyl (DPPH) and (B) 2,2′-azino-bis-3-ethylbenzthiazoline-6-sulphonic acid (ABTS) assays were measured to evaluate the anti-oxidant effects of SH at varying concentration of 0, 50, 100, 250, 500, and 1000 μg/mL. Results are expressed as the mean±standard deviation (SD) (n=3). Student’s t-test with a significant level of *p<0.05 compared to Blank (0 μg/mL) group was used for statistical analysis.
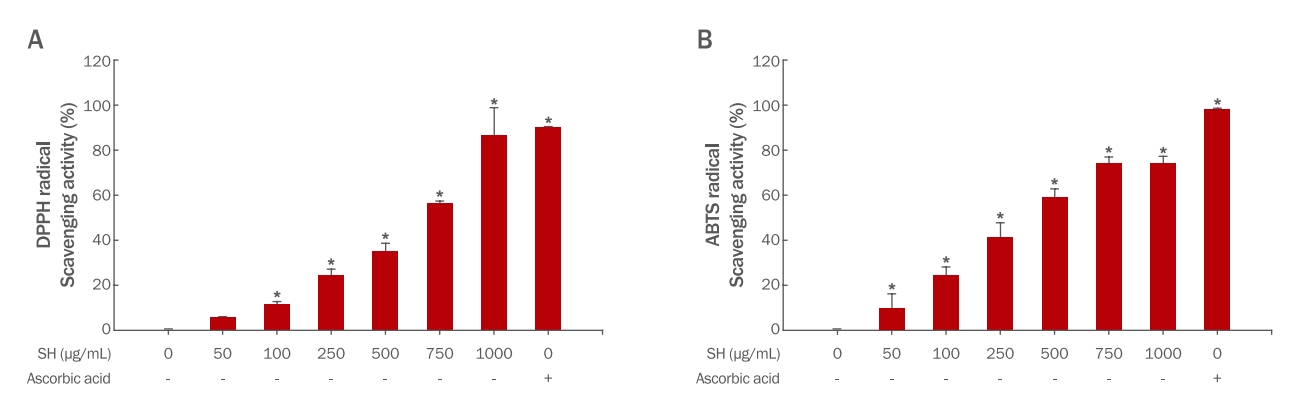
Figure 2.Effect of Sargassum horneri (SH) extracts on the cell viability in human dermal fibroblasts (HDF).SH were administered at the concentration of 50, 75, 100, 250, 500, 750, and 1000 μg/mL. After 24 h, cell proliferation was determined by MTT assay. Results are expressed as the mean±SD (n=3). Student’s t-test with a significant level of *p<0.05 compared to Blank (0 μg/mL) group was used for statistical analysis.

Figure 3.Effect of Sargassum horneri (SH) extracts on anti-inflammation in human dermal fibroblasts (HDF).SH were administered at the concentration of 10, 50, and 100 μg/mL. (A) Cytokine (interleukin 6 [IL-6]) productions in culture supernatant were investigated by enzyme-linked immunosorbent assay (ELISA) kits. (B) mRNA levels of IL-6 in HDF cell treated with SH. (C, D) MAPKs protein expressions were analyzed by Western blot analysis. Results are expressed as the mean±SD (n=3). statistical analysis was performed using Student’s t-test with a significant level of #p<0.05 compared to Blank (LPS Non-treated) group and *p<0.05 compared to control (LPS treated) group.
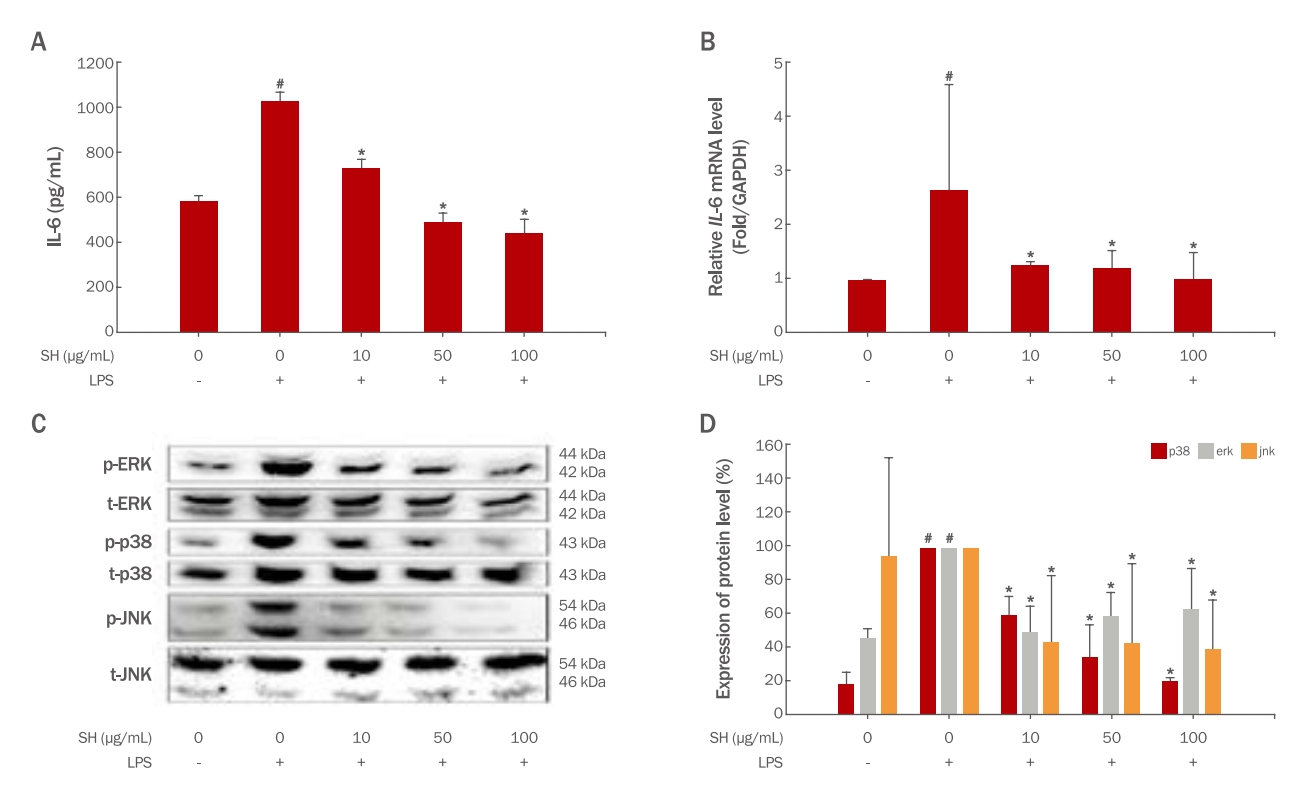
Figure 4.Effect of Sargassum horneri (SH) extracts on wrinkle improvement.SH were administered at the concentration of 10, 50, and 100 μg/mL. (A) Western blot analysis was used to analyze MMP1 protein expressions. (B) Immunofluorescence staining was used for collagen Type I expression analysis. (C) Collagenase inhibitory activity.(D) Elastase inhibitory activity. Results are expressed as the mean±SD (n=3). Student’s t-test with a significant level of *p<0.05 compared to Blank (0 μg/mL) group was used for statistical analysis.

ReferencesCen R, Wang L, He Y, Yue C, Tan Y, Li L, Lei X. Dermal fibroblast migration and proliferation upon wounding or lipopolysaccharide exposure is mediated by stathmin. Frontiers in Pharmacology 12: 781282. 2022.
Corre I, Paris F, Huot J. The p38 pathway, a major pleiotropic cascade that transduces stress and metastatic signals in endothelial cells. Oncotarget 8: 55684-55714. 2017.
Dias MKHM, Madusanka DMD, Han EJ, Kim HS, Jeon YJ, Jee Y, Kim KN, Lee K, Fernando IPS, Ahn G. Sargassum horneri (Turner) C. Agardh ethanol extract attenuates fine dust-induced inflammatory responses and impaired skin barrier functions in HaCaT keratinocytes. Journal of Ethnopharmacology 273: 114003. 2021.
Dreher D, and Junod AF. Role of oxygen free radicals in cancer development. European Journal of Cancer 32: 30-38. 1996.
Eklouh-Molinier C, Happillon T, Bouland N, Fichel C, Diébold MD, Angiboust JF, Manfait M, Brassart-Pasco S, Piot O. Investigating the relationship between changes in collagen fiber orientation during skin aging and collagen/water interactions by polarized-FTIR microimaging. Analyst 140: 6260-6268. 2015.
Fuller B. Role of PGE-2 and other inflammatory mediators in skin aging and their inhibition by topical natural anti-inflammatories. Cosmetics 6: 6. 2019.
Granstein RD, Deak MR, Jacques SL, Margolis RJ, Flotte TJ, Whitaker D, Long FH, Amento EP. The systemic administration of gamma interferon inhibits collagen synthesis and acute inflammation in a murine skin wounding model. Journal of Investigative Dermatology 93: 18-27. 1989.
Han EJ, Kim HS, Sanjeewa KKA, Jung K, Jee Y, Jeon YJ, Fernando IPS, Ahn G. Sargassum horneri as a functional food ameliorated IgE/BSA-induced mast cell activation and passive cutaneous anaphylaxis in mice. Marine Drugs 18: 594. 2020.
Jenkins G. Molecular mechanisms of skin ageing. Mechanisms of Ageing and Development 123: 801-810. 2002.
Joo YE, Kwon SB, Kwon YJ, Choi YW, Kim MJ, Sun M, Ahn KJ, An IS. Effects of ‘NEOGEN VBIOME LIPOSOME™’ on the increased expression of COL1A1 and HAS2 mRNA in human dermal fibroblasts. Asian Journal of Beauty and Cosmetology 20: 451-459. 2022.
Kim DS, Kim M, Sung NY, Han IJ, Kim G, Kim CS, Yoo YC, Jung Y. Immune enhancing activity of Sargassum horneri extracts via MAPK pathway in macrophages. Journal of Marine Bioscience and Biotechnology 15: 12-23. 2023.
Kim DS, Han IJ, Lee BS, Park SY, Nho EY, Eom J, Suh JY, Kim G, Park J, Sung NY. Development of oral disintegration film containing naturally derived compounds using peptide collagen and a study of its functions. Asian Journal of Beauty and Cosmetology 18: 235-247. 2020.
Kim HJ, Kim SR, Park JK, Kim DI, Jeong JS, Lee YC. PI3Kγ activation is required for LPS-induced reactive oxygen species generation in respiratory epithelial cells. Inflammation Research 61: 1265-1272. 2012.
Kim ME, Jung YC, Jung I, Lee HW, Youn HY, Lee JS. Anti-inflammatory effects of ethanolic extract from Sargassum horneri (Turner) C. agardh on lipopolysaccharide-stimulated macrophage activation via NF-κB pathway regulation. Immunological Investigations 44: 137-146. 2015.
Ko W, Lee H, Kim N, Jo HG, Woo ER, Lee K, Han YS, Park SR, Ahn G, Cheong SH. The anti-oxidative and anti-neuroinflammatory effects of Sargassum horneri by heme oxygenase-1 induction in BV2 and HT22 cells. Antioxidants 10: 859. 2021.
Lee BJ, Lee SM, Hyun JH, Kim YY. Durability performances of concrete produced with recycled bio-polymer based on Sargassum honeri. Journal of the Korean Recycled Construction Resources Institute 7: 445-451. 2019.
Lee HG, Jayawardena TU, Liyanage NM, Song KM, Choi YS, Jeon YJ, Kang MC. Antioxidant potential of low molecular weight fucoidans from Sargassum autumnale against H2O2-induced oxidative stress in vitro and in zebrafish models based on molecular weight changes. Food Chemistry 384: 132591. 2022.
Lim SW, Ryoo HC, Lee SH. Understanding of skin aging and its prevention and care. The Journal of Skin Barrier Research 4: 71-80. 2002.
Madhavaraj L, Lim HD, Kim KM, Kim DH, Han GH. Influence of Sargassum horneri mitigating odorous gas emissions from swine manure storage facilities. Sustainability 12: 7587. 2020.
Malemud CJ. Matrix metalloproteinases (MMPs) in health and disease: an overview. Frontiers in Bioscience-Landmark 11: 1696-1701. 2006.
Mimić-Oka J, Simić DV, Simić TP. Free radicals in cardiovascular diseases. Facta Universitatis, Series: Medicine and Biology 6: 11-22. 1999.
Murakami S, Hirazawa C, Ohya T, Yoshikawa R, Mizutani T, Ma N, Moriyama M, Ito T, Matsuzaki C. The edible brown seaweed Sargassum horneri (Turner) C. Agardh ameliorates high-fat diet-induced obesity, diabetes, and hepatic steatosis in mice. Nutrients 13: 551. 2021.
Na EJ, Yang HO, Choi YE, Han HS, Rhie SJ, Ryu JY. Anti-inflammatory and collagen production effect of syringic acid on human keratinocyte (HaCaT) damaged by ultraviolet B. Asian Journal of Beauty and Cosmetology 4: 523-531. 2018.
Perron NR, Brumaghim JL. A review of the antioxidant mechanisms of polyphenol compounds related to iron binding. Cell Biochemistry and Biophysics 53: 75-100. 2009.
Pittayapruek P, Meephansan J, Prapapan O, Komine M, Ohtsuki M. Role of matrix metalloproteinases in photoaging and photocarcinogenesis. International Journal of Molecular Sciences 17: 868. 2016.
Pillai S, Oresajo C, Hayward J. Ultraviolet radiation and skin aging: roles of reactive oxygen species, inflammation and protease activation, and strategies for prevention of inflammation-induced matrix degradation: a review. International Journal of Cosmetic Science 27: 17-34. 2005.
Poljšak B, Dahmane R. Free radicals and extrinsic skin aging. Dermatology Research and Practice 2012: 135206. 2012.
Song YS, Li H, Balcos MC, Yun HY, Baek KJ, Kwon NS, Choi HR, Park KC, Kim DS. Fucoidan promotes the reconstruction of skin equivalents. The Korean Journal of Physiology and Pharmacology 18: 327-331. 2014.
Sanjeewa KKA, Jayawardena TU, Lee HG, Herath K, Jee Y, Jeon YJ. The protective effect of Sargassum horneri against particulate matter-induced inflammation in lung tissues of an in vivo mouse asthma model. Food and Function 10: 7995-8004. 2019.
Youn JS, Shin SY, Wu Y, Hwang JY, Cho JH, Ha YG, Kim JK, Park MJ, Lee S, Kim TH, et al. Antioxidant and anti-wrinkling effects of Aruncus dioicus var. kamtschaticus extract. Korean Journal of Food Preservation 19: 393-399. 2012.
|
|
|||||||||||||||||||||||||||||||||||