요약목적본 연구는 Derma GenieTM-H001을 이용하여 세포 내 항산화, 항염, 광보호, 항안드로겐 및 모발 성장과 연관된 유전자 발현 변화 등을 평가하여 탈모 증상 완화를 위한 기능성 화장품 원료로의 Derma GenieTM의 적용 가능성을 입증하였다.
방법항염 효능을 평가하기 위해서 NO assay를, 염증성 사이토카인의 유전자 발현 분석을 위해서는 qRT-PCR을 수행하였다. 모유두 세포 내 항산화 작용 및 광 보호 효능을 확인하기 위해서 H2O2 처리 및 UVB가 조사된 모유두 세포에서 WST-1 assay, DCF-DA assay, LDH leakage assay, UVB-irradiation assay 등이 시행되었다. 또한 모유두세포 내 모발 성장과 연관된 유전자 발현 변화를 확인하기 위해 qRT-PCR을 수행하였으며, 성장기 모발의 유도 가능성을 확인하였다.
결과Derma GenieTM-H001에서 폴리페놀류 화합물이 함유되어 있고, DPPH radical 소거능이 있음을 확인하였다. 2D monolayer 배양에서는 모유두세포에서 독성을 보이지 않고 세포 증식률을 증가시켰으며, 3D spheroid 배양에서 모유두세포 구형 크기를 증가시키는 것을 확인하였다. 염증성 인자인 산화 질소와 3종의 염증성 사이토 카인(TNF-α, IL-1β, NOS2)은 Derma GenieTM가 처리된 Raw 264.7 세포에서 현저하게 감소되었다. 또한 H2O2 처리 및 UVB가 조사된 모유두세포에서 Derma GenieTM가 상당한 세포 독성 완화 효능을 가지는 것을 확인했다. 마지막으로, qRT-PCR 분석을 통해 모발 퇴행을 야기하는 유전자 발현(AR, TGF-β1)은 감소시키고, 모발 성장에 필수적인 유전자 발현(ALPL, LEF1, VCAN, FGF2, FGF7, FGF10, WNT5A, VEGF)은 Derma Genie™ 처리군에서 농도 의존적으로 증가되는 것을 확인하였다.
AbstractPurposeThis study aimed to assess the potential of Derma Genie™-H001 as a functional cosmetic ingredient for alleviating hair loss symptoms by evaluating its impact on anti-inflammatory, antioxidative, photoprotective, antiandrogenicity, and activation of hair growth-related gene expression.
MethodsWe employed various methods, including nitric oxide (NO) assay and quantitative real-time polymerase chain reaction (qRT-PCR, to estimate anti-inflammatory activities). Additionally, this study assessed antioxidative and photoprotective effects on human dermal papilla cells (HDPCs) using water-soluble tetrazolium salt (WST-1) assay, 2′,7′-dichlorofluorescin diacetate (DCF-DA) assay, lactate dehydrogenase (LDH) assay, and ultraviolet B (UVB)-irradiation assay. To investigate the anti-hair loss effects of Derma Genie™-H001, 3D spheroid culture and qRT-PCR were conducted.
ResultsDerma Genie™-H001 exhibited the characteristics of polyphenols and demonstrated 2,2-dipheny-1-picrylhydrazyl (DPPH) radical scavenging activity. Importantly, it showed no cytotoxicity on HDPCs and increased the diameter of HDPCs 3D spheroid. Inflammatory mediators such as NO and proinflammatory cytokines were reduced in a dose-dependent manner in Raw 264.7 cells treated with Derma Genie™. Moreover, Derma Genie™ exhibited substantial protective effects against hydrogen peroxide (H2O2) and UVB-induced cytotoxicity in HDPCs. Notably, qRT-PCR analysis revealed a decrease in the expression of genes related to hair loss and an increase in the expression of genes associated with hair growth in HDPCs treated with Derma Genie™.
ConclusionDerma Genie™-H001 demonstrated promising effects in mitigating LPS-induced proinflammatory cytokines, H2O2-induced cytotoxicity, UVB-induced cytotoxicity, and DHT-induced TGF-β1 expression. Furthermore, it significantly upregulated the expression of hair growth-related genes. These findings suggest that Derma Genie™ may serve as a valuable functional cosmetic ingredient for improving hair loss symptoms.
中文摘要目的 本通过评估 Derma Genie™-H001 对抗炎、抗氧化、光保护、抗雄激素和激活毛发生长相关基因表达的影响,评估 Derma Genie™-H001作为缓解脱发症状的功能性化妆品成分的潜力。
方法 我们采用了多种方法, 包括一氧化氮(NO)测定和qRT-PCR,以评估抗炎活性。此外,本研究使用WST-1测定、DCF-DA 测定、LDH leakage assay, UVB-irradiation assay 评估了对人真皮乳头细胞 (HDPC) 的抗氧化和光保护作用。为了研究 Derma Genie™-H001 的抗脱发效果,进行了3D球体培养和qRT-PCR。
Introduction모발은 포유 동물에서 진화적으로 잘 보존되어 있는 감각 기관(sensory organ)이다. 외부 항원에 대한 면역 반응, 체온 조절, 혈관 생성, 신경 발생, 상처 치유 등은 모발의 주요 생리학적 기능으로 알려져 있다(Ji et al., 2021). 모발은 모낭(hair follicle)과 모간(hair shaft)으로 구성되며 끊임없이 재생되는 상피조직과는 다르게 성장기, 퇴행기, 휴지기라고 불리는 모주기(hair cycle)를 가지는 것이 특징이다(Park et al., 2018). 이와 같이 고도로 조직화된 기관인 모낭의 성장과 퇴행은 진피의 모유두세포(dermal papilla cell)와 표피의 모낭 줄기세포(hair follicle stem cell)의 상호적 신호 전달을 통해 조절된다(Daszczuk et al., 2020). 특히 모낭이 성장기로 전환되기 위해서는 다양한 신호 물질의 분비가 필요한데, 지방 전구세포에서는 PDGFα, 진피 모유두세포에서는 NOG, FGF7, FGF10, TGFβ2 생성의 증가가 필수적인 것으로 알려져 있다(Hsu et al., 2014). 선행 연구에서는 털이 없는 마우스에 모유두세포를 피하 주입하였을 때 모낭이 생성된 것을 통해, 모낭 생성 시 모유두세포의 중요성을 강조하고 있다(Jahoda et al., 1996). 또한 최근에는 모유두세포와 hydrogel, self-assembling peptide, collagen-chitosan scaffold 등 biomaterial을 활용한 조직 재생 기술이 연구되고 있는 실정이다(Ji et al., 2021).
안드로겐 의존성 탈모(androgenetic alopecia, AGA)와 원형 탈모(alopecia areata, AA)는 가장 흔한 탈모증으로, 모낭의 소형화(miniaturization)와 모간의 연모화(vellus hair) 등의 특징을 동반한다(York et al., 2020). 탈모의 정확한 원인 및 메커니즘(mechanism)은 아직 규명되지 않았는데, 최근 연구에서는 AGA 환자에서 과산화지방질의 표지인 malondialdehyde의 증가와 항산화 효소인 superoxide dismutase 등의 감소를 통해 AGA 환자의 체내 항산화능 감소를 확인하였다(Prie et al., 2016). 또한 AA 환자를 대상으로 한 연구에서는 혈액 내에서 8-deoxyguanosine, high mobility group box 1 등의 염증 유발 물질의 증가를 보여주고 있다(Mustafa et al., 2021). 이러한 선행 연구의 결과는 현재까지 알려져 있는 탈모의 원인과 더불어 산화 스트레스(oxidative stress) 및 염증(inflammation)이 탈모증과 깊은 연관성을 가지고 있음을 시사한다.
최근에는 탈모 예방 및 모발 성장에 도움을 주며 부작용이 적은 천연 유래 화장품 소재에 대한 연구가 활발히 진행되고 있다. 특히 식물 유래의 천연 생리활성 물질들은 항산화(anti-oxidant), 항0염(anti-inflammatory), 항균(anti-microbial), 항안드로겐(anti-androgenic) 등의 기능을 통해 탈모를 완화시키는 것으로 보고되어 있다(Dhariwala & Ravikumar, 2019; Ezekwe et al., 2020; Gupta et al., 2022). 본 연구에 사용한 Derma GenieTM-H001은 하수오(Pleuropterus multiflorus), 창포(Acorus calamus), 약모밀(Houttuynia cordata), 흰목이 버섯(Tremella fuciformis), 자소엽(Perilla folium)의 혼합 추출물이다. 하수오, 창포, 약모밀, 흰목이 버섯, 자소엽은 전통적으로 탈모 완화 및 육모 촉진 소재로 많이 활용되어온 천연물이다(Khwairakpam et al., 2018; Kim et al., 2019; Li et al., 2018; Park et al., 2011; Yoon et al., 2023). 특히 해당 생약들은 동아시아 등지에서 널리 사용해온 약용 식물로, 폴리페놀, 플라보노이드 및 페닐프로파노이드를 포함하는 파이토케미칼(phytochemical) 성분이 다량 함유되어 있어 항염 및 항산화 효능이 뛰어난 것으로 알려져 있다(Lee & Han, 2012; Li et al., 2014; Muthuraman & Singh, 2011; Shingnaisui et al., 2018; Yoon et al., 2023). 구체적으로, 하수오에는 갈산(gallic acid) 및 카테킨(catechin), 창포에는 알파-아사론(α-asarone) 및 베타-아사론(β-asarone), 약모밀에는 퀘르시트린(quercitrin) 및 하이페로사이드(hyperoside), 흰목이 버섯에는 글루쿠로노자일로만난(Glucuronoxylomannan), 자소엽에는 로즈마린산(rosmarinic acid) 등이 주로 함유되어 있다(Charachit et al., 2022; Han et al., 2013; Hermes et al., 2021; Yoon et al., 2023; Zhao et al., 2015). 또한 선행 연구에서 하수오는 항안드로겐 작용, 창포는 항산화 활성, 약모밀은 성장기 모낭 신호의 증가, 흰목이 버섯은 항염 작용, 자소엽은 성장기 모낭 신호의 증가 및 항안드로겐 작용을 하는 것으로 보고되어 있어, 세포 내 탈모 완화 및 육모 촉진 가능성이 연구된 바 있다(Esfandiari et al., 2018; Kim et al., 2019; Li et al., 2018; Shin et al., 2020; Shingnaisui et al., 2018; Yoon et al., 2023). 하지만 화장품에 이용되는 천연물 원료는 개별 추출물이 아닌 복합 추출물로 배합된 형태로 주로 사용되고 있으며 추출물의 혼합은 성분 간 상호작용으로 인해 효과가 상승된다는 연구가 보고된 바 있으므로, 해당 5가지 생약의 복합 추출물의 모유두 세포 내 모낭 생리 활성 촉진에 대한 연구는 추가적으로 필요할 것으로 보인다(Huang et al., 2005; Shin et al., 2020).
따라서 본 연구에서는 전통적으로 탈모 완화 소재로 활용되어 왔고, 세포 내 탈모 완화 및 육모 촉진 가능성이 연구된, 하수오, 창포, 약모밀, 흰목이 버섯, 자소엽을 복합 추출하여 각 생약의 장점을 활용하고자 하였으며, 해당 복합 추출물이 세포 내에서 항염, 항산화, 항안드로겐, 광보호 및 모발 성장에 필수적인 유전자 발현 증가 효능을 가지는지 분석하였다. 또한 이러한 세포 내 생리학적 기능을 통하여 현재 사용되는 합성 의약품을 대체할 수 있는 천연 탈모방지제 및 발모제 개발 가능성을 알아보고자 하였다.
Methods1. 시료 준비본 연구에 사용된 Derma GenieTM-H001은 5종의 약용식물(하수오, 창포, 약모밀, 흰목이 버섯, 자소엽)로 구성된 100% 열수(80℃) 추출물로, 흰목이 버섯 추출물은 ㈜피지스바이오 흰목이버섯연구센터(Korea)에서, 하수오, 창포, 약모밀 추출물은 ㈜에코업바이오(Korea)에서 제공받아 사용되었다. 하수오, 창포, 약모밀, 흰목이 버섯, 자소엽의 열수 추출물은 동일한 비율로 혼합하여 100 mL의 용액을 Whatman 여과지 No. 1 (Whatman, UK)을 사용하여 여과하였고, 이후 0.2 µM의 진공 여과기(Corning, USA)를 이용하여 추가 정제하였다. 여과물은 진공 하에 회전 증발 농축기(Rotavapor R-100; Buchi, Switzerland)를 사용하여 농축되었고, 이후 동결 건조기에서 48 h 동안 동결 건조하였다(TFD-100; ilShinBioBase Co., Ltd., Korea). 동결 건조된 복합 추출물은 원물 100 mL 당 2.78 g의 고형분을 수득할 수 있었으며, 건조물은 100 mg/mL 농도가 되도록 증류수(distilled water)에 용해하여 -20℃에서 보관하였다. 이후 시료는 항염, 항산화, 항안드로겐, 광보호 및 모발 성장능을 분석하기 위해 사용되었다.
2. 세포 배양연구에 사용된 마우스 대식세포(Raw 264.7 cells)는 한국 세포주 은행(No. 40071; KCLB, Korea)에서 분양 받았으며, 세포의 배양을 위해 RPMI-1640 medium (R8758; Sigma-Aldrich, USA)을 사용하였다. 인간 모유두세포(HDPCs)는 PromoCell (Germany)사에서 구입하였으며, 배양을 위한 배지로는 follicle dermal papilla cell growth medium (C-26501; PromoCell, Germany)을 사용하였다. 세포는 세포배양기를 이용하여 37℃, 5% CO2 상태에서 배양 및 유지하였다.
3. 세포 외 항산화능 측정 시험1) 총 폴리페놀 함량Folin-Denis (Folin & Denis, 1912) 방법을 응용 후 진행하였으며, 시약으로는 2N Folin-Ciocalteau's phenol reagent (Sigma-Aldrich)를 사용하였다. 알칼리 수용액상에서 Folin-Ciocalteau's phenol reagent의 몰리브덴산과 텅스텐산은 페놀화합물에 의해 환원되어 몰리브덴산염과 텅스텐산염을 형성한다. 몰리브덴산염과 텅스텐산염은 청색으로 발색되는 물질로 최대 765 nm의 흡광도를 가진다. Derma GenieTM 의 총 폴리페놀 함량은 gallic acid (Sigma-Aldrich)를 표준물질로 사용하여 분석하였다. 0, 0.05, 0.1, 0.2, 0.5, 1 mg/mL의 농도의 Derma GenieTM 100 µL를 2N Folin-Ciocalteau's phenol reagent 100 µL와 혼합하여 5 min 동안 실온에서 반응시켰다. 이후 10% Na2CO3 (Fluka, UK) 100 µL를 첨가한 후 암실에서 1 h 동안 반응시켜 Synergy HTX Multi-Mode Microplate Reader (Biotek, USA)를 이용하여 765 nm의 파장에서 흡광도를 측정한 뒤 결과 값을 분석하였다.
2) DPPH radical 소거 활성Derma GenieTM 의 항산화 활성을 측정하기 위해 선행 연구에서 기술된 방법을 응용 후 진행하였다(Blois, 1958). 시약으로는 자유 유리기(free radical)를 포함하고 있는 2,2-dipheny-1-picrylhydrazyl (DPPH; Sigma-Aldrich)을 사용하였으며, 520 nm에서 최대 흡광도를 가지는 DPPH가 항산화 물질에 의해 환원되면 색이 변하는 원리를 이용하여 시험을 진행하였다. 0, 0.05, 0.1, 0.2, 0.5 mg/mL 농도의 Derma GenieTM 희석액을 0.2 mM의 DPPH 용액과 1:1로 혼합하고, 암실에서 30 min 동안 반응시킨 뒤 520 nm의 파장에서 흡광도를 측정하였다. 양성 대조군으로는 5 µg/mL의 L-ascorbic acid (Sigma-Aldrich)를 사용하여 비교하였다.
4. Nitric oxide (NO) 생성물 측정Derma GenieTM의 항염 활성을 측정하기 위해 마우스 대식세포(Raw 264.7 cells)와 lipopolysaccharide (LPS; Sigma-Aldrich)를 이용해 시험을 진행하였다. 그리스 시약(Griess reagent; Sigma-Aldrich)은 아질산염과 화학 반응하여 보라색의 아조염을 형성하고 이것은 NO의 농도와 일치한다. Raw 264.7세포는 96-well plate에 각 well 당 5×103 cells씩 분주하여 24 h 동안 배양하였다. 이후 0, 0.2, 1 mg/mL 농도의 Derma GenieTM 를 처리한 후 10 ng/mL 농도의 LPS로 자극한 뒤 24 h 동안 추가 배양하였다. 새로운 96-well plate에는 100 µL의 그리스 시약을 첨가하고, 100 µL의 세포 상층액을 추가하여 혼합물을 생성하였다. 혼합물은 10 min 동안 반응시킨 후 540 nm의 파장에서 흡광도를 측정한 뒤 결과 값을 분석하였다.
5. 세포 생존율 및 독성 평가1) 인간 모유두세포를 이용한 세포 생존율 측정세포 독성의 평가는 water-soluble tetrazolium salt (WST-1) assay를 통해 진행되었다. 96-well plate에 HDPCs이 2×103 cells/well의 농도가 되도록 분주하여 24 h 동안 배양하였다. 이후 Derma GenieTM를 0, 0.1, 0.2, 0.4, 1 mg/mL의 농도로 처리한 뒤, 48 h 동안 추가 배양하였다. 배양된 세포는 세포 배양액을 제거한 뒤 phosphate buffer saline (PBS; Welgene, Korea)을 이용하여 1회 세척한 후 EZ-Cytox Cell Viability Assay Kit reagent (DoGenBio, Korea) 혼합액을 100 µL씩 처리하여 30 min 동안 세포배양기에서 반응시켰다. 이후 450 nm 파장에서 흡광도를 측정한 뒤 결과 값을 분석하였다.
2) Spheroid formation assay인간 모유두세포의 3D spheroid 배양은 선행 연구에서 기술된 방법을 응용하여 진행하였다(Abreu et al., 2021). HDPCs을 96-well round-bottom ultra-low attachment microplates (Corning, USA)에 2×103 cells/well의 농도가 되도록 접종한 후, 하나의 spheroid가 형성될 수 있도록 24 h 동안 배양하였다. 이후 Derma GenieTM를 0.05, 0.1, 0.2 mg/mL의 농도로 처리하여 24 h과 48 h 동안 각각 추가 배양하였다. Spheroid의 크기는 phase-contrast microscopy를 활용하여 직경(diameter)을 측정한 뒤 결과 값을 분석하였다.
3) H2O2에 의한 산화 스트레스 모델에서의 세포 생존율 측정Derma GenieTM 의 세포 생존율은 WST-1 assay를 통해 측정되었다. HDPCs은 96-well plate에 2×103 cells/well의 농도가 되도록 분주하여 24 h 동안 배양하였다. Derma GenieTM 를 0, 0.1, 0.2, 0.4, 1 mg/mL의 농도로 12 h, 24 h 동안 사전 처리하여 추가 배양하였다. 이후 세포 배양액에 150 µM의 hydrogen peroxide (H2O2; Daejung, Korea)를 처리한 후, 24 h 동안 추가 배양하였다. 음성 대조군으로는 H2O2 단독 처리군을, 양성 대조군으로는 2.5 mM 농도의 N-acetyl cysteine (NAC; Sigma-Aldrich)을 사용하였으며, WST-1 assay를 이용하여 세포 생존율을 측정하였다.
4) H2O2에 의한 산화 스트레스 모델에서의 세포 독성 측정세포 독성(cytotoxicity) 측정을 위해, 손상된 세포 및 사멸된 세포에서 방출되는 lactate dehydrogenase 활성을 배양액으로부터 확인하였다. HDPCs은 96-well plate에 각 well 당 3×103 cells씩 분주하여 배양한 뒤, Derma GenieTM 를 0, 0.1, 0.2, 0.4, 1 mg/mL의 농도에 맞춰 사전 처리하였다. 24 h 사전 처리 후 500 µM의 H2O2를 처리하여 24 h 동안 추가 배양하였다. 음성대조군으로는 H2O2 단독 처리군을 사용하였다. 이후 세포 배양액의 상층액을 각 10 µL씩 새로운 96-well plate에 분주한 후 EZ-LDH Cell Cytotoxicity Assay Kit reagent (Biomax, Korea) 혼합액을 각각 100 µL씩 처리하여 30 min 동안 세포배양기에서 반응시킨 뒤, 450 nm에서 흡광도를 측정하였다.
5) UVB irradiation 모델에서의 세포 생존율 측정인간 모유두세포를 96-well plate에 3×103 cells/well 농도가 되도록 분주하여 24 h 동안 배양하였다. Derma GenieTM를 0, 0.1, 0.2, 0.4, 1 mg/mL의 농도로 12 h 및 24 h 동안 사전 처리하여 추가 배양하였다. 이후 PBS로 1회 세척한 뒤에 각 well 당 50 µL의 PBS가 들어가도록 분주하여, 배양접시의 뚜껑이 없는 상태에서 15 mJ/cm2 의 UVB를 조사하였다. 다음으로 Derma GenieTM가 포함된 새로운 배양액으로 교체하여 24 h 추가 배양시킨 후, WST-1 assay를 이용하여 세포생존율을 측정하였다.
6. 세포 내 Reactive oxygen species (ROS) 정량 분석세포 내 ROS는 H2DCFDA (Sigma-Aldrich) 시약을 사용하여 측정하였다. H2DCFDA는 세포 내의 cellular esterase에 의해서 deacetylation되어 H2DCF를 형성, 이는 곧 세포 내 ROS에 의해서 DCF로 전환되어 형광 물질로의 검출이 가능한 원리를 이용하였다. HDPCs을 96 well plate에 4×103 cells/well의 농도로 접종한 후, 24 h 동안 배양하였다. 이후, Derma GenieTM 를 0, 0.1, 0.2, 0.4, 1 mg/mL의 농도로 24 h 동안 사전 처리하였다. 세포 배양액을 제거하여 PBS로 1회 세척한 후, 10 µM의 H2DCFDA 시약이 포함된 배지를 분주하여 30 min 동안 암실에서 실온 배양시켰다. 이후 세포 내 ROS 유도 및 형광을 생성하기 위하여 1 mM 농도의 H2O2를 처리한 뒤, 30 min 동안 암실에서 실온 배양시켰다. 음성 대조군으로는 H2O2 단독 처리군을 사용하였으며, 양성 대조군으로는 2.5 mM의 NAC을 처리하였다. 형광 값은 Synergy HTX Multi-Mode Microplate Reader를 이용하여 측정하였으며, excitation 485 nm, emission 520 nm의 형광 값을 이용해 분석하였다.
7. Quantitative real-time polymerase chain reaction (qRT-PCR)Derma GenieTM 를 처리한 Raw 264.7 세포 및 HDPCs 내의 유전자 발현 분석을 하고자 qRT-PCR을 이용하였다. Total RNA는 RiboEX reagent (GeneAll Biotechnology, Korea)를 통해 추출하였고 cDNA는 1 µg의 total RNA와 1.5 mM dNTPs, oligo dT primers, 5X First-Strand Buffer, 0.1 M DTT, 그리고 M-MLV reverse transcriptase (Thermo Fisher Scientific, USA)를 이용하여 합성하였다. qRT-PCR은 StepOnePlus Real-Time PCR system (Thermo Fisher Scientific)을 통해 수행되었고, 시약으로는 5x HOT FIREPol EvaGreen qPCR Mix Plus (Solis BioDyne, Estonia)를 사용하였다. 분석된 모든 유전자의 발현량은 glyceraldehyde 3-phosphate dehydrogenase (GAPDH)를 통해 정량되었다. PCR stage는 40 cycles 반복하여 형광도를 측정하였으며, holding stage는 95℃, 10 min denaturation하고, denaturation (95℃, 30 s), annealing (60℃, 30 s), extension(72℃, 30 s) 순으로 반복하여 수행하였다. mRNA의 발현량은 Ct값을 이용해 분석하였다. 분석에 사용된 특정 유전자의 primer 서열의 경우 Table 1과 같다.
Results and Discussion1. Derma GenieTM 의 세포 외 항산화능 평가1) 총 폴리페놀 함량 평가Derma GenieTM -H001의 총 폴리페놀 함량은 Folin-Denis 방법을 응용하여 측정하였다(Folin & Denis, 1912). 그 결과, Derma GenieTM 에는 0.05 mg/mL에서 1.78 µg GAE/g, 0.1 mg/mL에서 3.40 µg GAE/g, 0.2 mg/mL에서 6.46 µg GAE/g, 0.5 mg/mL에서 14.62 µg GAE/g, 1 mg/mL에서 27.92 µg GAE/g의 폴리페놀이 함유되어 있는 것을 확인하였다(Figure 1A).
2) DPPH radical 소거 활성 평가Derma GenieTM 의 DPPH radical 소거 활성능은 Blois 방법을 응용하여 측정하였다(Blois, 1958). 양성 대조군으로는 5 µg/mL의 ascorbic acid를 사용하였다. 그 결과, Derma GenieTM 0.1 mg/mL에서 31.25%, 0.2 mg/mL에서 55.94%, 0.5 mg/mL에서 69.08%, 1 mg/mL에서 68.28%의 DPPH radical 소거 활성을 가졌다(Figure 1B). 따라서 총 폴리페놀 함량 및 DPPH radical 소거 활성능을 통하여 Derma GenieTM 의 세포 내 항산화 기능의 작용 가능성을 확인하였다.
2. Derma GenieTM 의 항염증 평가2) 염증성 사이토카인 억제 평가원형 탈모증은 자가 면역질환(autoimmune disease)으로 비반 흔성 탈모(non-scarring hair loss)를 일으키는 것으로 알려져 있다(Pratt et al., 2017). 이러한 비반흔성 탈모는 다양한 염증성 사이토카인(inflammatory cytokines)에 의해 일어나는 것으로 연구되어 있는데, 면역 회피(immune privilege) 기관인 모낭의 항상성(homeostasis)을 파괴하는 물질로는 TNF-α, IL-6, IL-1β 그리고 IFN-γ 등이 보고되어 있다(Simakou et al., 2019; Tomaszewska et al., 2020). 따라서 Derma GenieTM의 염증성 사이토카인 발현 억제 효과를 확인하기 위해 Raw 264.7 세포에서 IL-1β, NOS2, 그리고 TNF-α 의 유전자 발현 분석을 수행하였다(Figure 2B-D). 음성 대조군(LPS 10 ng/mL)에서는 IL-1β, NOS2, TNF-α 의 발현이 각각 48085.66%, 565.55%, 939.82%로 미처리군에 비해 유의하게 증가하였다. 반면 Derma GenieTM 병용처리군(0.2, 1 mg/mL)에서는 IL-1β 발현이 31854.40%, 17244.86%로 농도 의존적으로 감소하였고(Figure 2B), NOS2 발현은 444.51%, 172.55%로 유의하게 감소하였으며(Figure 2C), TNF-α의 발현 또한 725.66%, 667.40%로 음성 대조군에 비해 통계적으로 유의하게 감소한 것을 확인하였다(Figure 2D). 결과적으로 Derma GenieTM 는 LPS에 의해 유도된 대식세포에서 염증성 사이토카인 발현의 억제 효능을 보였으며, 이러한 결과를 바탕으로 향후 강력한 항염증 효과를 지닌 탈모 완화 기능성 원료로써 활용되어질 수 있을 것으로 사료된다.
3. Derma GenieTM의 세포 생존율 평가1) 세포 생존율 평가Derma GenieTM가 모유두세포 내에서 항산화능 및 모발성장능에 어떠한 영향을 미치는지 알아보기 전에, HDPCs에서의 독성 유발 농도를 확인하였다. HDPCs에 0-1 mg/mL 농도의 Derma GenieTM를 48 h 동안 처리한 후, WST-1 assay를 통해 세포 생존율(cell viability)을 분석하였다. Figure 3A와 같이 HDPCs에 Derma GenieTM를 처리한 결과, 1 mg/mL 이하의 농도에서 독성이 나타나지 않았으며, 0.2, 0.4, 1 mg/mL의 농도에서 각각 105.50%, 109.61%, 124.43%로 세포 생존율이 증가하는 것을 확인하였다(Figure 3A). 본 실험의 결과로 추후 처리 농도를 최대 1 mg/mL로 하여 이후 실험을 진행하였다.
2) Spheroid culture model에서의 세포 증식률 평가모유두세포는 진피 간엽(dermal mesenchyme) 유래의 분화된 세포로 모낭 내 기저 부위인 모구(hair bulb)에 spheroid 형태로 존재하며 모낭 신생을 유도하는 것으로 알려져 있다(Huang et al., 2016). 이러한 삼차원 구 형태는 모유두세포 내 모낭 생성능(hair-inductive properties) 형성에 있어 중요하다. 특히 더 많은 모유두세포를 이용하여 spheroid 배양시킨 뒤, 누드 마우스 피부에 이식하였을 때 더 높은 모낭 생성능(induction efficiency)을 가진다는 것을 보여주어, 모유두세포의 spheroid 크기가 모낭 생성능에 있어서 중요하다는 점을 보여주고 있다(Huang et al., 2013). 따라서 Derma GenieTM가 모유두세포의 spheroid 크기에 어떠한 영향을 미치는지 확인한 결과, 24 h 처리 조건에서는 Derma GenieTM 0.05, 0.1, 0.2 mg/mL 처리군에서 각각 106.73%, 107.39%, 107.85%로 농도 의존적으로 증가하였으며, 48 h 처리 조건에서는 Derma GenieTM 0.05, 0.1, 0.2 mg/mL 처리군에서 각각 104.86%, 108.42%, 109.95%로 유의하게 증가하는 것을 확인하였다(Figure 3B). 이러한 결과는 Derma GenieTM가 2차원 및 3차원 배양 조건 내 모유두 세포에서 독성을 유발하지 않고 세포 증식률을 증가시키는 안전한 천연물로의 가능성을 시사한다.
4. H2O2에 의한 산화 스트레스 모델에서 Derma GenieTM의 세포 독성 보호 효과모유두세포 내 산화 스트레스(oxidative stress)는 세포 노화(senescence)를 일으키고, 세포의 생리학적 특성을 감소시켜 follicular keratinocyte의 분화와 증식을 억제해 모낭 퇴행을 야기한다고 알려져 있다(Huang et al., 2017; Ma et al., 2023). 따라서 Derma GenieTM가 세포 내 항산화 기능 및 세포독성 완화 효능을 가지는지 확인하기 위해 H2O2에 의한 산화 스트레스 모델에서 WST-1 assay를 수행하였다.
Figure 4A와 같이 Derma GenieTM의 12 h 사전처리군(0.1, 0.2, 0.4, 1 mg/mL)에서는 세포 생존율이 각각 82.50%, 87.04%, 88.21%, 95.09%로 음성 대조군(74.67%)에 비해 세포 생존율이 현저히 증가함을 확인하였다. 유사하게, Derma GenieTM의 24 h 사전 처리군(0.1, 0.2, 0.4, 1 mg/mL)에서는 음성 대조군(78.84%)에 비해 세포 생존율이 개선되었으며 각각 85.72%, 86.19%, 90.68%, 95.84%로 통계적으로 유의하게 증가하였다. 이러한 결과를 통해, Derma GenieTM가 세포 외 항산화능과 더불어 모유두세포 내 강력한 항산화 기능을 수행하는 천연 소재로의 가능성을 확인하였다(Figure 4B).
5. UVB-irradiation 모델에서 Derma GenieTM의 세포독성 보호 효과모낭 내 과도한 UVB 조사는 모발의 성장을 억제하고, 빠른 퇴행기 모낭을 유도하는 것으로 알려져 있다(Lu et al., 2009). 또한 UVB는 세포 내 DNA damage 및 ROS를 증가시켜 세포 노화를 촉진하므로, UVB가 조사된 모유두 세포 내 광 손상을 억제하기 위한 소재 연구가 활발히 진행되고 있는 실정이다(Ahn, 2017; Madaan et al., 2018). 따라서 UVB가 조사된 모유두세포에서 Derma GenieTM의 세포독성 보호 효과를 확인하기 위해 Derma GenieTM를 0-1 mg/mL 농도로 12 h, 24 h 사전 처리하였다. 이후 UVB 15 mJ/cm2을 조사한 뒤 다시 24 h 동안 0-1 mg/mL 농도의 시료를 처리한 후, WST-1 assay를 수행하였다(Figure 5). Figure 5A와 같이 UVB 15 mJ/cm2를 조사한 음성대조군의 경우 세포 생존율이 72.13%로 감소하였으나, Derma GenieTM 24 h사전처리군(0.4, 1 mg/mL)에서는 세포 생존율이 각각 77.62%, 80.48%로 음성대조군에 비해 유의하게 증가함을 확인하였다. 따라서 Derma GenieTM는 모유두세포 내에서 광손상에 의한 세포독성을 보호할 수 있음을 확인하였다(Figure 5B).
6. Derma GenieTM의 모유두세포 내 활성 산소 및 독성 완화 평가산화 스트레스가 유도되는 경우 세포 내 ROS 및 LDH level이 증가하므로 Derma GenieTM의 모유두세포 내 활성산소 및 독성 완화 정도를 알아보고자 하였다(Figure 6). 먼저, 세포 내 활성산소 생성량을 확인하고자, HDPCs에 Derma GenieTM를 0-1 mg/mL 농도로 24 h 동안 사전 처리한 뒤, 산화 스트레스를 유도하였다. 그 결과, 음성 대조군(H2O2 1000 µM)에 비해 Derma GenieTM 사전처리군에서 통계적으로 유의한 ROS 감소 효과를 확인하였다(Figure 6A). 음성 대조군은 무처리군에 비해 세포 내 ROS양이 198.72%로 유의하게 증가하였고, Derma GenieTM 사전처리군은 0.1, 0.2, 0.4, 1 mg/mL 농도에서 각각 132.69%, 120.42%, 87.62%, 67.36%로 활성산소 생성 정도가 현저히 감소하는 것을 확인하였다(Figure 6A). 이후 산화 스트레스 모델 내 추가적인 세포 독성 완화 정도를 평가하기 위해 LDH leakage assay를 수행한 결과, 음성대조군(H2O2 500 µM)에 비해 Derma GenieTM 사전처리군(0.1, 0.2, 0.4, 1 mg/mL)에서 LDH 생성량이 농도 의존적으로 감소하는 것을 확인하였다(Figure 6B). 이처럼 산화 스트레스가 유도된 모유두세포 내 Derma GenieTM의 활성산소 감소 및 세포독성 완화 효능은(Figure 6), Figure 4와 더불어 모유두세포 내에서 강력한 항산화 기능을 수행할 것으로 예측된다.
7. Derma GenieTM의 모발 성장 관련 유전자 발현에 미치는 영향모낭은 모주기(hair cycle)라는 조직의 독특한 순환 구조를 가지며, 모낭 내 모유두세포는 중간엽(mesenchyme) 유래의 세포군으로 모낭줄기세포의 분화와 증식을 유도하여 모낭 생성을 일으키는 주요 신호 전달자로 알려져 있다(Morgan, 2014). 모유두세포가 성장기 모낭을 유도하기 위해서는 다양한 모발 성장 관련 유전자들의 발현이 필수적인데, 이 중에서도 FGF7, FGF10, NOG, ALPL, LEF1, VCAN, VEGF, FGF2, WNT5A 등은 모낭 성장을 유도하는 주요 유전자로 밝혀졌다(Madaan et al., 2018). 반면 남성형 탈모의 원인으로 알려진 dihydrotestosterone (DHT)은 모낭 퇴행을 유도하는데 이 때, androgen receptor (AR) 및 TGF-β1 등이 연관되어 있음이 보고되어 있다(Shin et al., 2013). 따라서 Derma GenieTM가 HDPCs 내모낭 퇴행과 관련된 유전자 발현에 미치는 영향을 분석한 결과, DHT 처리에 의해 증가된 AR (177.46%)과 TGF-β1 (126.36%) 발현량이 Derma GenieTM 병용처리시(0.04 mg/mL, 0.1 mg/mL) 농도 의존적으로 감소함을 확인하였다(Figure 7A-B). 특히, DHT와 Derma GenieTM(0.1 mg/mL)의 병용처리군에서 AR 발현량은 104.38%, TGF-β1 발현량은 83.81%로 음성대조군에 비해 유의하게 감소함을 확인하였다.
이후에는, Derma GenieTM가 모낭 성장을 유도하는 유전자 발현에 미치는 영향을 확인하였다. Figure 7C의 결과를 통해서, HDPCs의 표식 유전자(signature gene)인 ALPL, LEF1, VCAN의 발현이 Derma GenieTM처리군(0.1 mg/mL)에서 각각 151.96%, 234.46%, 1199.67%로 현저하게 증가함을 확인하였다. 또한 성장기 모낭 유도에 필수적인 5종(WNT5A, FGF7, FGF10, FGF2, VEGF)의 유전자 발현량을 확인한 결과, Derma GenieTM 처리군(0.1 mg/mL)에서 각각 480.57%, 354.76%, 485.04%, 988.52%, 170.07%로 무처리군에 비해 상당히 증가된 유전자 발현 양상을 확인할 수 있었다(Figure 7C). 이는 Derma GenieTM가 세포 내 항염, 항산화, 광보호 작용을 일으킴과 더불어 모낭 퇴행을 유도하는 유전자들의 발현은 낮추고, 모낭 생성에 필수적인 유전자들의 발현은 높여 탈모 완화 및 육모 효능을 가지는 기능성 소재로 활용될 수 있음을 시사하고 있다.
Conclusion본 연구는 5종의 생약(하수오, 창포, 약모밀, 흰목이 버섯, 자소엽) 복합 추출물인 Derma GenieTM-H001의 탈모 완화 및 육모 촉진 효능을 in vitro 모델 내에서 확인하고자 하였다. In vitro 모델 내 탈모 완화 효능을 확인하기 위해서는 Derma GenieTM의 세포 내 항산화, 항염, 항안드로겐 및 광보호 효과를 평가하였고, 세포 내 육모 촉진 효능을 확인하기 위해서는 Derma GenieTM의 세포 생존율 개선 및 모발 성장에 필수적인 유전자 발현 증가 효능을 평가하였다. 특히 탈모증의 주요 병인학적 요인으로 알려져 있는 과잉 안드로겐(hyperandrogen), 산화 스트레스(oxidative stress), 과염증 반응 (hyperinflammatory response), 광 손상(photodamaging) 등을 유도하여 세포 내 스트레스를 유발하였으며, 이에 대한 Derma GenieTM의 세포 보호 및 스트레스 완화 효능을 입증하여 탈모 완화 기능성 원료로써 Derma GenieTM의 가능성을 제시하였다(Devjani et al., 2023; Ma et al., 2023; Pi é rard-Franchimont et al., 2010; Shakoei et al., 2023; Simakou et al., 2019). 또한, 이차원 및 삼차원 배양 조건 내 모유두 세포의 증식 효과 및 모발 성장에 필수적인 8종의 유전자(VCAN, ALPL, LEF1, FGF7, FGF10, VEGF, FGF2, WNT5A) 발현 증가 효능을 통해 Derma GenieTM의 육모 및 발모 활성 가능성을 검증하였다.
구체적으로는, 모유두세포 내 Derma GenieTM가 세포 독성 및 증식율에 미치는 영향을 확인한 결과, 2D monolayer 배양 조건에서는 최대 1 mg/mL농도에서 124.43%의 세포 증식효과를 보였다. 또한 3D spheroid 배양 조건에서는 1 mg/mL 농도의 48 h처리 조건에서 109.95%의 spheroid 크기 증가를 확인하여, 종합적으로 Derma GenieTM가 모유두세포의 증식 및 성장을 향상시키는 것을 확인할 수 있었다.
다음으로는, 탈모증과의 연관성이 보고된 다양한 스트레스 요인(H2O2, LPS, UVB)을 세포 내 유도하여, 이에 대한 Derma GenieTM의 독성 완화 효능을 확인하고자 하였다(Ma et al., 2023). 특히 LPS(10 ng/mL) 처리를 통한 염증성 사이토카인 IL-1β, NOS2, TNF-α의 유전자 발현 증가는 Derma GenieTM 병용처리를 통해 현저하게 감소되었다. 또한 H2O2 (150 µM)를 처리한 모유두세포의 경우 세포 생존율이 78.84%로 감소하였는데, Derma GenieTM 1 mg/mL을 24 h 사전 처리한 경우 세포생존율이 95.84%로 회복되어 무처리군과 유사한 수치로 생존율이 개선되는 것을 확인할 수 있었다. 유사하게, UVB (15 mJ/cm2)를 조사한 모유두세포에서 72.13%로 낮아진 세포 생존율이 1 mg/mL로 24 h 사전 처리한 경우 세포 생존율이 80.48%로 개선되는 것을 보여주고 있다. 특히, H2O2 (1000 μM)를 처리한 경우 198.96%로 증가된 ROS양이 Derma GenieTM의 병용처리를 통해 농도 의존적으로 감소되는 양상을 보이므로, Derma GenieTM가 세포 내 강력한 항염, 항산화, 광보호 효능을 가지는 천연물 유래 소재임을 확인할 수 있었다.
이후, 모유두세포 내 세포 증식률 증가 및 스트레스 유도 모델에서의 독성 완화 효능을 보인 Derma GenieTM가 모낭 성장과 관련된 주요 유전자 발현을 조절하는지 알아보고자 하였다. AR과 TGF-β1는 안드로겐에 의해 증가하며, 모낭 퇴행을 유도하는 대표적인 유전자로 알려져 있다(Shin et al., 2013). DHT (100 nM)에 의해서 증가된 AR, TGF-β1의 유전자 발현량이 Derma GenieTM의 병용처리에 따라 유의하게 감소하는 것을 통해 Derma GenieTM의 항안드로겐 작용 가능성을 확인할 수 있었다. 또한 모유두세포 내 모발 생장에 필수적인 유전자 발현 양상을 확인한 결과 모유두세포 내 3종의 표식 유전자(VCAN, ALP, LEF1)와 5종의 성장기 모낭 유도 유전자(FGF7, FGF10, VEGF, FGF2, WNT5A) 모두 Derma GenieTM을 처리한 군에서 농도 의존적으로 증가한 것을 확인하였다. 휴지기의 모낭이 성장기로 전환되기 위해서는 진피 모유두세포에서 분비되는 FGF7, FGF10, NOG 등의 paracrine factor의 증가가 필수적이다(Hsu et al., 2014). 따라서 Derma GenieTM의 처리를 통한 인간 모유두세포 내에서의 발모 유도 유전자의 증가는 탈모를 예방 및 억제할 수 있는 가능성이 높은 기능성 물질로의 중요성을 뒷받침하고 있다.
최근의 연구 논문들은 모낭 세포 내 산화 스트레스, 고안드로겐증 및 과염증 반응이 탈모의 주요 병인학적 원인임을 제시하고 있으며, 이는 모유두세포 내 산화 스트레스, 안드로겐 수용 및 염증에 대한 억제가 탈모를 조절하는데 중요한 신규 전략으로 제시될 수 있음을 시사한다(Park et al., 2023; Sakib et al., 2021). 본 연구에서는, Derma GenieTM가 모유두세포에서 산화적 스트레스 및 자외선 조사에 의한 세포 손상을 억제할 뿐만 아니라 Raw 264.7 세포 내 항염 작용과 더불어 모유두세포 내 모발 성장에 필수적인 유전자 발현은 증가시키고, 모발 퇴행을 유도하는 유전자 발현은 감소시키는 것을 확인하였다. 따라서 추후 임상학적 연구를 통해 Derma GenieTM가 인체 두피 조직 내 도포에 따른 영향을 분석함으로써, 탈모 완화 및 육모 촉진의 기능성 소재로 개발하는데 기초 자료로써의 활용 가능성을 제시하였다.
AcknowledgementsThis work was supported by the Korea Environment Industry & Technology Institute (KEITI) grant funded by the Korea Ministry of Environment (MOE) (2021003240004) and the Commercializations Promotion Agency for R&D Outcomes (COMPA) grant funded by the Korea government (MSIT) (No. 2021B401).
NOTESAuthor's contribution
Conceptualization, SP, SA, and JL; Methodology, SP and JL; Software, SP; Validation, SP, NH, BL, YC, SB, SA, and JL; Formal analysis, SP; Investigation, SP, NH, BL, YC, SB, SA, and JL; Resources, SA and JL; Data curation, SP; Writing-original draft preparation, SP, SA, and JL; Writing-review and editing, SP, NH, BL, YC, SB, SA, and JL; Visualization, SP, SA, and JL; Supervision, JL; project administration, JL; Funding acquisition, SA and JL. All authors have read and agreed to the published version of the manuscript.
Author details
Seokmuk Park (Graduate Student), Department of Cosmetics Engineering, Graduate School of Konkuk University, 120 Neungdong-ro, Gwangjin-gu, Seoul 05029, Korea; Nayeon Han (Graduate Student), Department of Cosmetics Engineering, Graduate School of Konkuk University, 120 Neungdong-ro, Gwangjin-gu, Seoul 05029, Korea; Bo Liu (Graduate Student), Department of Cosmetics Engineering, Graduate School of Konkuk University, 120 Neungdong-ro, Gwangjin-gu, Seoul 05029, Korea and (Assistant Professor), Department of Beauty Health, Namsoul University, 91, Daehak-ro, Seonghwan-eup, Seobuk-gu, Cheonan-si, Chungcheongnam-do 31020, Korea; Younsang Choi (CEO), Tremella fuciformis R&D Center, Physisbiofarm Corporation, 706 Deogyuwolseong-ro, Seosang-myeon, Hamyang-gun, Gyeongsangnam-do 50000, Korea; Seunghee Bae (Professor), Department of Cosmetics Engineering, Graduate School of Konkuk University, 120 Neungdong-ro, Gwangjin-gu, Seoul 05029, Korea; Sungkwan An (Senior Researcher), ANX, Inc., 373 Chang-ui-ri, Seorak-myeon, Gapyeong-gun, Gyeonggi-do 477852, Korea; Jungmin Lee (CEO), Dermato Bio, Inc., #505, Techno Cube, 13-18 Songdogwahak-ro 16beon-gil, Yeonsu-gu, Incheon 21984, Korea.
Figure 1.Antioxidant activities of Derma Genie™-H001.(A) Total polyphenol content of Derma Genie™. The absorbance was measured at 765 nm, and the calibration curve of 0–100 μg/mL gallic acid as a standard material was y=0.0324χ+0.0545, R2=0.9989. (B) DPPH radical scavenging activity of Derma Genie™. Ascorbic acid (5 µg/mL) was used as a positive control and Derma Genie™ showed DPPH radical scavenging activity. The results are presented as mean ± SD of three independent experiments. *p<0.05, **p<0.01, ***p<0.001 compared with the vehicle treated group as determined by one-way ANOVA. DPPH, 2,2-dipheny-1-picrylhydrazyl.
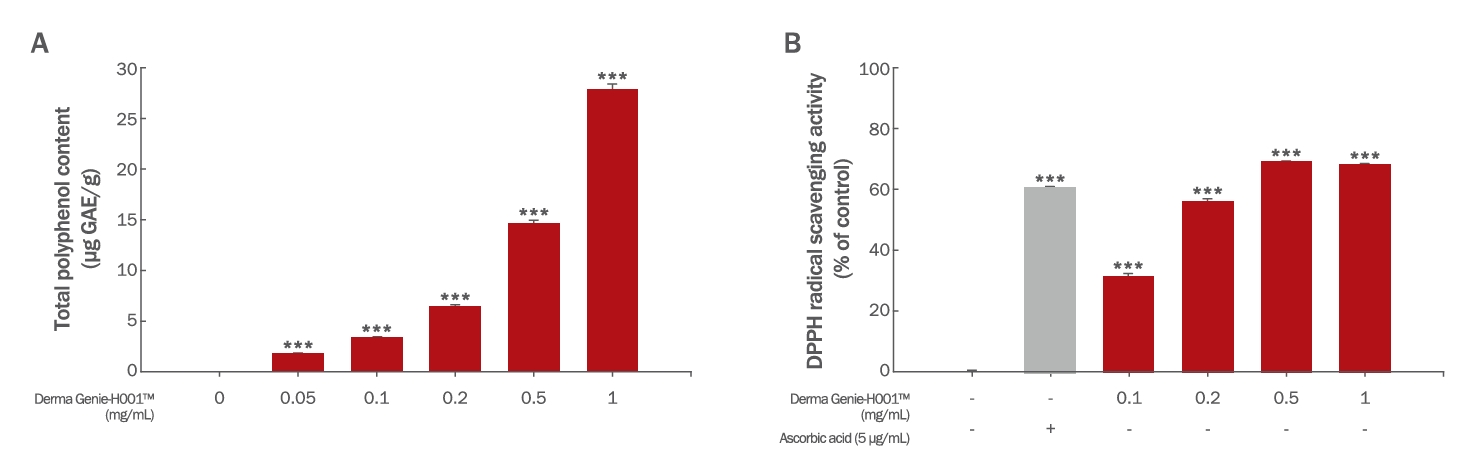
Figure 2.Anti-inflammatory effects of Derma Genie™-H001 on LPS-stimulated Raw 264.7 cells.(A) Raw 264.7 cells were seeded into 96-well plates and stimulated with 10 ng/mL LPS. Raw 264.7 cells were treated with the indicated doses of Derma Genie™. After 24 h of incubation, the amounts of nitric oxide were measured by Griess reaction assay. (B-D) The expression levels of IL-1β (B), NOS2 (C) TNF-α (D) were measured by qRT-PCR in Raw 264.7 cells treated with the indicated doses of LPS and Derma Genie™. The results are presented as the mean ± SD of three independent experiments. ###p<0.001 indicates significance from vehicle treated group and *p<0.05, **p<0.01, ***p<0.001 indicates significance from LPS-stimulated group as determined by one-way ANOVA. LPS, lipopolysaccharide; qRT-PCR, quantitative reverse transcription polymerase chain reaction.

Figure 3.Effects of Derma Genie™-H001 on cell viability and spheroid size of HDPCs.(A) HDPCs were seeded in 96-well plates and treated with the indicated doses of Derma Genie™ for 48 h. The WST-1 assay was used to evaluate cell viability and cytotoxicity on 2D monolayer culture. No toxicity was observed in the HDPCs. (B) A 96-well clear round-bottom ultralow attachment microplate was used to measure the volume of the HDPC spheroid. The cells were treated with 0.05–0.2 mg/mL of Derma Genie™ for 24 and 48 h. The results are presented as the mean±SD of three independent experiments. **p<0.01, ***p<0.001 compared with the vehicle treated group as determined by one-way ANOVA. HDPCs, human dermal papilla cells; WST-1, water-soluble tetrazolium salt-1.
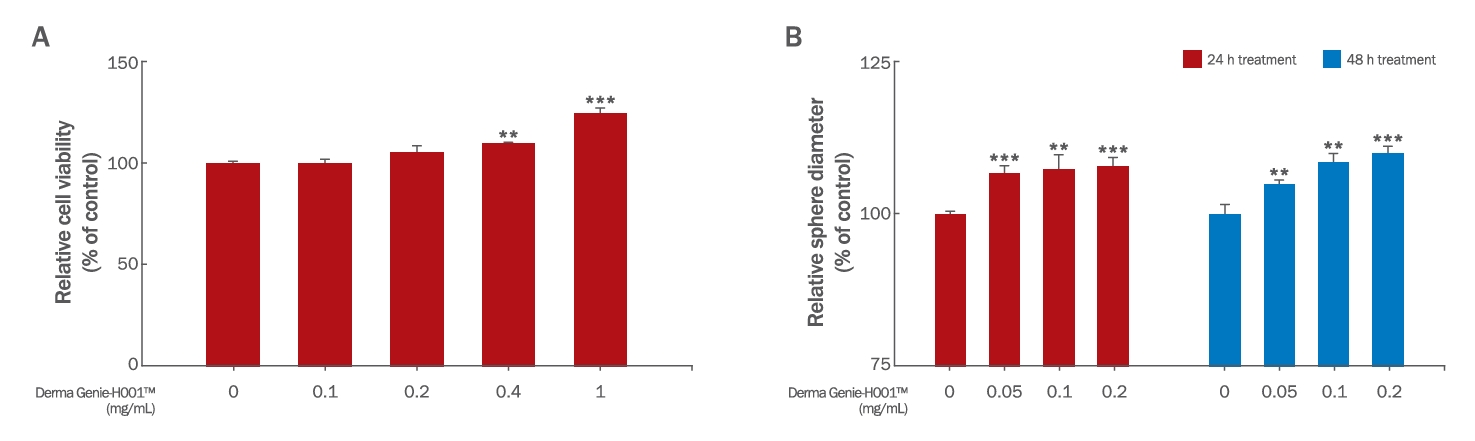
Figure 4.Protective effect of Derma Genie™-H001 on H2O2-induced cytotoxicity in HDPCs.(A) HDPCs were incubated with Derma Genie™ for 12 and 24 h, followed by treatment with 150 μM H2O2 for 24 h, and cell viability was measured using the WST-1 assay. (B) Phase-contrast images of H2O2-induced HDPCs after 24 h. All values represent the mean ± SD of three independent experiments. ###p<0.001 indicates significance from vehicle treated group and *p<0.05, **p<0.01, ***p<0.001 indicates significance from H2O2-treated group as determined by one-way ANOVA.

Figure 5.Protective effect of Derma Genie™-H001 on UVB-induced cytotoxicity in HDPCs.(A) HDPCs were incubated with Derma Genie™ for 12 and 24 h, followed by irradiation with UVB 15 mJ/cm2 for 24 h, and cell viability was measured by WST-1 assay. (B) Phase-contrast images of UVB-stimulated HDPCs were captured after 24 h. All values represent the mean±SD of three independent experiments. ###p<0.001 indicates significance from vehicle treated group and **p<0.01, ***p<0.001 indicates significance from UVB-stimulated group as determined by one-way ANOVA. UVB, ultraviolet B.
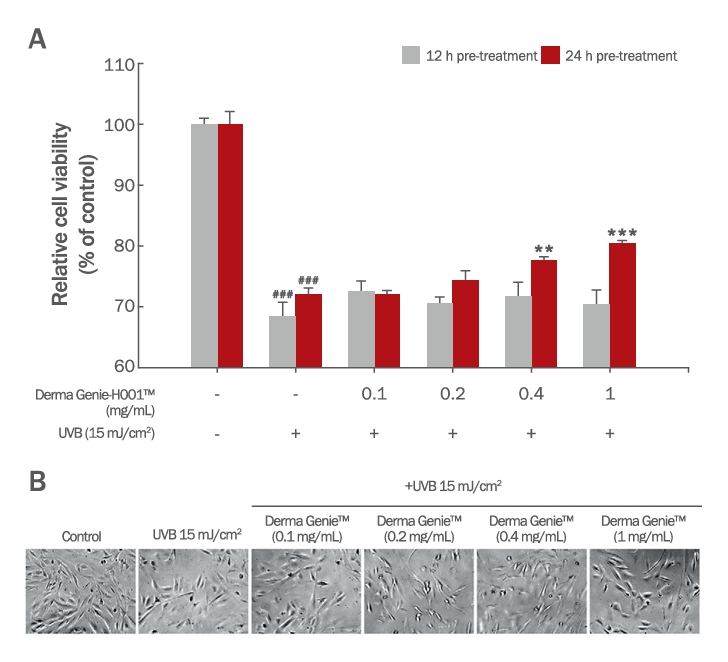
Figure 6.Ameliorative effects of Derma Genie™-H001 on intracellular ROS levels and cellular damage in H2O2-induced HDPCs.(A) Intracellular ROS levels were measured using the dichlorofluorescein diacetate (DCFDA) method. HDPCs were treated with the indicated doses of Derma Genie™ for 24 h and then labeled with 10 µM DCFDA for 30 min. The cells were treated with 1 mM H2O2 and analyzed immediately using a fluorescent plate reader. (B) Oxidative stress-induced cellular damage was assessed via the LDH leakage assay. (C) The subcellular localization of DCFDA was observed using an Axiovert 200 UV microscope. All values represent the mean ± SD of three independent experiments. ###p<0.001 indicates significance from vehicle treated group and ***p<0.001 indicates significance from H2O2-treated group as determined by one-way ANOVA. ROS, reactive oxygen species; DCFDA, dichlorofluorescein diacetate.
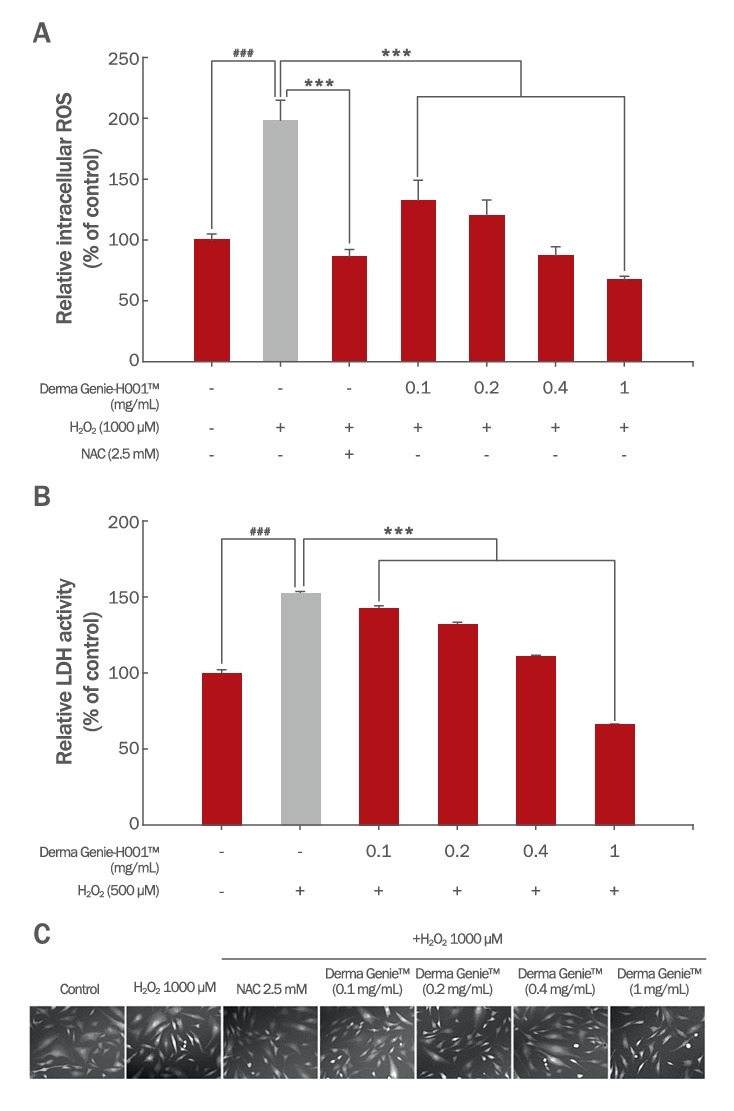
Figure 7.Effects of Derma Genie™-H001 on expression of hair growth-related genes in HDPCs.(A-B) HDPCs were treated with the indicated doses of Derma Genie™ and DHT for 8 h. The mRNA expression levels of hair loss-related genes (AR and TGF-β1) were assessed by qRT-PCR and normalized against GAPDH. (C) HDPCs were treated with 0–0.1 mg/mL of Derma Genie™ for 8 h. The mRNA expression levels of hair growth-related genes (ALPL, VCAN, LEF1, VEGF, FGF2, WNT5A, FGF7, and FGF10) were assessed by qRT-PCR and normalized against GAPDH. All values represent the mean ± SD of three independent experiments. *p<0.05, **p<0.01, ***p<0.001 indicates significance from vehicle treated group and #p<0.05, ##p<0.01 indicates significance from DHT-treated group as determined by one-way ANOVA. DHT, dihydrotestosterone
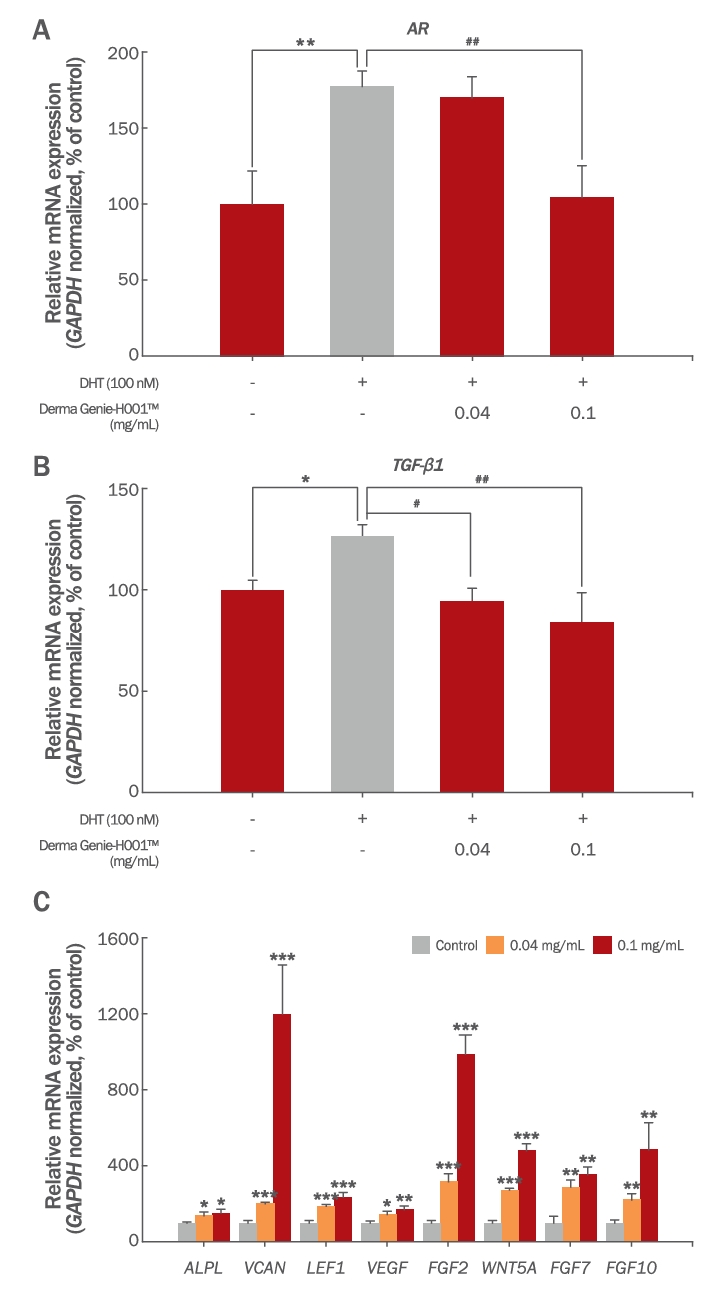
Table 1.List of primers for quantitative real time polymerase chain reaction Gapdh, glyceraldehyde-3-phosphate dehydrogenase; IL-1β, interleukin 1 beta; TNF-α, tumor necrosis factor alpha; NOS2, nitric oxide synthase 2; GAPDH, glyceraldehyde-3-phosphate dehydrogenase; WNT5A, Wnt family member 5A; ALPL, alkaline phosphatase; VCAN, versican; FGF2, fibroblast growth factor 2; VEGF, vascular endothelial growth factor; LEF1, lymphoid enhancer binding factor 1; FGF7, fibroblast growth factor 7; FGF10, fibroblast growth factor 10; AR, androgen receptor; TGF-β1, transforming growth factor beta 1. The primers for the genes Gapdh, IL-1β, TNF-α, and NOS2 were designed to target gene sequences in the species Mus musculus (house mouse). Conversely, the primers for GAPDH, WNT5A, ALPL, VCAN, FGF2, VEGF, LEF1, FGF7, FGF10, AR, and TGF-β1 were designed to target gene sequences in Homo sapiens (human). ReferencesAbreu CM, Cerqueira MT, Pirraco RP, Gasperini L, Reis RL, Marques AP. Rescuing key native traits in cultured dermal papilla cells for human hair regeneration. Journal of Advanced Research 30: 103-112. 2021.
Ahn KJ. Photoprotective effects of caffeic acid against Ultraviolet-induced damages on human follicle dermal papilla cells. Asian Journal of Beauty and Cosmetology 15: 105-111. 2017.
Blois MS. Antioxidant determinations by the use of a stable free radical. Nature 181: 1199-1200. 1958.
Charachit N, Sukhamwang A, Dejkriengkraikul P, Yodkeeree S. Hyperoside and quercitrin in Houttuynia cordata extract attenuate UVB-Induced human keratinocyte cell damage and oxidative stress via modulation of MAPKs and Akt signaling pathway. Antioxidants (Basel). 11: 221. 2022.
Daszczuk P, Mazurek P, Pieczonka TD, Olczak A, Boryń Ł M, Kobielak K. An intrinsic oscillation of gene networks inside hair follicle stem cells: an additional layer that can modulate hair stem cell activities. Frontier in Cell and Developmental Biology 8: 595178. 2020.
Devjani S, Ezemma O, Kelley KJ, Stratton E, Senna M. Androgenetic alopecia: therapy update. Drugs 83: 701-715. 2023.
Dhariwala MY, Ravikumar P. An overview of herbal alternatives in androgenetic alopecia. Journal of Cosmetic Dermatology 18: 966-975. 2019.
Esfandiari E, Ghanadian M, Rashidi B, Mokhtarian A, Vatankhah AM. The effects of Acorus calamus L. in preventing memory loss, anxiety, and oxidative stress on lipopolysaccharide-induced neuroinflammation rat models. International Journal of Preventive Medicine 9: 85. 2018.
Ezekwe N, King M, Hollinger JC. The use of natural ingredients in the treatment of alopecias with an emphasis on central centrifugal Cicatricial alopecia: a systematic review. The Journal of Clinical and Aesthetic Dermatology 13: 23-27. 2020.
Folin O, Denis W. On phosphotungstic-phosphomolybdic compounds as color reagent. Journal of Biological Chemistry 12: 239-243. 1912.
Gupta AK, Talukder M, Bamimore MA. Natural products for male androgenetic alopecia. Dermatologic Herapy 35: e15323. 2022.
Han DQ, Zhao J, Xu J, Peng HS, Chen XJ, Li SP. Quality evaluation of Polygonum multiflorum in China based on HPLC analysis of hydrophilic bioactive compounds and chemometrics. Journal of Pharmaceutical and Biomedical Analysis 72: 223-30. 2013.
Hermes L, Römermann J, Cramer B, Esselen M. Quantitative analysis of β-asarone derivatives in Acorus calamus and herbal food products by HPLC-MS/MS. Journal of Agricultural and Food Chemistry 69: 776-782. 2021.
Hsu YC, Li L, Fuchs E. Emerging interactions between skin stem cells and their niches. Nature Medicine 20: 847-856. 2014.
Huang CF, Chang YJ, Hsueh YY, Huang CW, Wang DH, Huang TC, Wu YT, Su FC, Hughes M, Chuong CM, et al. Assembling composite dermal papilla spheres with adipose-derived stem cells to enhance hair follicle induction. Scientific Reports 6: 26436. 2016.
Huang D, Ou B, Prior RL. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry 53: 1841-56. 2005.
Huang WY, Huang YC, Huang KS, Chan CC, Chiu HY, Tsai RY, Chan JY, Lin SJ. Stress-induced premature senescence of dermal papilla cells compromises hair follicle epithelial-mesenchymal interaction. Journal of Dermatological Science 86: 114-122. 2017.
Huang YC, Chan CC, Lin WT, Chiu HY, Tsai RY, Tsai TH, Chan JY, Lin SJ. Scalable production of controllable dermal papilla spheroids on PVA surfaces and the effects of spheroid size on hair follicle regeneration. Biomaterials 34: 442-451. 2013.
Jahoda CA, Oliver RF, Reynolds AJ, Forrester JC, Horne KA. Human hair follicle regeneration following amputation and grafting into the nude mouse. The Journal Investigative Dermatology 107: 804-7. 1996.
Ji S, Zhu Z, Sun X, Fu X. Functional hair follicle regeneration: an updated review. Signal Transduction and Targeted Therapy 6: 66. 2021.
Khwairakpam AD, Damayenti YD, Deka A, Monisha J, Roy NK, Padmavathi G, Kunnumakkara AB. Acorus calamus: a bio-reserve of medicinal values. Journal of Basic and Clinical Physiology and Pharmacology 29: 107-122. 2018.
Kim J, Shin JY, Choi YH, Jang M, Nam YJ, Lee SY, Jeon J, Jin MH, Lee S. Hair growth promoting effect of Hottuynia cordata extract in cultured human hair follicle dermal papilla cells. Biological and Pharmaceutical Bulletin 42: 1665-1673. 2019.
Lee HA, Han JS. Anti-inflammatory effect of Perilla frutescens (L.) Britton var. frutescens extract in LPS-stimulated RAW 264.7 macrophages. Preventive Nutrition and Food Science 17: 109-115. 2012.
Li H, Lee HS, Kim SH, Moon B, Lee C. Antioxidant and anti-inflammatory activities of methanol extracts of Tremella fuciformis and its major phenolic acids. Journal of Food Science 79: C460-468. 2014.
Li JJ, Li Z, Gu LJ, Choi KJ, Kim DS, Kim HK, Sung CK. The promotion of hair regrowth by topical application of a Perilla frutescens extract through increased cell viability and antagonism of testosterone and dihydrotestosterone. Journal of Natural Medicines 72: 96-105. 2018.
Lu Z, Fischer TW, Hasse S, Sugawara K, Kamenisch Y, Krengel S, Funk W, Berneburg M, Paus R. Profiling the response of human hair follicles to ultraviolet radiation. The Journal of Investigative Dermatology 129: 1790-1804. 2009.
Ma YQ, Sun Z, Li YM, Xu H. Oxidative stress and Alopecia areata. Frontiers in Medicine 10: 1181572. 2023.
Madaan A, Verma R, Singh AT, Jaggi M. Review of hair follicle dermal papilla cells as in vitro screening model for hair growth. International Journal of Cosmetic Science 40: 429-450. 2018.
Morgan BA. The dermal papilla: an instructive niche for epithelial stem and progenitor cells in development and regeneration of the hair follicle. Cold Spring Harbor Perspectives in Medicine 4: a015180. 2014.
Mustafa AI, Khashaba RA, Fawzy E, Baghdady SMA, Rezk SM. Cross talk between oxidative stress and inflammation in Alopecia areata. Journal of Cosmetic Dermatology 20: 2305-2310. 2021.
Muthuraman A, Singh N. Attenuating effect of Acorus calamus extract in chronic constriction injury induced neuropathic pain in rats: an evidence of anti-oxidative, anti-inflammatory, neuroprotective and calcium inhibitory effects. BMC Complementary and Alternative Medicine 11: 24. 2011.
Park AM, Khan S, Rawnsley J. Hair biology: growth and pigmentation. Facial Plastic Surgery Clinics of North America 26: 415-424. 2018.
Park HJ, Zhang N, Park DK. Topical application of Polygonum multiflorum extract induces hair growth of resting hair follicles through upregulating Shh and β-catenin expression in C57BL/6 mice. Journal of Ethnopharmacology 135: 369-375. 2011.
Park S, Han N, Lee JM, Lee JH, Bae S. Effects of Allium hookeri extracts on hair-inductive and anti-oxidative properties in human dermal papilla cells. Plants (Basel) 12: 1919. 2023.
Piérard-Franchimont C, Quatresooz P, Piérard GE. Effect of UV radiation on scalp and hair growth. In: Aging hair. In: Trüeb R, Tobin D, eds. Springer. Berlin, Heidelberg. pp113-121. 2010.
Pratt CH, King LE Jr, Messenger AG, Christiano AM, Sundberg JP. Alopecia areata. Nature Reviews Disease Primers 3: 17011. 2017.
Prie BE, Iosif L, Tivig I, Stoian I, Giurcaneanu C. Oxidative stress in Androgenetic alopecia. Journal of Medicine and Life 9: 79-83. 2016.
Sakib SA, Tareq AM, Islam A, Rakib A, Islam MN, Uddin MA, Rahman MM, Seidel V, Emran TB. Anti-Inflammatory, Thrombolytic and hair-growth promoting activity of the n-hexane fraction of the methanol extract of Leea indica leaves. Plants (Basel) 10: 1081. 2021.
Shakoei S, Mirmiranpoor H, Nakhjavani M, Nasimi M, Bakhshi G, Azizpour A. Oxidative stress and antioxidant markers in patients with Alopecia areata: a comparative cross-sectional study. Indian Journal of Dermatology, Venereology and Leprology 89: 411-415. 2023.
Shin H, Yoo HG, Inui S, Itami S, Kim IG, Cho AR, Lee DH, Park WS, Kwon O, Cho KH, et al. Induction of transforming growth factor-beta 1 by androgen is mediated by reactive oxygen species in hair follicle dermal papilla cells. BMB Reports 46: 460-464. 2013.
Shin JY, Choi YH, Kim J, Park SY, Nam YJ, Lee SY, Jeon JH, Jin MH, Lee S. Polygonum multiflorum extract support hair growth by elongating anagen phase and abrogating the effect of androgen in cultured human dermal papilla cells. BMC Complementary Medicine and Therapies 20: 144. 2020.
Shingnaisui K, Dey T, Manna P, Kalita J. Therapeutic potentials of Houttuynia cordata Thunb. Against inflammation and oxidative stress: A review. Journal of Ethnopharmacology 220: 35-43. 2018.
Simakou T, Butcher JP, Reid S, Henriquez FL. Alopecia areata: A multifactorial autoimmune condition. Journal of Autoimmunity 98: 74-85. 2019.
Tomaszewska K, Kozłowska M, Kaszuba A, Lesiak A, Narbutt J, Zalewska-Janowska A. Increased serum levels of IFN-γ, IL-1β, and IL-6 in patients with Alopecia areata and Nonsegmental vitiligo. Oxidative Medicine an Cellular Longevity 2020: 5693572. 2020.
Yoon Y, Han N, Lee JH, Bae S, Lee J. Review of the effects of Tremella fuciformis Berk extract as a functional phytochemical. Asian Journal of Beauty and Cosmetology 21: 151-164. 2023.
|
|
|||||||||||||||||||||||||||||||||||||