자외선 A에 의해 유도된 인간각질형성세포 손상에 대한 Scutellarin의 항산화 효과
Anti-oxidant Effects of Scutellarin in UVA-irradiated HaCaT Cells
Scutellarin对紫外线A诱导损伤的人皮肤角质形成细胞的抗氧化作用
Article information
Abstract
목적
본 연구의 목적은 ultraviolet A (UVA)로부터 산화적 스트레스가 유도된 인간각질형성세포에서 scutellarin의 산화억제 효능을 확인하는데 있다.
방법
Scutellarin의 항산화 효능을 확인하기 위하여 water-soluble tetrazolium salt (WST-1) assay를 이용한 세포독성 측정, 2′,7′-dichlorofluorescin diacetate (DCFDA) assay를 통한 세포 내 활성산소종 정량분석 그리고 quantitative realtime polymerase chain reaction (qRT-PCR)을 통해 superoxide dismutase 1 (SOD1), catalase (CAT) 및 glutathione peroxidase 1 (GPx1) mRNA의 발현 조절 양상을 측정하였다.
결과
Scutellarin는 그 자체로 독성을 보이지 않았고, 농도의존적으로 UVA로부터 세포를 보호하는 효과가 있음이 확인되었다. UAV 조사에서는 세포 내 ROS가 2.15 배 증가하였으나 csutellarin 전처리 군에서는 1.61-1.20 배로 감소하였다. UVA 조사에 의해 저하된 SOD1, CAT 및 GPx1 mRNA의 발현은 scutellarin의 전처리 군에서 농도 의존적으로 증가 하였다.
결론
본 연구결과를 통하여 scutellarin이 인간각질형성세포에서의 항산화 방어 메커니즘의 조절을 확인하였고, 향후 scutellarin이 기능성 화장품 개발에 응용될 수 있는 소재로서의 활용을 확인하기 위하여 추가적인 기전 연구가 필요할 것으로 사료된다.
Trans Abstract
Purpose
This study was to investigate the anti-oxidant activity of scutellarin in ultraviolet A (UVA)-irradiated HaCaT cells.
Methods
To confirm the anti-oxidant effects of scutellarin, water-soluble tetrazolium salt (WST-1) was used to determine the cytotoxicity, 2′,7′-dichlorofluorescin diacetate (DCFDA) was used to quantitatively analyze intracellular reactive oxygen species (ROS), and quantitative real-time polymerase chain reaction (qRT-PCR) was used to determine the regulation of superoxide dismutase 1 (SOD1), catalase (CAT) and glutathione peroxidase 1 (GPx1) mRNA expression.
Results
As a result, scutellarin had no toxicity, and effectively protected HaCaT cells from UVA in a concentration dependent manner. The intracellular ROS was increased by 2.15 times after cell irradiated with UVA, but decreased by 1.61-1.20 times in scutellarin pretreatment group. The expression of SOD1, CAT and GPx1 mRNA, which was downgraded by UVA irradiation, was upregulated in a concentration dependent manner in the scutellarin pretreatment group.
Conclusion
This study confirmed that scutellarin regulated anti-oxidant defense mechanisms in HaCaT cells. Future research will be needed to confirm the application of scutellarin as a material for the development of functional cosmetics.
Trans Abstract
目的
探讨scutellarin对ultraviolet A (UVA)诱导氧化应激的人皮肤角质形成细胞的抗氧化作用。
方法
为确定scutellarin的 抗氧化作用,利用water-soluble tetrazolium salt (WST-1) assay测定scutellarin的细胞毒性,利用2′,7′-dichlorofluorescin diacetate (DCFDA) assay定量分析细胞内活性氧(reactive oxygen species, ROS)以及利用 quantitative real-time polymerase chain reaction(qRT-PCR)测定superoxide dismutase 1(SOD1),cat alase(CAT)以及glutathione peroxidase 1(GPx1)mRNA的表达量。
结果
Scutellarin自身不具有毒性,并且按浓度依赖性具有从UVA保护细胞的作 用。在UVA照射下,细胞内增加了2.15倍ROS,而在scutellarin预处理群中,发现ROS降低1.61-1.20倍。在UVA照射下, SOD1,CAT 以及GPx1 mRNA的表达明显降低,但在scutellarin预处理群中,发现按浓度依赖性增加了其表达量。
结论
通过研究确认了scutellarin在人皮肤角质形成细胞内的抗氧化机制,将来仍需进一步研究来确认scutellarin作为功能性化妆品开发原料的应用。
Introduction
최근 의료과학의 발전, 경제성장, 생활수준의 향상으로 인간의 평균수명이 연장되어 노령화 추세가 가속화되고 있다. 이에 인간의 항노화에 관한 관심이 더욱 증가되고 있으며, 특히 피부의 형태학적 변화는 직접 눈으로 관찰할 수 있어 피부노화 예방에 많은 관심이 집중되고 있다. 피부노화는 내인성 인자뿐만 아니라 외인성 인자에 의존하는 복합적인 과정이며(Wohlrab, 2016), 외적 노화는 주로 자외선으로 인한 광노화에 의해 발생되며 내적 노화를 촉진시킨다. 태양광선은 인간의 세포내외에서 활성 산소종(ROS)을 생성시키므로 피부 노화는 주로 자외선 노출과 관련된다. 피부는 광노화로 인하여 깊은 주름과 잔주름 생성, 과색소 침착, 피부건조 및 가려움, 탄력 감소 및 염증발생 등의 변화가 나타난다(Ahn, 2017; Han et al., 2016).
자외선의 영역은 크게 단파장인 UVC (200–280 nm), 중파장인 UVB (280–320 nm) 및 장파장인 UVA (320–400 nm)로 구분된다. 에너지가 강하여 피부암 유발이 높은 UVC는 오존층에서 차단되므로 피부에 직접적인 영향을 미치는 자외선은 UVB와 UVA이다. 그 중 UVA는 95% 정도를 차지하며 에너지는 상대적으로 약하지만 지속적으로 노출되면 다양한 조직에서의 피부 손상을 일으킨다. 일상 자외선이라 불리는 UVA는 자외선의 가장 보편적인 요소로써 세포나 피부에 산화 스트레스 손상을 주며, 피부 깊숙이 침투하여 피부결합 조직의 심각한 변화를 유도한다. UVA의 유해한 영향은 세포 수준에서 입증되었고 세포 기능과 조직 손상의 연쇄적인 손상을 초래했으며(Battie et al., 2014; Ikehata & Ono, 2011; Kripke, 1991) 그 외 피부에 미치는 수많은 생물학적 영향을 갖는다. UVA는 인간각질형성세포의 세포 독성과 콜라겐 분해를 통해 조기 피부 노화와 관련한 발병기전에서 중요한 역할을 하며, 이를 통해 유발된 산화적 스트레스는 콜라겐 손상을 야기하는 metalloprotease-1의 유도를 매개한다(Pluemsamran et al., 2012). 결과적으로 자외선은 피부암 뿐만 아니라 활성산소에 기인한 조기 피부 노화를 발생시킨다(Kammeyer & Luiten, 2015; Shah & He, 2015).
McCord는 정상적인 호흡 시에 25개의 산소분자가 환원될 때마다 1개의 프리라디칼(free radical)이 생성된다고 보고하였다(McCord & Fridovich, 1969). 생체내에서 항산화 물질과 항산화 효소가 균형을 이루게 되면 활성산소를 제거하여 정상적인 대사작용을 가지게 된다. 그러나 필수불가결하게 신체 내에서 발생되는 활성산소가 항산화시스템 불균형으로 신체 내에서 제때에 제거되지 못하면 산화적 손상을 일으켜 각종 질병과 피부노화의 원인이 된다(Blois, 1958; Kappus, 1986).
피부는 크게 바깥으로부터 표피층, 진피층, 피하조직으로 구성되어 있으며 주요 기능은 자외선, 외부 환경오염 물질 및 미생물 등의 침입을 방지하고 수분손실을 막는 피부 보호장벽의 역할을 한다(Feingold & Elias, 2014). 피부 노화는 기능적, 구조적으로 변화되어 탄력 저하, 기미 및 주근깨 침착, 유분 저하, 수분 손실 증가, 각질세포 응집력 강화, 주름 증가 등으로 나타난다(Freedberg, 1999).
Scutellarin은 황금, 골무 등에 포함된 성분으로 페놀화합물의 일종인 flavone에 속한다. 동양에서는 한약재로도 쓰이며 효능에 관한 연구들이 각 분야별로 진행되어 왔다. 플라보노이드(flavonoid)의 일종인 scutellarin은 효율적인 항산화제로 알려져 있으며(Liu et al., 2002), 산화적 스트레스를 줄여주고 세포 사멸을 조절함으로써 PC12 세포보호, 치매 쥐의 손상된 학습 능력과 기억력의 회복, 심근 세포에서 허혈, 재관류 손상을 예방한다(Guo et al., 2011; Hong & Liu, 2007; Wang et al., 2016)고 보고되었다. 하지만 scutellarin이 UVA 조사에 의해 산화적 스트레스가 유발된 인간각질형성세포에서 산화적 스트레스를 경감시키는 효능이 있는지에 대한 연구는 아직 미미한 실정이다. 본 연구에서는 scutellarin의 항산화 연구와 관련하여 각질형성세포에서 SOD1, CAT 및 GPx1 mRNA 발현 조절에 미치는 영향을 확인해 보고, UVA 조사에 의해 증가된 활성산소가 scutellarin에 의해 억제되어 보호되는지 확인하고자 한다. 결과적으로 scutellarin이 인간각질형성세포에서 UVA에 의해 유도된 산화적 스트레스를 경감시켜 항산화 시스템을 보호하는지 입증하고, 이를 통해 scutellarin의 항노화 화장품 소재로서의 가능성을 알아보고자 한다.
Methods
1. 세포배양 및 시료처리
본 실험에는 인간각질형성세포주인 HaCaT cell (American Type Culture Collection, USA)이 사용되었다. 세포배양은 10% fetal bovine serum (FBS; HycloneTM, GE Healthcare Life Sciences, USA)과 1% penicillin/streptomycin (HycloneTM) 이 첨가된 Dulbecco’s Modified Eagle Medium (DMEM; HycloneTM)배지를 사용하여 37℃, 5% CO2 세포배양기 조건에서 배양되었다. Scutellarin (Sigma-Aldrich, USA)은 분말타입으 로 구매하였고 실험에 사용할 때는 dimethyl sulfoxide (DMSO; Sigma-Aldrich)에 적정 농도별로 용해하여 사용하였고, UVA는 UV-A lamp (UVP, USA)를 이용하여 10 J/cm2 의 강도로 조사 하였다.
2. 세포생존율 측정
Scutellarin의 세포독성 실험은 EZ-cytox Cell Viability Assay Kit (Itsbio, Korea)을 사용하였다. 세포생존율은 세포 내 소기관인 미토콘드리아의 탈수소효소에 의해 생성되는 formazan의 흡광도를 측정하는 원리인 WST-1 assay을 이용하였다. 인간각질형성세포(3×103 cells/well)를 96-well plate에 100 μL씩 분주한 후 24 h 배양 후 scutellarin과 UVA를 적정 농도 처리하고 24 h 배양하였다. 배양된 세포에 EZcytox Cell Viability Assay Kit reagent 10 μL를 첨가하여 1h 배양 후 iMakrTMmicroplate absorbance reader (Bio-Rad Laboratories, USA)를 이용하여 450 nm에서 흡광도를 측정하였으며, 실험은 3회 반복 수행하여 세포생존율 평균값을 도출하였다.
3. mRNA 추출과 cDNA 합성
배양된 세포로부터의 mRNA 추출은 Trizol reagent (InvitrogenTM, Thermo Fisher Scientific, USA)를 이용하여 mRNA를 추출하였으며, 추출된 mRNA는 Nanodrop (Maestrogen, USA)을 이용하여 순도를 측정하여 260/280nm의 ratio 1.8 이상의 mRNA만을 실험에 사용하였다. cDNA는 1 μg RNA를 대상으로 Moloney Murine Leukemia Virus reverse transcriptase (M-MLV RT; Enzynomics, Korea)을 이용하여 합성하였다.
4. qRT-PCR 측정
UVA와 scutellarin에 의해 인간각질형성세포내에서 일어나는 SOD1, CAT, GPx1 유전자 발현패턴을 정량적으로 분석하기 위하여 SYBR green (InvitrogenTM)을 이용하였으며, Line-Gene K real-time PCR detection system (BioER, China)를 사용하여 PCR을 진행하였다. PCR 결과의 유효성은 melting curve로 검증하였으며, 각 유전자의 발현은 β-actin 의 발현을 표준화하여 비교 분석 하였다. 실험에 사용된 유전자의 primer는 Table 1과 같다.
5. 세포내 ROS 변화량 측정
세포 내 활성산소종 농도 변화를 측정하기 위하여 DCFDA (Sigma-Aldrich) assay를 사용하였다. 소수성 비형광물질인 DCFDA가 세포막을 투과한 후 세포내 ROS에 의해 산화되면 녹색의 형광을 띄는 DCF로 변환된다는 원리를 이용하여 측정하였다. 인간각질형성세포를 2×105 cells/well로 분주하여 24 h 배양 후 scutellarin을 전처리한 후에 추가로 다시 배양하였다. 세포를 수확하기 전에 DCFDA를 10 μM 첨가하여 30 min 배양 후 수확한 세포를 PBS로 세척하고 1% trypsin-EDTA를 처리하여 수확한 세포를 phosphate-buffered saline (PBS)로 다시 세척하여 BD FACSCaliburTM flow cytometer (BD Biosciences, USA)를 이용하여 ROS량을 측정하였다(excitation λ: 485 nm, emission λ: 530 nm). N-acetyl-L-cystein (NAC; Calbiochem, USA)은 실험의 양성대조군으로 동일한 과정을 거쳤다.
6. 통계처리
본 연구의 모든 실험은 동일한 조건하에 3회 이상 반복 수행하였다. 실험결과는 평균±표준 편차로 나타내었다. 실험결과는 student’ t -test로 검정하였고, 유의 수준은 0.05 이하인 경우 통계적으로 유의하다고 분석하였다.
Results and Discussion
1. Scutellarin의 UVA에 의한 세포독성 보호효과
인간각질형성세포에서 scutellarin 자체의 세포 독성을 확인하기 위해서 인간각질형성세포에 scutellarin을 각각 0, 0.5, 1, 5 μM의 농도로 처리한 후, 세포생존율을 측정하였다. 분석 결과, 모든 농도에서 세포독성이 나타나지 않았다(Figure 1A). 한편 인간각질형성세포에서 UVA에 대한 scutellarin의 세포보호효과를 확인하기 위하여 96-well plate에 인간각질형성세포를 3×103 cells/well로 분주하여 24 h 배양 후 scutellarin을 각각 0, 0.5, 1, 5, 10 μM의 농도로 6 h 전처리하고, UVA는 10 J/cm2의 강도로 조사하여 24 h 배양하였다. 그 결과 세포생존율은 인간각질형성세포에 UVA를 조사한 군에서 무처리군에 비해 61%의 세포생존율을 보였으나, scutellarin을 0.5, 1, 5, 10 μM 전처리한 군에서는 세포생존율은 각각 75%, 84%, 90%까지 농도 의존적으로 증가하여 높은 세포보호효과를 확인하였다(Figure 1B). 결과적으로 인간각질형성세포에서 UVA에 의해 유도되는 세포독성 및 세포 생장 저해에 scutellarin이 보호효과가 있음을 확인하였다.
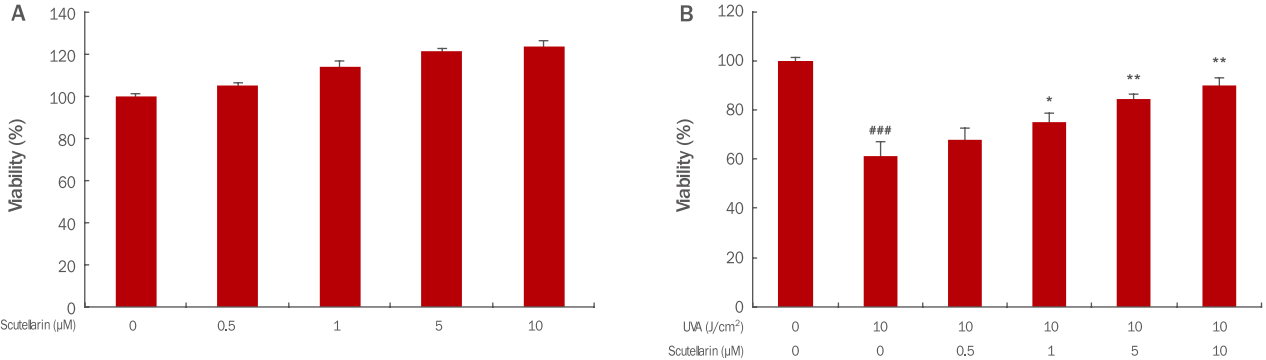
Cell viability of scutellarin in HaCaT cells and in UVA-irradiated HaCaT cells.
HaCaT cells (3×103) were seeded on 96-well plate and then incubated for 24 h. Then, the cells were treated with 0.5, 1, 5, and 10 μM of scutellarin in each well. After additional incubation, cell viability of scutellarin in HaCaT cells (A) and in UVA-irradiated HaCaT cells (B) was measured by the WST-1 assay respectively. The graph represents the M±S.D. of the relative cell viability in each sample from triplicate experiments (* p<0.05, **p<0.01 compared with UVA irradiated cells without scutellarin; ###p<0.001 compared with negative controls that were not treated scutellarin and UVA irradiation). UVA, ultraviolet A; WST-1, water-soluble tetrazolium salt; M±S.D., mean±standard deviation.
2. 세포내 ROS 억제 효과
Scutellarin이 UVA에 의해 세포내 발생하는 ROS의 억제 효능을 확인한 결과 인간각질형성세포에 UVA를 10 J/cm2 강도로 조사하였을 때 UVA를 조사하지 않은 무처리대조군에 비해 ROS 생성량이 2.15배 증가하였으나 scutellarin을 1, 5, 10 μM 전처리한 군에서의 ROS는 각각 1.61, 1.36, 1.20배로 농도 의존적으로 감소하였다. 10 J/cm2 강도로 UVA만 조사하였을 때와 비교하여 scutellarin 10 μM 전처리하였을 때 ROS 억제 효능은 1.20배 였고 양성대조군인 NAC 10 mM로 처리했을 때는 1.03배로 확인되었다(Figure 2). 농도 대비 효과로 비교해보면 ROS 소거제인 NAC에 비하여 scutellarin이 더 효과적인 것을 확인할 수 있었다.
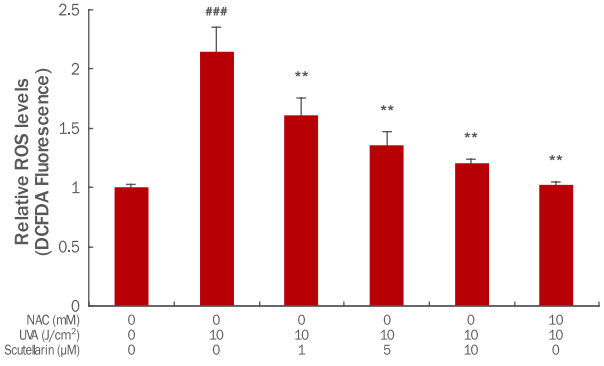
The ROS scavenging effects of scutellarin in UVA-induced HaCaT cells.
HaCaT (2×105) cells were seeded on 60 mm culture dish and then incubated for 24 h. Prior to UVA, the cells were pretreated with 1, 5 and 10 μM of scutellarin and 10 mM NAC. Then, the cells were washed by PBS and irradiated by 10 J/ cm2 UVA. After further incubation for 24 h, the ROS level was measured by the flow cytometer. The graph represents the M±S.D. of the ROS level in each sample from triplicate experiments. The Student's t-test was conducted to determine statistical significance (**p<0.01 compared with UVA irradiated cells without scutellarin and NAC; ###p<0.001 compared with negative controls that were not treated scutellarin, NAC and UVA irradiation). ROS, reactive oxygen species; DCFDA, 2′,7′-dichlorofluorescin diacetate; NAC, N-acetyl-L-cystein; UVA, ultraviolet A; PBS, phosphate-buffered saline; M±S.D., mean±standard deviation.
3. SOD1, CAT 및 GPx1 mRNA expression 조절
세포내 산화적 스트레스를 줄이는 대표적인 항산화 효소인 SOD는 초과산화이온을 산소와 과산화수소로 바꿔 주는 불균등화 반응을 촉매하는 효소이다. 산소에 노출되는 거의 모든 세포에서 항산화 방어기작을 하여 체내의 활성산소 농도를 낮추는 역할을 한다(McCord & Fridovich, 1969). SOD 효소군은 크게 3가지로 나누는데 그 중 하나인 SOD1은 주로 세포질에 존재하며 산소가 존재하는 모든 조직에서 활성산소를 감소시킨다(Crapo et al., 1992). Scutellarin의 항산화 기전을 확인하기 위하여 SOD1 의 인간각질형성세포내에서의 유전자 발현 변화 조절을 확인하기 위하여 qRT-PCR을 수행하였다. 그 결과 인간각질형성세포에 UVA를 10 J/cm2 강도로 조사하였을 때 UVA를 조사하지 않은 무처리대조군에 비해 SOD1 mRNA 발현이 0.61배 하향되었으나, scutellarin을 1, 5, 10μM 전처리한 군에서는 각각 0.70, 0.93, 1.13배로 상향 조절되었다(Figure 3A). 그러므로 인간각질형성세포에서 UVA 조사로 인해 감소한 SOD1 유전자가 scutellarin 전처리를 통해 농도 의존적으로 상향 조절됨으로써 활성산소에 의한 조직손상을 보호하는 방어기전으로 역할을 한다.
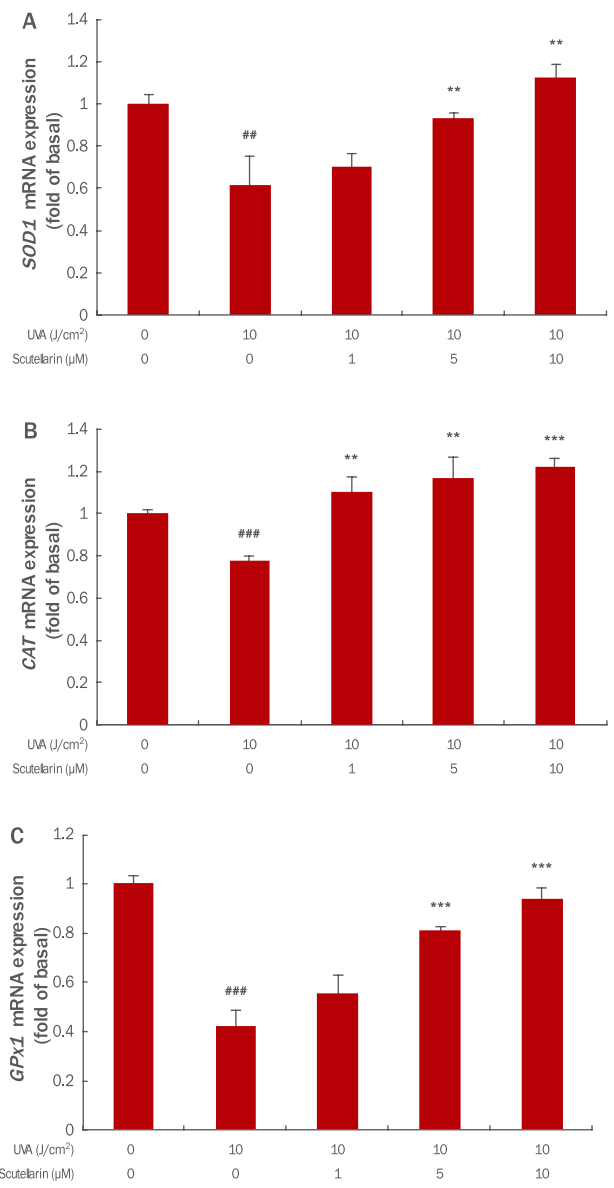
Effects of scutellarin on mRNA expression in UVA-induced HaCaT cells.
HaCaT (2×105) cells were seeded on 60 mm culture dish and incubated for 24 h. Prior to UVA, the cells were pre-treated with 1, 5 and 10 μM of scutellarin. Then, the cells were washed by PBS and irradiated by 10 J/cm2 UVA. After further incubation for 24 h, the expression level of SOD1 (A), CAT (B), and GPx1 (C) mRNA was measured by the qRT-PCR. The graph is representative of three independent experiments (M±S.D.). The Student's t-test was conducted to determine statistical significance (**p<0.01, ***p<0.001 compared with irradiated cells without scutellarin; ##p<0.01, ###p<0.001 compared with negative controls that were not treated scutellarin and UVA irradiation). SOD1, superoxide dismutase 1; GPx1, glutathione peroxidase; CAT, catalase; UVA, ultraviolet A; qRTPCR, quantitative real-time polymerase chain reaction; M±S.D., mean±standard deviation.
CAT는 거의 모든 호기성 세포의 peroxisome에 존재하며 안정된 효소로서 H2O2를 산소와 물로 분해함으로써 과산화수소 증가에 따른 단백질, 핵산 및 생체막 등의 조직손상에 방어한다(Chance et al., 1979; Frank & Massaro, 1980; Keilin & Hartree, 1955). UVA에 의해 자극된 인간각질형성세포에서 scutellarin의 CAT mRNA 발현 변화 조절을 확인한 결과, 10 J/cm2 강도의 UVA조사에 의해 CAT mRNA이 0.78배 하향하였으나 scutellarin을 1, 5, 10 μM 전처리에 의해 각각 1.11, 1.17, 1.22배로 상향 조절되었다(Figure 3B).
Glutathion peroxidase는 대부분 세포질에 존재하며 glutathion thiol (GSH)을 glutathione disulfide (GSSG)로 산화시킴과 동시에 H2O2를 H2O로 환원시킨다. UVA에 의해 자극된 인간각질형성세포에서 scutellarin의 GPx1 mRNA 발현 변화를 확인한 결과, 인간각질형성세포에 UVA를 10 J/cm2 강도로 조사하였을 때 UVA를 조사하지 않은 무처리대조군에 비해 0.42배 하향하였으나 scutellarin을 1, 5, 10 μM 전처리한 군에서의 GPx1 mRNA 발현은 각각 0.55, 0.87, 0.94배로 상향 조절되었다(Figure 3C).
Conclusion
본 연구에서는 scutellarin의 항산화 효능을 다양한 실험을 통해 확인하였다. Scutellarin은 HaCaT cell에서 그 자체로 세포독성이 나타나지 않았으며 UVA에 의한 세포손상을 농도의존적으로 회복시키는 효과를 보여주었다. 더 나아가 UVA에 의해 유도된 세포내 ROS를 농도 의존적으로 제거하는 효과를 확인하였다. 마지막으로 UVA에 의해 감소한 항산화 효소인 SOD1 , CAT 그리고 GPx1 의 유전자 발현을 농도 의존적으로 상향시켰다. 이러한 결과들을 종합해볼 때 UVA 조사로 산화적 스트레스가 유발된 인간각질형성세포에 대해 scutellarin이 세포를 보호하고, 산화반응을 완화시키는 효과가 있는 것으로 사료된다. 그동안 scutellarin은 항암, 항종양, 신경세포 보호 그리고 항림프종과 같은 다양한 생물학적 활성이 보고되었으나, 화장품 소재로서의 사용가능성은 보고가 미미하였다. 이에 scutellarin의 무독성, 세포보호 및 항산화 효과를 본 연구를 통해 확인함으로써 향후 항산화 기능을 기반으로 한 anti-aging 화장품 소재로서 활용가능 할 것으로 사료된다.
Acknowledgements
본 논문은 보건복지부 보건의료연구개발사업의 지원(과제번호: HN13C0080)에 의한 것이며, 이에 감사드립니다.
