파슬리 추출물의 기능성 화장품 소재로서의 생리활성
Physiological Activities of Parsley Extracts as an Ingredient of Functional Cosmetics
绉叶石蛇床提取物作为功能性化妆品原料的生理活性研究
Article information
Abstract
목적
파슬리(Petroselinum crispum) 70% 에탄올 추출물의 활성 효능을 확인하여 기능성 화장품 소재로서의 응용 가능성을 검증하고자 하였다.
방법
파슬리를 70% 에탄올로 추출하여, 항염증 및 항노화, 미백 효과를 확인하기 위하여 총 폴리페놀 함량, 총 플라보노이드 함량, 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical 소거능, nitric oxide (NO) 생성, cyclooxygenase 2 (COX2), microphthalmia-associated transcription factor (MITF), tyrosinase, phospho-extracellular signal–regulated kinase (p-ERK), phospho-c-Jun N-terminal kinase (p-JNK) 발현량 억제 효과를 측정하였다.
결과
파슬리 추출물의 플라보노이드, 폴리페놀 함량과 DPPH radical 소거능을 확인하였으며, RAW 264.7, B16F10, human dermal fibroblast (HDF) 세포에서 파슬리 추출물에 대한 세포 독성 실험을 진행한 결과, 세포독성이 나타나지 않는 범위에서 실험을 진행하였다. NO 생성 억제 및 COX2 억제효과를 확인하였고, MITF 발현량이 억제된 반면 tyrosinase 억제 효과는 나타나지 않는 것으로 확인되었다. 또한 JNK의 인산화가 억제되는 것을 확인하였다.
결론
파슬리 추출물은 항산화 효과가 우수하고, 항염증 효과와 미백 및 주름 개선 효과를 가지는 다양한 기능성 화장품 소재로서의 가치가 있는 것으로 사료된다.
Trans Abstract
Purpose
This study attempted to examine the active effects of 70% ethanol extracts of parsley (Petroselinum crispum) and verify its usefulness as an ingredient of functional cosmetics.
Methods
Parsley was extracted using 70% ethanol and, to verify its anti-inflammatory, anti-aging, and skin-brightening effects, its total polyphenol content, and total flavonoid content, and 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging activity, as well as its ability to synthesize nitric oxide (NO), suppress cyclooxygenase 2 (COX2) and inhibit microphthalmia-associated transcription factor (MITF) and tyrosinase were assessed and phospho-extracellular signal–regulated kinase (p-ERK), phospho-c-Jun N-terminal kinase (p-JNK).
Results
Total polyphenol and flavonoid contents and DPPH radical scavenging activity of parsley extracts were verified. From results of cytotoxicity test on parsley extracts in RAW 264.7, B16F10, and human dermal fibroblast cells, following experiments were conducted at concentrations which cytotoxicity was not observed. The result showed good MITF inhibition, but poor tyrosinase inhibition. In addition, NO and COX2 were inhibited and phosphorylation of JNK was suppressed.
Conclusion
Parsley extracts have remarkable anti-oxidant effects and are valuable as a cosmetics ingredient with anti-inflammatory, skin-brightening, and anti-aging effects.
Trans Abstract
目的
探讨绉叶石蛇床70%乙醇提取物的活性功效,评价作为功能性化妆品原料的应用可行性。
方法
利用70%乙醇提 取绉叶石蛇床提取物,为确认绉叶石蛇床提取物的抗炎、抗衰老以及美白作用,测量多酚含量和总黄酮含量,并测定 2,2-diphenyl-1-picrylhydrazyl(DPPH)自由基消除能力和一氧化氮(nitric oxide,NO)抑制作用,cyclooxygenase 2(COX2)、microphthalmia-associated transcription factor(MITF)、tyrosinase、phospho-extracellular signal– regulated kinase(p-ERK)以及phospho-c-Jun N-terminal kinase(p-JNK)表达的抑制作用。
结果
测量绉叶石蛇床的 多酚含量和总黄酮含量并确定DPPH自由基消除能力。在RAW 264.7, B16F10, human dermal fibroblast(HDF)细胞中, 对绉叶石蛇床进行细胞毒性实验,并在不出现毒性范围内进行实验。确认NO生成抑制和COX2抑制作用,同时抑制MITF 表达,但不出现tyrosinase抑制效果。此外,绉叶石蛇床提取物具有抑制JNK的磷酸化的作用。
结论
绉叶石蛇床提取物 具有优秀的抗氧化、抗炎、美白以及皱纹改善作用,因此作为多种功效的功能性化妆品原料充分具有可行性。
Introduction
파슬리(parsley)의 학명은 Petroselinum crispum 으로, 쌍떡잎식물 산형화목 미나리과 두해살이풀로 높이는 20-50 cm이며 짙은 녹색을 띈다. 원산지는 유럽남동부와 아프리카 북부이며 따뜻한 곳에서는 3월 중순에 파종하여 6월에 정식하고 11월부터 이듬해 3월까지 수확한다. 생육적온이 15-20℃인 호냉성 작물로서 5℃ 이상으로만 온도관리를 하면 연중 수확이 가능하다(Yang et al., 2007). 파슬리를 식용으로 했을 때 정혈, 뇌신경촉진작용, 피부미용, 점막기능 강화의 효과가 있을 뿐만 아니라 신장결석, 방광결석 등 신장장애 질환에 대한 효능 및 약효에 대하여 보고되고 있다(Jeon et al., 2008). 또한 파슬리는 플라보노이드(flavonoid) 계열의 항산화 성분들을 많이 함유하고 있어 활성산소를 제거하며, 파슬리의 쿠마린(coumarin) 성분은 항균효과를 가지고 있다(Fejes et al., 2000). 파슬리의 정유 성분은 내장 안에서 부패를 일으키는 박테리아 번식을 방지할 뿐만 아니라 식욕을 촉진시키는 역할을 한다(Cha et al., 2006). 파슬리에는 독특한 향기를 내는 휘발성 물질인 아피올(apiol)이 함유되어 있어 식욕증진 및 발한, 보온, 구치제거, 피로회복작용을 한다고 알려져 있다(Ojala et al., 2000).
현재까지 파슬리의 생리활성 연구로는 파슬리의 잎과 씨의 휘발성 성분(Kim et al., 1990), 파슬리에 대한 연구는 재배시기에 따른 파슬리의 modified atmosphere (MA)저장 시 저장성 비교(Yang et al., 2007)의 파슬리 재배에 관한 연구를 비롯하여 채소류 추출물의 항산화 효과 및 항돌연변이능(Parry et al., 2006), 항염증 천연추출물이 멜라닌생성에 미치는 영향(Dorman et al., 2011), 파슬리추출물의 피부 노화 방지와 자극완화에 대한 효과(Kim et al., 2004), 채소주스 보충을 통한 여대생의 지질 패턴 및 항산화능 개선 효과(Gupta & Seshadri, 1952), apigenin의 항염증 효능과 그 작용기전에 관한 연구(Uada et al., 2004), 파슬리 가루를 첨가한 설기떡의 품질특성(Lim & Park, 2011), 항산화 천연화합물이 neuraminidase 및 superoxide dismutase와 catalase의 활성에 미치는 영향(Nielsen et al., 1999)과 같이 파슬리에 관련된 다양한 연구들이 보고되었다. 하지만 현재까지 파슬리 추출물을 이용한 화장품 소재로서의 항산화, 항염증, 멜라닌에 의한 기능성 화장품 생리활성 효능 연구에 대해서는 미비한 실정이다.
따라서, 본 연구에서는 파슬리 추출물의 항산화 활성을 살펴보고, B16F10 세포에서의 멜라닌 생성 억제효과와 HDF 세포에서의 MMP1 발현 억제능을 통한 항노화, RAW 264.7 세포에서의 항염증 효과를 평가함으로써 파슬리 추출물의 기능성 화장품 소재로서의 생리활성 효능을 알아보고 기초 자료들을 제공하고자 한다.
Methods
1. 실험재료
1) 시료준비
파슬리는 신영에프에스(Korea)에서 독일산을 구입하여 사용하였으며, 물로 4–5회 씻어 불순물을 제거한 다음 실온에서 건조시켰다. 건조한 파슬리 500 g을 분쇄하여 70% ethanol (Duksan Pure Chemicals, Korea)을 20배로 가한 후에 37℃, 100 rpm 인큐베이터(Jeio Tech, Korea) 안에서 72 h 추출하였다. 72 h 후 추출액을 분리하기 위하여 여과지(WhatmanⓇFilter Papers No.2; GE Healthcare Life Sciences, UK)를 이용하여 여과한 후 감압 농축(Eyela, Tokyo Rikakikai, Japan)을 통해 ethanol을 제거한 뒤 동결 건조하여 최종 추출물을 얻어 본 실험에 사용하였다. 건조 중량에 대한 추출 고형분의 수율은 10.58%로 확인되었다.
2) 시약
본 실험에 사용된 시약은 neutral red (NR) solution, Griess reagent, Folin-Ciocalteau’s phenol reagent, aluminum nitrate [Al(NO3)3], potassium acetate (CH3COOK), caffeic acid, quercetin, formaldehyde, glacial acetic acid, lipopolysaccharide (LPS), DPPH, ascorbic acid, phosphate buffered saline (PBS), p -nitrophenyl phosphate, p-ERK, p-JNK, anti-mouse IgG-Ab를 Sigma-Aldrich (USA)로부터 구입하여 사용하였으며, sodium carbonate (Na2CO3)는 Samchun Pure Chemical (Korea)에서, arbutin은 Alfa Aesar (USA)에서 구입하여 사용하였다.
3) 세포주 및 세포배양
본 실험에 사용한 세포주인 HDF, B16F10 melanoma, RAW 264.7 macrophage 세포는 한국세포주은행(Korean Cell Line Bank, Korea)에서 구입하여 사용하였으며, high glucose Dulbecco’s modified Eagle’s medium (DMEM; Sigma-Aldrich) 배지에 10% fetal bovine serum (FBS; Sigma-Aldrich)과 1% penicillin/streptomycin (100 IU/mL; GE Healthcare Life Sciences)를 첨가하여 사용하였고, 37℃, 95% 습도, 5% CO2 조건에서 배양하였다.
2. 항산화 실험 측정
1) DPPH radical 소거능 측정
DPPH radical 소거활성은 Blois (1958) 방법을 이용하여 측정하였다. 파슬리 추출물을 농도별로 희석한 후 96 well plate에 10 mM DPPH 용액 180 μL와 시료액 20 μL를 혼합하여 차광상태에서 37℃, 30 min 간 반응시킨 후 Synergy HT (BioTek Instruments, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. 동일한 조건으로 3회 반복적으로 실험하여 평균값을 측정하였으며, 양성 대조군으로는 ascorbic acid를 사용하였다.
2) 총 폴리페놀 함량 측정
총 폴리페놀 함량 측정은 Association of Official Agricultural Chemists (AOAC)의 Folin & Denis (1912)의 방법을 수정하여 Folin-Ciocalteau’s phenol reagent가 시료의 페놀성 화합물에 의해 환원되면, 몰리브덴 청색(molybdenum blue)으로 발색되는 원리를 이용하여 정량하였다(Gutfinger, 1981). 파슬리 추출물을 각 농도별로 희석한 후 시료 400 μL와 Folin-Ciocalteau’s phenol reagent 400 μL를 혼합하여 3 min 간 실온에서 반응시켰다. 반응시킨 후 10% Na2CO3를 400 μL를 혼합하여 암실에서 60 min 반응시킨 후 상등액 200 μL씩 96 well plate에 분주하여 Synergy HT를 이용하여 760 nm에서 흡광도를 측정하였다. 동일한 조건으로 3회 반복적으로 실험하여 평균값을 측정하였으며, 표준물질 caffeic acid를 사용하였다.
3) 총 플라보노이드 함량 측정
총 플라보노이드 함량 측정은 Moreno et al. (2000) 방법을 수정 및 변형하여 측정하였다. 파슬리 추출물을 각각 0.2, 0.5, 1, 2, 5 mg/mL로 희석한 후 시료 100 μL와 10% Al(NO3)3 20 μL, 1 M CH3COOK 20 μL, ethanol 860 μL를 차례로 혼합하여 실온에서 40 min 간 방치 후 원심분리기(FinePCR, Korea)로 부유물을 가라앉힌 후 96 well plate에 200 μL씩 분주하여 Synergy HT를 이용하여 415 nm에서 흡광도를 측정하였다. 동일한 조건으로 3회 반복적으로 실험하여 평균값을 측정하였으며, 표준물질 quercetin을 사용하였다.
3. 세포 생존율
파슬리 추출물의 세포 생존율에 미치는 영향을 알아보기 위해 NR assay를 이용하여 분석을 실시하였다(Borenfreund & Puerner, 1985). HDF, RAW 264.7, B16F10 세포를 96 well plate에 well 당 3×104 cells/well의 세포를 24 h 동안 CO2 인큐베이터(Jeio Tech)에서 부착시킨 후, 시료를 농도별로 처리한 다음 37℃에서 CO2 인큐베이터에서 48 h 동안 배양하였다. 48 h 후 NR solution 용액이 1% 포함된 무 혈청배지로 교환 후, 3 h 동안 배양한 다음 세포 고정액으로 10% formaldehyde 용액이 첨가된 PBS를 각 well에 100 μL로 20 min 동안 처리 및 고정하였다. NR desorb solution (1% glacial acetic acid, 49% ethanol, 50% distilled water)을 각 well에 100 μL을 가하여 세포 내의 NR을 추출하고 540 nm에서 Synergy HT를 이용하여 흡광도를 측정하였다. 실험은 3회 반복 실시 후 t -test를 통해 통계적으로 각각의 유의성을 확인하였다.
4. NO 생성 저해능 측정
파슬리 추출물의 NO 생성 저해능을 알아보기 위해 Green et al. (1982)의 방법에 따라 세포 배양액 내 NO 양을 nitrite (NO2-)와 nitrate (NO3-) 형태로 측정하였다. RAW 264.7 세포를 96 well plate에 well당 5×104 cells/well의 농도로 분주하고 24 h 동안 배양 후, 배지를 제거한 다음 LPS 1 μg/mL 포함된 배지에 시료를 농도별로 처리 후 48 h 배양하였다. 새로운 plate에 배양된 세포 상층액 100 μL와 Griess reagent 100 μL을 가하여 차광된 상태에서 10 min 간 반응시키고 Synergy HT를 이용하여 540 nm에서 흡광도를 측정하였다.
5. Western blotting
파슬리 추출물이 항염증과 관련된 COX2 발현 억제능 측정, 멜라닌 생성에 필요한 단백질인 MITF와 tyrosinase의 발현에 미치는 영향 및 MMP1 생성에 중요하게 작용하는 kinase인 ERK와 JNK의 세포 내 활성화에 미치는 영향을 확인하기 위해 western blotting을 수행하였다. 파슬리 추출물을 25, 50 μg/mL 농도로 처리 후 RAW 264.7와 B16F10, HDF 세포를 수확하여 radioimmunoprecipitation assay (RIPA) buffer [Tris-Cl, 50 mM sodium chloride (NaCl; Sigma-Aldrich), 1% NP-40, 0.5% sodium deoxycholate, 0.1% sodium dodecyl sulfate (SDS), protease inhibitor cocktail; Roche, Switzerland]를 첨가하고 세포를 용해하였다. 용해된 RAW 264.7와 B16F10, HDF 세포는 원심 분리하였고, 상등액은 단백질을 변성시킨 후 sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)를 이용하여 분리하였다. 분리된 단백질은 100 V의 조건에서 nitrocellulose membrane (WhatmanⓇ)으로 transfer한 다음 membrane에 옮겨진 단백질은 5% skim milk (Sigma-Aldrich) 용액에서 blocking 처리한 후 1× tris-buffered saline with tween 20 [TBST; 150 mM NaCl, 10 mM Tris-Cl (0.2% Tween 20, pH 7.5)]에 희석한 β-actin primary antibody (1:10,000; Sigma-Aldrich), anti-COX2 antibody produced in rabbit (1:200; Sigma-Aldrich), anti-MITF antibody produced in rabbit (1:3,000; Sigma-Aldrich), anti-tyrosinase antibody produced in mouse (1:3,000; Sigma-Aldrich)를 처리하고 24 h 동안 교반하였다. Secondary antibody는 anti-mouse IgG antibody, anti-rabbit IgG antibody (Santa Cruz Biotechnology, USA)을 사용하여 30 min 교반하였으며, 교반이 완료된 membrane은 TBST로 세척하였다. 세척이 완료 된 후 실험용 필름(Konica Minolta, Japan)에서 SuperSignal™ West Pico Chemiluminescent Substrate (Thermo Fisher Scientific, USA)을 처리하여 필름에 감광을 유도한 다음 암실에서 자동현상기(QX-130II; Konica)를 이용하여 현상하였다. 현상된 필름상의 단백질양은 Image J (National Institutes of Health, USA)를 이용하여 band 농도차이를 비교하였다.
6. 통계처리
본 연구의 모든 실험은 동일한 조건하에 독립적으로 3회 이상 실시하여 실험 결과를 얻었으며, 모든 실험 결과는 평균±표준편차(mean±standard deviation, M±SD)로 표기하였다. 통계 처리는 Statistical Package for the Social Sciences (SPSS) Window Version 17.0 (IBM, USA)을 이용하여 분석하였으며, 유의성 검증은 Student’s t -test를 실시하였고, p 값이 0.05 미만일 때 통계적으로 유의한 차이가 있는 것으로 판정하였다.
Results and Discussion
1. 항산화 효과 측정 결과
1) DPPH radical 소거능
Free radical은 인체의 단백질, 지질 등과 반응하는 노화의 원인 물질로 알려져 있으며, DPPH 방법에 의한 free radical 소거능은 안정한 활성산소종(reactive oxygen species, ROS)으로 항산화 물질의 항산화력을 검증하는데 널리 사용되고 있다. 파슬리 추출물의 항산화 효과를 알아보기 위하여 DPPH radical 소거 활성을 측정한 결과를 Figure 1에 나타냈으며, 양성 대조군으로 사용한 ascorbic acid는 1%의 농도에서 60%의 라디칼 소거 활성이 확인되었으며, 파슬리 추출물 0.5% 농도에서는 32.0%의 라디칼 소거 활성을 확인하였다. DPPH 라디칼 소거능을 측정한 결과 추출물의 농도가 증가함에 따라 DPPH 소거 활성에는 큰 영향을 미치지 않는 것으로 확인하였다.

DPPH radical scavenging activity of parsley extracts.
Free radical scavenging activity was carried out so as to measure anti-oxidant activity of parsley extracts. Moreover, ascorbic acid was used as comparative material (positive control). The concentration-dependent free radical scavenging activity of the parsley extract was confirmed. Results are expressed as M±SD of three independent experiments. DPPH, 2,2-diphenyl-1-picrylhydrazyl; M±SD, mean±standard deviation.
2) 총 폴리페놀 함량 변화
폴리페놀 화합물은 대사 과정 중에 발생하는 유해한 과산화물질을 제거하여 항산화, 항알러지, 항균, 항암, 충치예방, 당뇨성질환 예방 및 심장질환 등에 효과가 있으며 총 폴리페놀 함량이 증가할수록 항산화 생리활성이 증가하는 경향으로 보고되고 있다(Halliwell et al., 1995; Imai et al., 1994). 총 폴리페놀 함량을 측정하기 위하여 파슬리 추출물을 0.2, 0.5, 1, 2, 5 mg/mL의 농도로 실험에 사용하였다. Caffeic acid를 표준 용액으로 하여 파슬리 추출물의 총 폴리페놀 함량을 환산하였다. 실험 결과는 Figure 2에 나타냈으며, 파슬리 추출물의 총 폴리페놀 함량은 12.25 mg caffeic acid equivalent (CAE)/100 g이었으며 농도 의존적으로 증가하는 양상을 나타내었다.

Total polyphenol content of parsley extracts.
Total polyphenol content in parsley extracts was measured. In the result, the content of total polyphenol in the parsley extracts was 12.25 mg CAE/100 g and increased in a concentration-dependent manner. Results are expressed as M±SD of three independent experiments. CAE, caffeic acid equivalent; M±SD, mean±standard deviation.
3) 총 플라보노이드 함량 변화
플라보노이드는 폴리페놀에 속하는 성분으로, C6-C3-C6을 기본골격으로 하여 노란색 또는 담황색을 나타내는 페놀계 화합물을 총칭한다(Hertog et al., 1993). 또한, 플라보노이드는 식물계에 분포하는 이차 대사물로 구조적으로 phenolic hydroxyl기가 존재하여 free radical 소거 활성이 우수하고, 자외선에 대한 필터작용, 활성산소 제거를 통한 항산화 작용을 하는 것으로 알려져 있다(Havsteen, 1983). 파슬리 추출물의 총 플라보노이드 함량을 측정하기 위하여 파슬리 추출물을 0.2, 0.5, 1, 2, 5 mg/mL의 농도로 실험에 사용하였고, quercetin을 표준 용액으로 하여 파슬리 추출물의 총 플라보노이드 함량을 환산하였다. 본 실험 결과를 Figure 3에 나타냈으며, 파슬리 추출물의 총 플라보노이드의 함량은 80.99 mg quercetin (QE)/100 g이었으며 농도 의존적으로 증가하는 양상을 나타내었다.
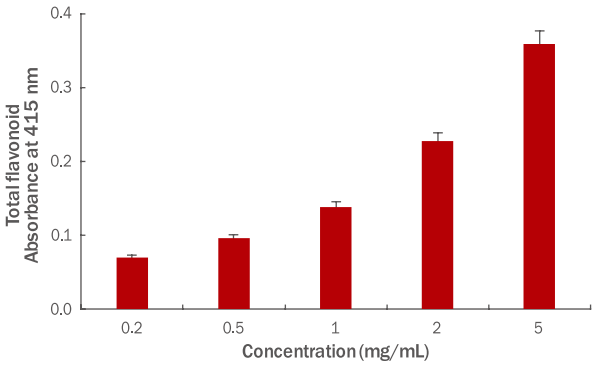
Total flavonoid content of parsley extracts.
Total flavonoid content in parsley extracts was measured. In the result, the content of total flavonoid in the parsley extracts was 80.99 mg QE/100 g and increased in a concentration-dependent manner. Results are expressed as M±SD of three independent experiments. QE, quercetin equivalent; M±SD, mean±standard deviation.
2. 세포 생존율 측정 결과
1) RAW 264.7 세포에 대한 세포 생존율
마우스 대식세포인 RAW 264.7 세포에서 세포 생존율에 미치는 영향을 알아보기 위하여 70% 에탄올을 이용한 파슬리 추출물을 5, 10, 20, 50, 100 μg/mL의 농도로 처리하고, 48 h 배양하여 NR assay를 실시하였다. 본 실험 결과, 파슬리 추출물 5, 10, 20, 50 μg/mL 농도까지 90% 이상의 세포 생존율을 나타났으며, 100 μg/mL에서 세포 생존율이 14.3% 감소함을 확인하였다. 본 실험을 통해 파슬리 추출물이 50 μg/mL 농도까지는 RAW 264.7 세포에 대한 독성이 나타나지 않는 것을 확인하여 추후 실험은 50 μg/mL 농도에서 진행하였다(Figure 4A).
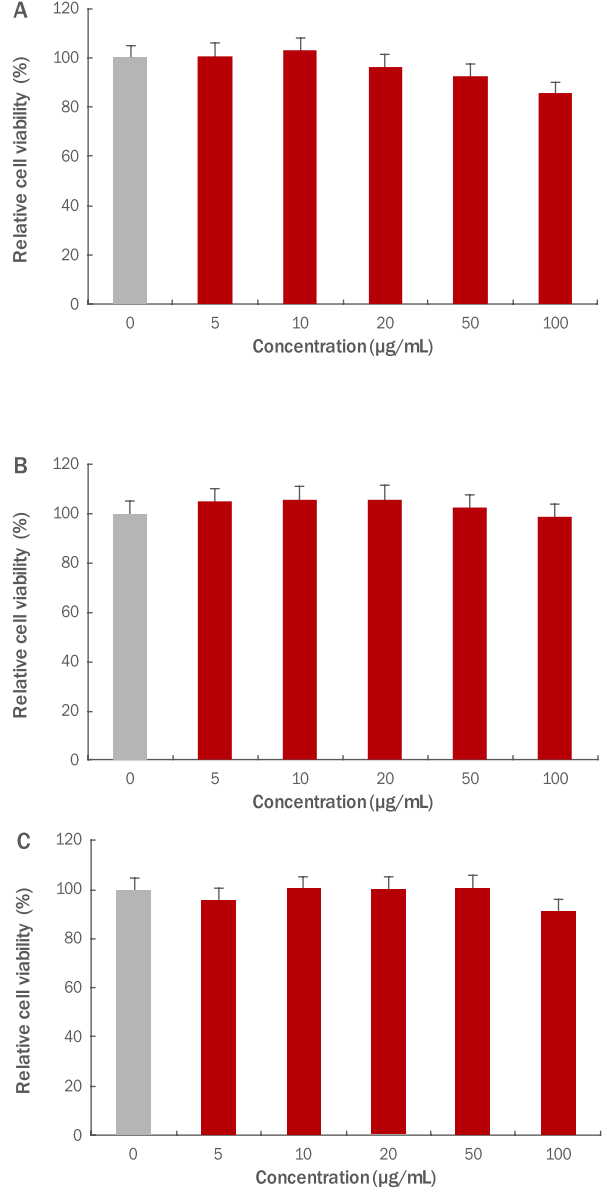
The cytotoxicity of parsley extract was measured.
(A) The cytotoxicity of parsley extracts was measured in RAW 264.7 macrophage cells. In the result, cell viability was 90% or higher up to 5, 10, 20, 50 μg/mL and decreased by 14.3% at 100 μg/mL. (B) The cytotoxicity of parsley extracts was measured in B16F10 melanoma cells. It was verified that cytotoxicity was not shown in all indicated concentrations. (C) The cytotoxicity of parsley extracts was measured in HDF cells. In the result, cell viability was 95% or higher up to 5, 10, 20, 50 μg/mL concentrations, and decreased by 8.3% at 100 μg/mL. The extracts were compared with the untreated group. Results are expressed as M±SD of three independent experiments. M±SD, mean±standard deviation.
2) B16F10 세포에 대한 세포 생존율
B16F10 세포에서 세포 생존율에 미치는 영향을 알아보기 위하여 70% 에탄올을 이용한 파슬리 추출물을 5, 10, 20, 50, 100 μg/mL의 농도로 처리하고, 48 h 배양하여 NR assay를 실시하였다. 본 실험 결과, 파슬리 추출물 5, 10, 20, 50, 100 μg/mL 농도까지 95% 이상의 세포 생존율을 나타났으며, 모든 농도에서 세포 독성이 나타나지 않는 것을 확인하였다(Figure 4B).
3) HDF 세포에 대한 세포 생존율
인간 섬유 세포인 HDF 세포에서의 세포 생존율에 미치는 영향을 알아보기 위하여 70% 에탄올을 이용한 파슬리 추출물을 5, 10, 20, 50, 100 μg/mL의 농도로 처리하고, 48 h 배양하여 NR assay를 실시하였다. 본 실험 결과, 파슬리 추출물 5, 10, 20, 50 μg/mL 농도까지 95% 이상의 세포 생존율을 나타났으며, 100 μg/mL에서 세포 생존율이 8.3% 감소함을 확인하였다. 본 실험을 통해 파슬리 추출물은 HDF 세포에 대한 독성이 나타나지 않는 것을 확인하였고, 추후 실험은 파슬리 추출물의 세포 생존율이 95% 이상인 50 μg/mL 농도에서 진행하였다(Figure 4C).
3. 항염증 효과 측정 결과
1) NO 생성 저해능 측정
활성 질소종(reactive nitrogen species, RNS)의 하나이며, 최근 염증 반응의 중요한 작용인자로 알려진 NO의 생성 저해에 미치는 파슬리 추출물의 효과를 알아보기 위하여, 대식세포인 RAW 264.7 세포에 NO 생성을 유도하는 LPS가 처리된 배지와 파슬리 추출물을 5, 10, 20, 50 μg/mL 농도별로 처리하여 NO 생성 억제능을 측정하였다(Figure 5). 본 실험 결과, LPS 단독 처리군에 비해 파슬리 추출물은 20 μg/mL에서 12% 감소하였고(*p<0.05), 50 μg/mL에서 46.8%의 NO 생성 억제율을 나타내었다(*p<0.05). 이와 같은 결과를 통해 파슬리 추출물은 LPS에 의해 유도된 NO 생성을 억제함으로써 항염증 효과가 있음을 확인하였다. 따라서 RAW 264.7 세포에서의 항염증의 생성억제가 확인됨에 따라 염증인자를 억제하는 세포활성에 기여할 수 있을 것으로 사료된다.
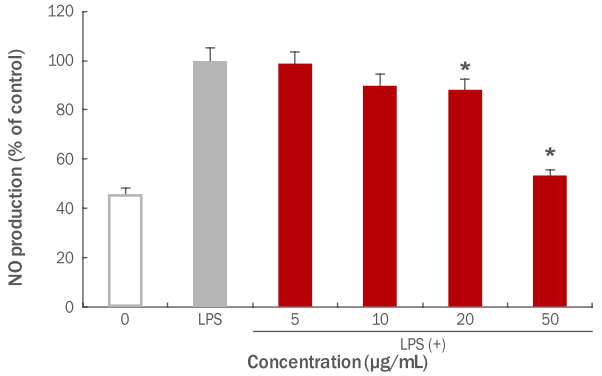
Inhibitory effects of parsley extracts on antiinflammation in RAW 264.7 macrophage cells.
RAW 264.7 macrophage cells were treated with LPS (1 μg/mL). The inhibitory effects of parsley extracts on anti-inflammation were measured. The results were compared between only treated with LPS group and experimental group which both treated with LPS and parsley extracts, and an inhibitory effects on NO production were checked at 10, 20, 50 μg/mL concentrations of parsley extracts. The results are presented as the M±SD of three independent experiments and statistical significance was shown ( * p<0.05). NO, nitric oxide; LPS, Lipopolysaccharide; M±SD, mean±standard deviation.
2) COX2 발현 억제능 측정
본 실험에서는 염증 매개 물질인 LPS를 대식세포인 RAW 264.7 세포에 처리한 후 70% 에탄올로 추출한 파슬리 추출물을 25, 50 μg/mL로 처리하고 western blotting을 이용하여 RAW 264.7 세포 내 COX2 단백질 발현 억제 효과를 확인하였다(Figure 6). 정확한 발현량을 확인하고자 COX2 High와 Low로 발현 노출 시간의 차이를 두고 동일한 방법으로 측정하였다(Figure 8A). 두 처리군 모두 LPS에 의해 COX2 발현량이 유의하게 증가되었고, High는 50 μg/mL 농도에서 유의한 저해 효과가 확인 되었으며, Low는 파슬리 추출물 25, 50 μg/mL의 농도에서 유의하게 저해되었다(Figure 8B; **p<0.01, ***p<0.001). NO에 의해 생성된 COX2는 염증과정에서 인지질을 대사시켜 생성된 arachidonic acid에서 prostaglandin E2 (PGE2)를 생성시키는 효소이고, COX2에 의해 생성된 PGE2는 혈관확장, 통증 및 발열 작용을 하는 것으로 알려져 있으며, 과도한 COX2의 발현은 암 조직에 있어서 혈관신생(angiogenesis) 및 전이능(metastatic potential)을 높이고 세포사멸을 억제하는 것으로 알려져 있으며 COX2의 염증반응은 세포의 암화(carcinogenesis)에도 관련이 되어 있음이 보고되고 있다(Baldwin, 1996). 이러한 결과를 통하여 파슬리 추출물은 RAW 264.7 대식세포에서 COX2를 효과적으로 억제하는 기능으로 보아 피부 염증 반응을 효과적으로 억제하는데 관여할 수 있을 것으로 사료된다.

Inhibitory effects of parsley extracts on COX2 activation in RAW 264.7 macrophage cells.
In order to check the anti-inflammatory effects of parsley extracts, RAW 264.7 macrophage cells were treated with LPS and inhibitory effects on COX2 activity were measured by using western blotting. To determine the exact expression level, COX2 high and low were measured by the same method with different exposure time. The results, were compared between only treated with LPS group and experimental group which both treated with LPS and parsley extracts and it was determined that COX2 activity was significantly inhibited by parsley extracts. (A) A variation of COX2 protein expression due to parsley extracts was shown. (B) COX2 protein expression due to parsley extracts is graphed. The results are presented as the M±SD of three independent experiments (**p<0.01; ***p<0.001). LPS, lipopolysaccharide; Control, untreated group; COX2, cyclooxygenase 2; EX, exposure; M±SD, mean±standard deviation.
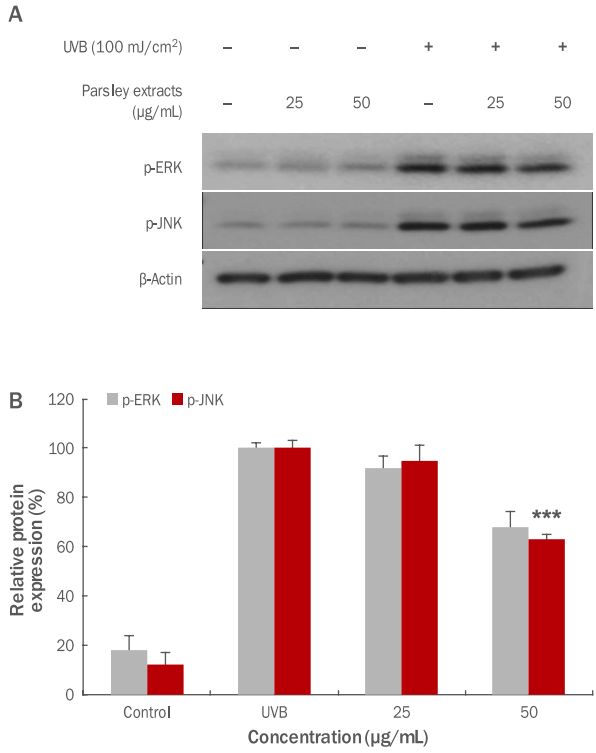
Inhibitory effects of parsley extracts on the activation of p-ERK and p-JNK by UVB in HDF cells.
In order to check the anti-aging effects of parsley extracts, HDF cells were treated with UVB, and inhibitory effects on p-ERK and p-JNK activity were measured by using western blotting. From results p-JNK significant inhibitory effects were checked. (A) A variation of p-ERK and p-JNK protein expression due to parsley extracts was shown. (B) p-ERK and p-JNK protein expression due parsley extracts was graphed. The results are presented as the M±SD of three independent experiments. Statistical significance was shown (***p<0.001). UVB, ultraviolet B; p-ERK, phospho-extracellular signal–regulated kinase; p-JNK, phosphoc-Jun N-terminal kinase; HDF, human dermal fibroblast; M±SD, mean±standard deviation.
4. 항멜라닌 효과 측정 결과
파슬리 추출물의 항멜라닌 효과를 측정하기 위하여 MITF, tyrosinase의 발현량 변화를 확인하였다. 멜라닌 생합성 자극호르몬인 α-melanocyte-stimulating hormone (α-MSH) 10 nM을 멜라닌 형성세포인 B16F10 세포에 처리하였다. α-MSH를 처리 후 멜라닌 발현을 활성화시키고, 파슬리 추출물을 25, 50 μg/mL의 농도별로 처리한 후 western blotting을 이용하여 MITF, tyrosinase의 활성억제 효과를 확인하였다(Figure 7). 본 실험 결과, 파슬리 추출물에 의해 MITF의 활성이 25 μg/mL 농도에서 15.0%, 50 μg/mL 농도에서 38.2%의 농도별로 우수한 억제 효과를 보였으며, 그에 반해 tyrosinase억제 효과는 나타나지 않는 것으로 확인되었다. 이와 같은 결과를 통하여 tyrosinase의 억제 효과가 나타나지 않아 미백 효과는 미약하나, MITF에 의한 미백 효과는 우수한 것으로 확인되었다.
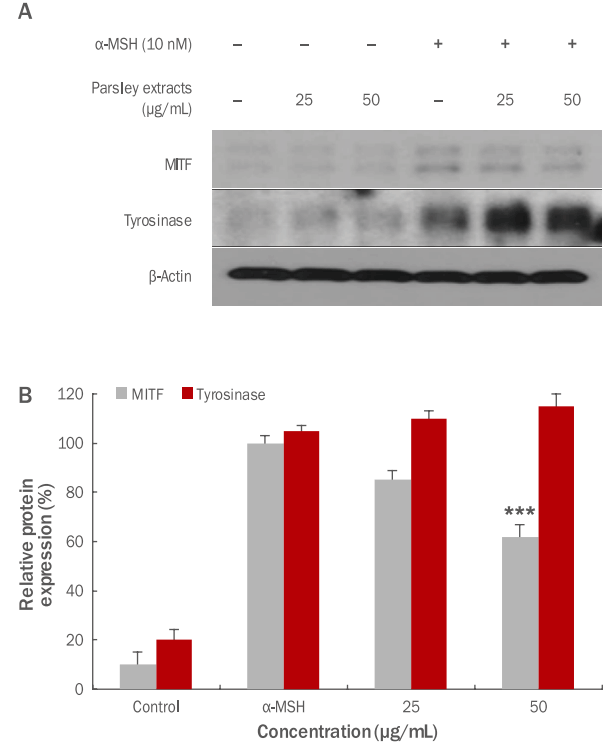
Inhibitory effects of parsley extracts on MITF and tyrosinase activation in B16F10 melanoma cells.
In order to check the whitening effects of parsley extracts, B16F10 melanoma cells were treated with α-MSH. Then, inhibitory effects on MITF, tyrosinase activity were measured by using western blotting. The results were compared between α-MSH group and experimental group which both treated with α-MSH and parsley extracts and in MITF expression, significant inhibitory effects were checked. (A) A variation of MITF, tyrosinase protein expression due to parsley extracts was shown. (B) MITF, tyrosinase protein expression due to parsley extracts was graphed. The results are presented as the M±SD of three independent experiments ( ***p<0.001). α-MSH, α-melanocyte-stimulating hormone; MITF, microphthalmia-associated transcription factor; M±SD, mean±standard deviation.
5. 항노화 효과 측정 결과
HDF 세포에 ultraviolet B (UVB)가 조사되면 세포 내 DNA 손상뿐만 아니라 광노화 현상이 발생하며, HDF 세포의 광노화는 성장을 저해하며 MMP1의 발현을 촉진하여 진피층에 존재하는 콜라겐의 분해를 촉진시키는 것으로 알려져 있다(Yoon, 2013). 본 연구에서는 UVB에 의한 MMP1 유전자 발현에 관련있다고 알려진 p-ERK와 p-JNK의 인산화 정도를 western blotting을 이용하여 측정하였다. 파슬리 추출물을 25, 50 μg/mL 농도로 각각 처리한 후 UVB lamp (Johnsam, Korea)를 이용하여 100 mJ/cm2의 강도로 조사하였다. 본 실험 결과, Figure 8에서 볼 수 있듯이 UVB 조사 후 p-ERK와 p-JNK의 단백질 발현이 파슬리 추출물 처리에 의해 감소된 것을 확인할 수 있었고(Figure 8A), p-JNK의 50 μg/mL 농도에서 37.0% 유의하게 저해되었다(Figure 8B; ***p <0.001). 이와 같은 결과는 파슬리 추출물이 HDF 세포에서 UVB에 의해 유도된 JNK의 인산화를 억제 함으로써 콜라겐 분해를 촉진하는 MMP1 유전자의 발현을 억제하여 주름 개선에 도움을 주는 것으로 사료된다.
Conclusion
본 연구에서는 파슬리 추출물의 항산화 및 항염증, 항멜라닌, 항노화의 기능성 화장품 소재로서의 생리활성 효능을 알아보고자 하였다. 항산화 활성 효과를 측정하기 위하여 DPPH radical 소거능, 총 폴리페놀 함량, 총 플라보노이드 함량을 확인하였다. DPPH radical 소거능을 확인한 결과 농도 의존적인 DPPH radical 소거 활성이 확인 되었으며, 총 폴리페놀 함량은 12.25 mg CAE/100 g이었으며, 총 플라보노이드 함량 측정 결과 80.99 mg QE/100 g으로 총 폴리페놀와 총 플라보노이드 모두 농도 의존적으로 증가하는 양상을 나타내었다. 세포 생존율 측정을 위해 파슬리 추출물을 농도에 따라 RAW 264.7, B16F10, HDF 세포에 처리한 결과, 세포 독성이 나타나지 않는 농도에서 실험을 수행하였다. 항염증 효과를 측정한 결과, 50 μg/mL에서 46.8%의 NO 생성 억제율이 나타났으며, 50 μg/mL에서도 COX2 단백질 발현 억제효과가 있음을 확인하였다. 멜라닌 효과 측정 MITF, tyrosinase 발현량 측정결과, MITF의 25, 50 μg/mL의 농도별로 발현 억제 효과를 보였으며, 그에 반해 tyrosinase 억제 효과는 나타나지 않는 것으로 확인하였다. HDF 세포에서 UVB에 의해 과발현을 유도하였고, MMP1 유전자 발현에 관련 있다고 알려진 p-ERK와 p-JNK의 발현 정도를 측정한 결과, 유의한 JNK 인산화 활성억제 효과를 확인하였다. 따라서 파슬리 추출물의 항산화, 항염증 및 미백 개선, 주름 개선 효과를 가진 기능성 화장품 소재로서의 가능성이 있을 것으로 사료된다.