인간 진피섬유아세포에서의 하이드록시티로졸의 산화억제 효능
Anti-oxidant Effects of Hydroxytyrosol in Human Dermal Fibroblasts
Hydroxytyrosol对人真皮成纤维细胞的氧化抑制作用
Article information
Abstract
목적
Hydroxytyrosol은 항산화 특성을 지닌 페놀계 식물 화학 물질의 일종으로, 본 연구에서는 UVA와 hydroxytyrosol을 인간 진피섬유아세포에 처리하여 UVA로 유도된 인간 진피섬유아세포에서의 hydroxytyrosol의 세포 내 작용 기전 연구를 통해 산화 억제에 효과가 있는 기능성 소재로서의 가능성을 제시하고자 한다.
방법
Hydroxytyrosol의 효능 평가는 세포생존율 분석, 활성산소 측정, qRT-PCR을 통해 검증하였다. UVA로 감소한 세포 생존율을 확인하기 위해 WST-1 assay의 원리를 이용하여 측정되었다. Hydroxytyrosol의 항산화 효과를 입증하기 위해서 DCF-DA를 이용하여 ROS 정량분석과 GSH 변화값을 측정하였고, GPx1, SOD1, CAT 유전자의 발현변화를 살펴보았다.
결과
UVA로 감소한 세포생존율은 hydroxytyrosol 농도의존적으로 증가하였다. UVA로 증가된 활성산소에 대해 hydroxytyrosol 처리 시 ROS 소거와 GSH 양의 증가, GPx1, SOD1, CAT mRNA 발현량의 증가를 통해 산화 억제 효과를 확인하였다.
결론
본 연구결과를 통하여 hydroxytyrosol이 인간 진피섬유아세포에서의 산화 억제 효과를 확인하였고, 향후 hydroxytyrosol이 적용된 제품을 통한 임상 연구가 진행된다면 항산화제, 화장품의 기능성 소재로써 응용 가능할 것으로 판단된다.
Trans Abstract
Purpose
Hydroxytyrosol is a type of phenolic phytochemical with antioxidant properties. In this study, we present the potential of hydroxytyrosol as a functional material with antioxidant effects by determining its intracellular action mechanism in ultraviolet A (UVA)-induced oxidative stress in human dermal fibroblasts (HDFs).
Methods
Evaluation of the efficacy of hydroxytyrosol was verified through cell survival rate analysis, active oxygen measurement, and quantitative real time polymerase chain reaction (qRT-PCR). The cell survival rate, which was decreased by UVA, increased in a concentration-dependent manner in response to hydroxytyrosol. A WST-1 assay was used to assess the decrease in cell survival rate due to UVA. To verify the antioxidant action of hydroxytyrosol, 2',7'-dichlorofluorescein diacetate (DCF-DA) was used to perform quantitative reactive oxygen species (ROS) analysis and measurement of changes in glutathione (GSH) values, and changes in expression of glutathione peroxidase 1 (GPx1), superoxide dismutase 1 (SOD1) and catalase (CAT) mRNA were also examined.
Results
The cell survival rate that was decreased because of UVA treatment was improved in a concentration-dependent manner by hydroxytyrosol. Antioxidant effects of hydroxytyrosol were confirmed by the elimination of ROS, increase in the amount of GSH, and increase in the expression levels of GPx1, SOD1, and CAT mRNA.
Conclusion
The results of this study suggest that hydroxytyrosol has antioxidant effects in HDFs. We believe that future clinical research on products containing this agent will enable its use in functional materials, such as antioxidants and cosmetics.
Trans Abstract
目的
Hydroxytyrosol是一种具有抗氧化性能的酚类植物化学物质, 对UVA诱导人真皮成纤维细胞用hydroxytyrosol处 理, 通过探索hydroxytyrosol的细胞内机制, 作为抗氧化功能性材料提供可行性。
方法
利用细胞生存率测定, 活性氧 测定, qRT-PCR方法进行对hydroxytyrosol的效能评价。利用WST-1 assay原理确认由UVA减少的细胞生存率;为确认 hydroxytyrosol的抗氧化效能, 利用DCF-DA进行ROS定量分析和测定GSH变化量, 以及确定GPx1 、SOD1 、CAT 遗传因 子的表达方法。
结果
因UVA减少的细胞生存率通过hydroxytyrosol根据浓度依赖性增加;因UVA增加的活性氧, 利用 hydroxytyrosol处理时, ROS、GSH的量减少以及GPx1,SOD1,CAT mRNA的表达量减少, 从而确认了抗氧化作用。
结论
通过研究确认了hydroxytyrosol的人真皮成纤维细胞的氧化抑制效果, 将来hydroxytyrosol产品进行临床研究, 作为抗氧 化剂和功能材料充分具有适用可行性
Introduction
오늘날 우리사회는 환경오염의 증가, 인구의 고령화 현상으로 인해 인체의 세포는 그 어느 때보다 산화적 손상으로 인한 스트레스를 많이 받게 되었으며 이러한 손상으로부터 보호받기 위한 노력이 많은 연구 활동을 통해 이루어지고 있다(Sies, 1997).
신체 내에서 활성산소종(reactive oxygen species, ROS)의 생성이 증가하게 되면 지질, 단백질, DNA 파괴 및 각종 면역물질의 활성도를 감소시키고 생체 내 세포를 손상시키며 노화나 색소 침착과 같은 미용학적 문제를 야기시킨다(Ciencewicki et al., 2008; Kwon et al., 2013). 따라서, 산화적 손상을 예방하기 위한 다양한 항산화제 개발을 위한 연구가 이루어져 왔으며, 일부 천연 항산화 물질은 세포의 산화적 손상을 방어하며 혈관 이완작용, 항염증, 항산화, 항암효과를 나타내는 약리 활성 성분이 풍부한 것으로 알려져 왔다(Kikuchi et al., 2005; Ursini et al., 1986). 잘 알려져 있는 항산화제로는 효소적 항산화제인 superoxide dismutase (SOD), catalase 및 glutathione peroxide/reductase와 비타민 E, 비타민 C, 유비퀴놀, 카로티노이드, 글루타치온 및 플라보노이드 등의 비효소적 항산화제가 주로 사용되어 왔다(Park, 1997).
그 외에도 비효소적 항산화제로 강력한 항산화 작용을 하는 물질로 잘 알려진 것으로는 올리브(Olive)가 있다. 올리브는 생체 및 피부에 친화적이며 안전한 것으로 항산화 효과 외에도 면역 체계를 강화하고 에너지를 증진시키며, 호흡기 관련 질환, 피부 상처 감염 치료, 감기 증상 완화 등에 뛰어난 효능을 나타내어 많은 분야에서 연구 대상이 되어 왔다(Kitani et al., 2002). 올리브 잎은 최고의 폴리페놀 복합체이며(Choi et al., 2008), 특히 올리브 과일과 오일에 다량 함유되어 있는 hydroxytyrosol은 올리브 오일의 주요 페놀 성분으로 강력한 항산화 효과를 가진 물질로 최근 기능성 식품 및 보충제의 성분으로 활발히 연구되고 있다(Lopez-Huertas & Fonolla, 2017; Poudyal et al., 2017; Visioli, 2012). Hydroxytyrosol에 관해서는 마우스에서의 산화 스트레스를 감소시키고, 혈관 내피세포에서 세포를 보호하고 신장 독성에 대해 항산화 효과가 있다는 연구 결과가 보고된바 있다(Capasso et al., 2007; Zheng et al., 2015).
이에 본 연구에서는 hydroxytyrosol을 이용하여 세포 독성을 알아보고, 인간 진피섬유아세포에 처리시 UVA에 의한 산화적 손상에 대해 분자 생물학적 기전을 확인하여 hydroxytyrosol의 산화 억제 효과를 확인함으로써, 화장품의 기능성 소재로써 활용 가능성을 살펴보고자 한다.
Methods
1. 세포배양
본 연구에 사용된 인간 진피섬유아세포(Human dermal fibroblasts, HDFs)는 Sigma-Aldrich (USA)로부터 구매하여 사용하였다. HDFs 세포의 배양은 Dulbecco’s Modified Eagle Medium (DMEM; Hyclone™, USA)에 10% fetal bovine serum (FBS; Hyclone™), 1% 페니실린/스트렙토마이신(penicillin 100 IU/mL, streptomycin 100 μg/mL; InvitrogenTM, USA)를 함유하고 있는 배지를 사용하였고, 37℃, 5% CO2가 유지되는 환경인 세포배양기 내에서 배양하였다.
2. 시료 처리
Hydroxytyrosol (Sigma-Aldrich)은 순수정제(>90%)된 liquid 형태로 실험에 사용될 때는 dimethyl sulfoxide (DMSO; Sigma-Aldrich)에 적정한 농도로 용해하여 사용되었다. 세포배양접시에 HDFs (1×10⁶ cells/well)를 24 h 동안 배양 후 hydroxytyrosol을 배지에 첨가해 6 h 동안 전 처리 하였다. 세포에 UV-A lamp (UVP, USA)를 이용하여 UVA를 조사하였고, UVA 파장은 fiberoptic spectrometer system USB2000 (Ocean Optics, USA)으로 측정하였다. HDFs에 UVA를 조사하기 위해 세포배양접시의 배지를 제거한 후, pH 7.4의 phosphate-buffered saline (PBS)로 2회 세척하고 세포가 건조되지 않도록 PBS 1 mL을 세척된 HDFs에 넣어 세포배양접시의 뚜껑을 연 상태로 UVA를 조사하였다. UVA 조사 후 PBS를 제거하고 다시 새로운 배지를 첨가하였고, 배양기에서 24 h 추가 배양한 후 실험에 사용하였다.
3. Cell viability 측정
세포 생존율은 water-soluble tetrazolium salt-1 (WST-1)의 원리를 이용하여 세포 내의 미토콘드리아 탈수소효소와 수용성인 tetrazolium salts가 반응할 때 형성되는 발색물질인 formazan을 이용하여 세포생존율을 측정하였다. HDFs (3×10³ cells/well)를 96 well plate에 접종하여 24 h 배양 후, hydroxytyrosol을 농도별로 5, 10, 20, 30 μM 로 처리하였고, UVA 조사 후에 24 h 동안 추가 배양하였다. 배양된 세포에 EZ-Cytox cell viability assay kit reagent (ItsBio, Korea) 10 μL를 첨가하여 1 h 후에 microplate reader (Bio-Rad, USA)를 이용하여 490 nm에서 흡광도를 측정하였다. 각각의 실험을 독립적으로 3회 반복하여 수행하였으며 세포생존율 평균값과 표준편차를 도출하였다.
4. RNA 추출과 cDNA 제조
세포배양이 끝난 세포를 trizol reagent (InvitrogenTM, USA)를 이용하여 용해한 후, 0.2 mL chloroform (Biopure, Canada)를 첨가하여 상온에서 반응하였다. 12000 rpm, 4℃ 조건으로 20 min 원심 분리하여 단백질이 포함된 하등액과 mRNA가 포함된 상등액을 분리한 후, 상등액은 0.5 mL isopropanol을 첨가해 10 min 상온에 방치하였고, 12000 rpm, 4℃ 조건으로 원심 분리하여 RNA를 침전시키고, 75% ethanol을 이용하여 세척 후 ethanol을 제거하고 상온에서 건조시켰다. 건조된 mRNA는 R Nase free water를 이용하여 녹여 실험에 사용하였고, 추출된 RNA는 Nanodrop (Maestrogen, USA)을 이용하여 260/280 nm의 ratio 1.8 이상인 순도의 RNA만을 실험에 사용하였다. 이렇게 추출된 RNA로부터 cDNA를 제작하기 위해서 PCR tube에 1 μg RNA, 0.5 ng oligo dT18를 total 10 μL로 제조 후 70℃에서 10 min 처리하여 RNA 변성을 유도하였고, M-MLV reverse transcriptase (Enzynomics, Korea)을 이용하여 37℃에서 1 h 반응시켜 cDNA를 합성하였다.
5. Quantitative real-time PCR
Hydroxytyrosol에 의한 HDFs 내에서 일어나는 유전자 발현 변화를 정량적으로 분석하기 위하여 qRT-PCR을 이용하였다. qRT-PCR은 PCR tube에 0.2 μM primers, 50 mM KCl, 20 mM Tris/HCl pH 8.4, 0.8 mM dNTP, 0.5U Extaq DNA polymerase, 3 mM MgCl, 1X SYBR green (InvitrogenTM)을 혼합하여 반응액을 제조하였으며, linegene K (BiOER, China)를 이용하여 PCR을 진행하였다. PCR의 유효성은 melting curve로 검증하였고, 각 유전자의 발현은 β-actin의 발현을 표준화하여 비교분석 하였다(Table 1).
6. 활성산소 측정
세포 내의 활성산소 농도 변화를 측정하기 위해 HDFs (2×10⁵ cells/well, 60 mm 배양 접시)을 24 h 배양 한 후 hydroxytyrosol을 5, 10 μM 농도별로 처리하였고, 24 h 추가 배양하였다. 세포 내 활성산소를 측정하기 위한 dye인 dichlorofluorescein diacetate (DCF-DA)를 10 μM 첨가하여 30 min 배양 후에 세포를 수확하여 PBS를 첨가하였고, 세포를 풀어준 다음 flow cytometry (Becton Dickinson, USA)를 사용하여 ROS 변화량을 측정하였다. Hydroxytyrosol의 활성산소 제거 효능을 비교·검증하기 위해 ROS 소거 능력이 뛰어난 것으로 알려져 있는 N-acetyl-L-cysteine (NAC)을 양성 대조군으로 사용하였고, hydroxytyrosol과 동일한 방식으로 처리 후 측정하였다.
7. 통계처리
모든 실험들은 독립적으로 3회 반복하여 수행하였으며, 실험결과는 평균±표준 편차로 나타내었다. 실험 결과는 Student t-test로 검정하였으며, p-value 값이 0.05 이하인 경우에만 통계적으로 유의하다고 분석하였다.
Results and Discussion
1. Hydroxytyrosol의 세포독성
인간 진피섬유아세포에 hydroxytyrosol을 5, 10, 20, 30 μM 농도로 각각 처리하여 hydroxytyrosol 자체의 세포독성을 확인하였고, hydroxytyrosol 5 μM 농도에서 118%, 10 μM에서 106%, 20 μM에서 97%, 30 μM에서 100%의 세포생존율을 보였다. 그러므로 hydroxytyrosol 20 μM이상의 농도에서는 세포독성이 있는 것으로 판단되어 이후 실험에서는 hydroxytyrosol 10 μM을 최대의 사용농도로 사용하였다(Figure 1).
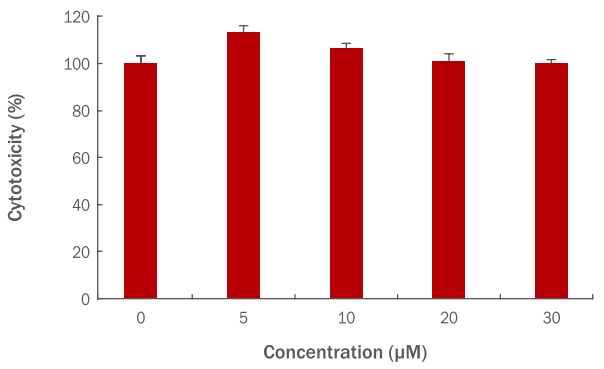
Cytotoxicity of hydroxytyrosol on HDFs.
HDFs (3×10³ cells) were plated into a 96-well plate; they were then, cultured for 24 h, and pre-treated with varying concentrations of hydroxytyrosol. After culturing for 24 h, cellular toxicity was measured using the WST-1 assay. HDFs were treated with hydroxytyrosol at concentrations of 5, 10, 20, and 30 μM to confirm the cytotoxicity of hydroxytyrosol. The graph represents the mean±standard deviation of the relative cell viability in each sample from triplicate experiments. HDFs, human dermal fibroblasts; WST-1, water-soluble tetrazolium salt-1..
2. UVA에 대한 hydroxytyrosol의 보호효능
UVA로 인해 손상된 인간 진피섬유아세포에서의 hydroxytyrosol의 세포보호 효능을 알아보기 위해 hydroxytyrosol을 각각 5, 10 μM의 농도로 전 처리 후 8 J/cm² UVA를 조사하였다. 그 결과 UVA만 조사한 대조군에서의 세포생존율이 57%에 비해 hydroxytyrosol을 5 μM 전 처리한 경우 75%, 10 μM에서 88%의 세포생존율을 보여 hydroxytyrosol에 의해 농도 의존적으로 세포생존율이 회복되고 있는 것을 확인하였다(Figure 2).

Protective effect of hydroxytyrosol in UVA- irradiated HDFs.
HDFs (3×10³ cells) were cultured on cell culture dishes for 24 h and were pre-treated with varying concentrations of hydroxytyrosol for 6 h. Cells were washed with PBS and irradiated with UVA (8 J/cm²). After incubation for 24 h, cell viability was measured using the WST-1 assay. The graph represents the mean±standard deviation of the relative cell viability in each sample from triplicate experiments. Student's t-test was performed to determine statistical significance. #p<0.05 compared with non-irradiated cells in the absence of hydroxytyrosol, and *p<0.05 compared with UVA-irradiated cells in the absence of hydroxytyrosol. UVA, ultraviolet A; HDFs, human dermal fibroblasts; PBS, phosphate-buffered saline; WST-1, water-soluble tetrazolium salt-1.
3. Hydroxytyrosol의 ROS 제거 효과
본 실험에서는 UVA로 인해 증가된 ROS가 hydroxytyrosol에 의해 어느 정도 제거되는지에 대한 변화량을 확인하고자 하였다. 그 결과 8 J/cm² UVA에 의해 ROS의 발현량이 1에서 2.75로 증가되었으나, hydroxytyrosol 각각 5, 10 μM 전 처리 후 8 J/cm² UVA 조사 시 ROS의 발현량이 2.15, 1.32로 감소되었다. 이 결과를 통해 hydroxytyrosol이 농도 의존적으로 ROS의 양을 감소시켜 세포 내 항산화 기능이 회복되고 있는 것이 확인되었다. 이 실험에서는 ROS scavenger로 알려진 N-acetyl-L-cysteine (NAC)을 양성대조군으로 비교분석하였다. 그 결과, 양성대조군으로 사용된 NAC은 10 mM에서 ROS의 발현량이 1.39로 감소하는 효과를 보였다(Figure 3). 특히 hydroxytyrosol 10 μM 처리한 경우의 ROS의 양은 항산화 효과 마커로 주로 사용되는 NAC 10 mM 처리한 양성대조군보다 그 양이 더 감소하여 hydroxytyrosol의 ROS 제거 능력이 탁월한 것으로 사료된다(Figure 3).

Effects of hydroxytyrosol on ROS scavenging in UVA-irradiated HDFs.
HDFs (3×10³ cells) were cultured on cell culture dishes for 24 h and were pre-treated with varying concentrations of hydroxytyrosol for 6 h. Cells were washed with PBS and irradiated with UVA (8 J/cm² ). After overnight incubation, DCF-DA was added and ROS level changes were measured 30 min later using a flow cytometer. The graph represents the mean±standard deviation of the ROS level in each sample from triplicate experiments. Student's t-test was performed to determine statistical significance. #p<0.05 compared with non-irradiated cells in the absence of hydroxytyrosol, and *p<0.05 compared with UVA-irradiated cells in the absence of hydroxytyrosol. ROS, reactive oxygen species; NAC, N-acetyl-L-cysteine; UVA, ultraviolet A; HDFs, human dermal fibroblasts; PBS, phosphate-buffered saline; DCF-DA, 2',7'-dichlorofluorescein diacetate.
4. Hydroxyyrosol이 GSH 변화에 미치는 효과
GSH는 항산화 작용을 위한 반응을 촉매시키고 물질대사를 포함하여 세포 내 수송을 하고 세포 산화·환원의 균형조절에 매우 중요한 역할을 통해 세포를 활성산소로부터 보호하는 역할을 한다(Lafleur et al., 1994). 따라서, hydroxytyrosol의 세포 내 H2O2 소거 정도와 OH- 라디칼 생성을 억제하는 효과를 확인하고자 GSH measurement 분석법을 이용하였다. 그 결과 8 J/cm² UVA에 의해 GSH의 양이 1에서 0.60로 감소되었으나, hydroxytyrosol 각각 5, 10 μM 전 처리 후 8 J/cm² UVA 조사 시 GSH의 양이 0.75, 1.04로 증가되었다(Figure 4). 이 결과를 통해 hydroxytyrosol이 농도 의존적으로 항산화제인 GSH의 발현을 증가시켜 세포 내 항산화 기능이 회복되고 있는 것으로 판단된다.
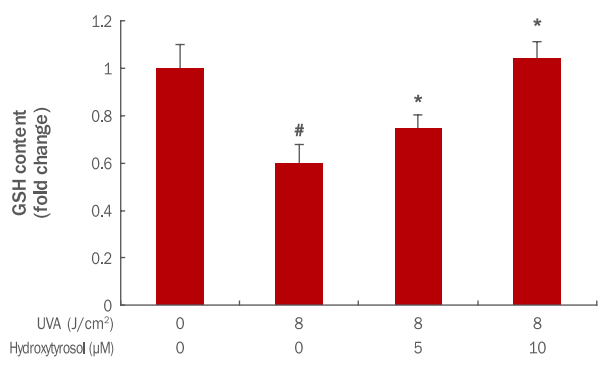
Effects of hydroxytyrosol on GSH activation change in UVA-irradiated HDFs.
HDFs (3×10³ cells) were cultured on cell culture dishes for 24 h and were pre-treated with varying various concentrations of hydroxytyrosol for 6 h. Cells were washed with PBS and irradiated with UVA (8 J/cm² ). After overnight incubation, cells were separated from the medium and treated with a lysis buffer. The graph represents the mean±standard deviation of the ROS level in each sample from triplicate experiments. Student's t-test was performed to determine statistical significance. #p<0.05 compared with non-irradiated cells in the absence of hydroxytyrosol, and *p<0.05 compared with UVA- irradiated cells in the absence of hydroxytyrosol. GSH, glutathione; UVA, ultraviolet A; HDFs, human dermal fibroblasts; PBS, Phosphate buffered saline.
5. Hydroxytyrosol이 GPx1 발현 변화에 미치는 효과
세포 내 항산화 단백질 유전자인 glutathione peroxidase (GPx1)은 GSH에 의해 H2O2나 다른 organic hydroperoxide를 환원시키는 기능을 하며 산화적 손상으로부터 세포를 보호하는 작용을 한다(Halliwell, 1992). 본 실험에서는 UVA에 의해 감소 된 GPx1 mRNA가 hydroxytyrosol에 의해 어느 정도 회복되는지를 그 변화량을 확인하였다. 그 결과 8 J/cm² UVA에 의해 GPx1 mRNA의 발현이 1에서 0.54로 감소되었으나, hydroxytyrosol 각각 5, 10 μM 전 처리 후 8 J/cm² UVA 조사 시 GPx1 mRNA 발현이 0.83, 0.92로 증가되었다(Figure 5). 이 결과를 통해 hydroxytyrosol이 활성산소로부터 세포를 보호하는데 효과가 있는 것으로 판단된다.
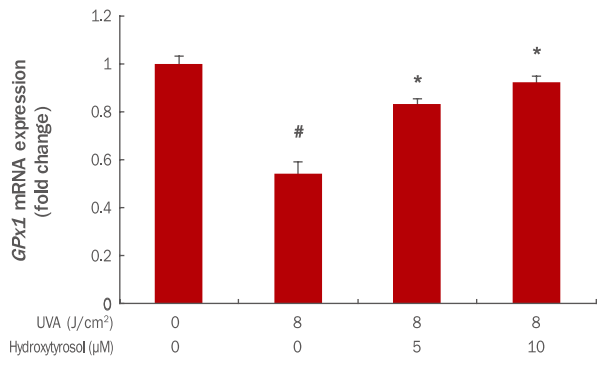
Effects of hydroxytyrosol on GPx1 activation change in UVA-irradiated HDFs.
HDFs were cultured for 24 h and pre-treated with varying concentrations of hydroxytyrosol for 6 h. Then, the cells were irradiated with UVA for 24 h. GPx1 mRNA expression was confirmed with qRT-PCR and was found to increase with the hydroxytyrosol concentration. The graph is representative of three independent experiments with mean±standard deviation. The Student's t-test was performed to determine statistical significance. #p<0.05 compared with non irradiated cells in the absence of hydroxytyrosol, and *p<0.05 compared with UVA-irradiated cells in the absence of hydroxytyrosol. GPx1, glutathione peroxidase 1; UVA, ultraviolet A; HDFs, human dermal fibroblasts; qRT-PCR, quantitative real time polymerase chain reaction.
6. Hydroxytyrosol이 SOD1 발현에 미치는 효과
SOD1은 주된 항산화 효소로 인체 내에서 모든 조직에 대해 산화적 스트레스를 감소시키는데 중요한 역할을 한다(Huang et al., 1999). 본 실험에서는 UVA에 의해 감소된 SOD1 mRNA가 hydroxytyrosol에 의해 어느 정도 회복되는지를 확인하였다. 그 결과 8 J/cm² UVA에 의해 SOD1 mRNA의 발현이 1에서 0.35로 감소되었으나, hydroxytyrosol 각각 5, 10 μM 전 처리 후 8 J/cm² UVA 조사 시 SOD1 mRNA 발현이 0.70, 0.91로 증가되었다(Figure 6). 이 결과를 통해 hydroxytyrosol이 SOD1 발현을 증가시켜 활성산소를 감소시키고 세포 및 조직을 보호하는데 효과가 있는 것으로 사료된다.
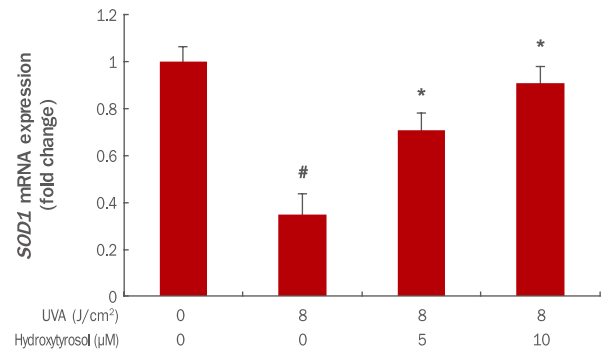
Effects of hydroxytyrosol on SOD1 mRNA expression in UVA-irradiated HDFs.
HDFs were cultured for 24 h and pre-treated with hydroxytyrosol of different concentrations for 6 h. After UVA irradiation, cells were incubated 24 h in serum-added medium. SOD1 mRNA expression was confirmed using qRT-PCR and was found to increase with the hydroxytyrosol concentration. The expression of SOD1 mRNA was increased in a dose dependent manner by 5, 10 μM pretreatment with hydroxytyrosol. The graph represents the mean±standard deviation from three independent experiments. The Student's t-test was performed to determine statistical significance. #p<0.05 compared with non irradiated cells in the absence of hydroxytyrosol, and *p<00.05 compared with UVA irradiated cells in the absence of hydroxytyrosol. SOD1, superoxide dismutase 1, UVA, ultraviolet A; HDFs, human dermal fibroblasts; qRT-PCR, quantitative real time polymerase chain reaction.
7. Hydroxytyrosol이 CAT 발현에 미치는 효과
체내 항산화 효소인 카탈라아제(catalase, CAT)는 수산화 라디칼(hydroxyl radical, OH-)의 생성을 억제하는 기전에서 항산화 작용을 하게 된다(Girard et al., 2006). 본 연구에서는 산화적 스트레스를 유발시켰을 때, hydroxytyrosol 처치로 CAT 생성에 미치는 영향을 확인하고자 하였다. 그 결과 8 J/cm² UVA에 의해 CAT mRNA의 발현은 1에서 0.46으로 감소되었으나, hydroxytyrosol을 각각 5, 10 μM 전 처리 후 8 J/cm² UVA 조사 시 CAT mRNA 발현은 0.70, 0.89로 증가되었다. 이 실험으로 hydroxytyrosol이 농도 의존적으로 항산화 유전자인 CAT mRNA 발현을 증가시켜 항산화에 효과가 있는 것이 확인되었다(Figure 7). 즉, hydroxytyrosol이 감소된 CAT의 회복에 관여하며 세포 내 활성산소(ROS)의 감소와 세포 노화 억제에 효과가 있는 것으로 예상된다.
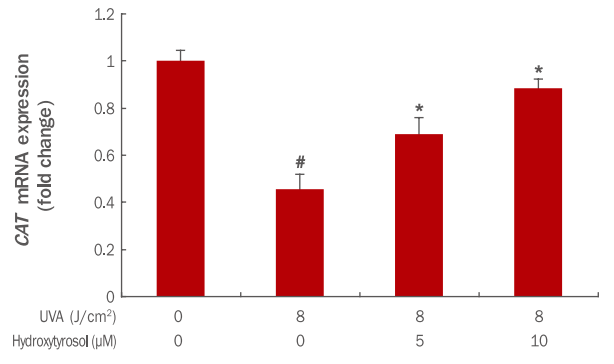
Effects of hydroxytyrosol on CAT mRNA expression in UVA-irradiated HDFs.
HDFs were cultured for 24 h and pre-treated with varying concentrations of hydroxytyrosol for 6 h. Then, cells were irradiated with UVA and incubated 24 h in a medium containing serum. CAT mRNA expression was confirmed using qRT-PCR and was found to increase with the hydroxytyrosol concentration. The expression of CAT mRNA in the group treated with 5, 10 μM hydroxytyrosol was increased in a concentration-dependent manner. The graph represents the mean±standard deviation from three independent experiments. The Student's t-test was performed to determine statistical significance. #p<0.05 compared with non irradiated cells in the absence of hydroxytyrosol, and *p<0.05 compared with UVA irradiated cells in the absence of hydroxytyrosol. CAT, catalase; UVA, ultraviolet A; HDFs, human dermal fibroblasts; qRT-PCR, quantitative real time polymerase chain reaction.
Conclusion
현대인은 그 어느 때보다도 산화적 스트레스를 유발하는 환경 속에 노출되어있다. 산화적 스트레스는 다양한 질병을 야기하고, 신체 내외적으로 노화를 일으키는 것으로 알려져 있어 이를 억제하기 위한 천연물 소재 개발과 연구가 식품이나 의·약학, 생명과학 분야에서 진행되어 왔다. 항산화 작용이 뛰어난 것으로 알려져 많은 분야에서 연구 대상이 되어 온 올리브 중 과일과 오일에 주로 함유되어 있는 hydroxytyrosol은 강력한 항산화 효과를 가진 물질로 기능성 식품 및 보충제의 성분으로 활발히 연구되어 왔다(Lopez-Huertas & Fonolla, 2017; Poudyal et al., 2017; Visioli, 2012). 그러나 향장 분야에서의 hydroxytyrosol에 대한 연구는 극히 미미하며, 인간 진피섬유아세포에서의 hydroxytyrosol에 대한 연구는 없었던 것으로 보인다. 따라서, 본 연구에서는 인간 진피섬유아세포에서의 산화적 스트레스에 대해 hydroxytyrosol의 항산화 효과를 확인하여 항산화 효과가 있는 항노화 화장품 원료로서의 가능성을 알아보고자 한다.
첫째, Hydroxytyrosol을 인간 진피섬유아세포에 처리했을 때 UVA에 의한 세포 손상에 어떠한 영향을 주는지 확인하고자 ROS 제거 및 GSH의 변화, GPx1, SOD1, CAT 유전자의 발현변화를 살펴보았다.
Hydroxytyrosol의 항산화 효과를 확인한 결과 hydroxytyrosol 처리로 인해 인간 진피섬유아세포에서의 ROS 총량은 농도 의존적으로 감소하였고(Figure 3), GSH의 변화값은 hydroxytyrosol 농도가 증가함에 따라 그 양이 증가하는 것을 확인할 수 있었다(Figure 4). 특히 hydroxytyrosol 10 μM 처리한 경우의 ROS의 양은 NAC 10 mM 처리한 양성대조군보다 그 양이 더 감소하여 뛰어난 항산화 소재로서의 유효성을 확인 할 수 있었다.
둘째, 항산화 효소인 SOD1과 CAT, GPx1 유전자 발현 변화에서는 hydroxytyrosol 처리로 유전자 발현이 농도 의존적으로 증가하여(Figure 5, Figure 6, Figure 7), 항산화에 효과가 있는 기능성 화장품으로서의 hydroxytyrosol의 활용 가치를 확인 할 수 있었다.
이상의 결과를 통해 hydroxytyrosol은 기존에 알려진 기능성 식품 및 보충제의 성분으로의 활용뿐만 아니라 피부세포에서의 항산화 효과가 우수하여 피부 산화적 스트레스를 감소시키는데 효과가 있는 기능성 화장품 소재로도 사용될 수 있을 것으로 사료된다. 또한 향후에 본 추출물이 적용된 제품을 이용한 임상 연구가 진행된다면 화장품 및 피부 미용에 실질적으로 응용 가능한 기능성 소재로서의 활용 가능성이 있을 것으로 기대된다.
Acknowledgements
이 논문은 해양수산부의 재원으로 해양생명공학기술개발사업(과제번호: 20150184) 연구개발비 지원에 의해 수행되었습니다.
