화장품 소재로서 고마리 추출물의 생리활성
Persicaria thunbergii Extract as a Physiologically Active Cosmetic Ingredient
Persicaria thunbergii提取物作为生理活性化妆品原料
Article information
Abstract
목적
고마리 추출물에 대한 생리활성 및 그에 따른 화장품 소재로서의 응용 가능성을 알아보고자 하였다.
방법
고마리 에탄올 및 열수 추출물의 항산화, 항염, 항균 효능을 확인하기 위하여 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical 소거능, nitric oxide (NO) 생성량 측정, 산화적 스트레스에 대한 HaCaT 세포 보호 효과, 항염, 항균, 알러지인자인 β-hexosaminidase 발현량 억제를 측정하였다.
결과
고마리 추출물의 항산화 효능을 비교한 결과, 에탄올 추출물이 열수 추출물보다 우수하였으며, 고마리 에탄올, 열수 추출물의 폴리페놀 함량은 각각 132.00, 89.46 μg/mL이고, 총 플라보노이드 함량은 각각 115.27, 84.94 μg/mL으로 확인되었다. 그리고 DPPH radical 소거능 측정결과, 고마리 에탄올, 열수 추출물의 농도가 500 μg/mL 일 때 각각 79.80, 70.33%로 확인되었으며, 세포 독성 실험결과, HaCaT, RAW 264.7, RBL-2H3 세포에서 유의한 세포독성은 나타나지 않았다. Hydrogen peroxide (H2O2)에 의해 유발되는 산화적 스트레스에 대한 HaCaT 세포 보호 효과 확인결과, 고마리 에탄올, 열수 추출물은 23%, 18%로 세포 보호 효과가 확인되었다. RAW 264.7 세포에 대한 고마리 추출물의 항염 효과를 확인한 결과, 농도 의존적으로 nitric oxide (NO)생성이 억제되었다. β-Hexosaminidase의 분비를 측정한 결과, 고마리 에탄올과 열수 추출물은 농도 의존적으로 면역세포의 탈과립을 억제하였다. 고마리 추출물의 항균효능을 측정한 결과, Staphylococcus aureus (S. aureus), Staphylococcus epidermidis (S. epidermidis), Propionibacterium acnes (P. acnes)에서도 농도 의존적으로 항균 활성이 확인되었다.
결론
이상의 연구결과를 통해 고마리 추출물은 항산화, 항염증 및 항균 효과를 가지는 기능성 화장품 소재로서의 효능이 확인되었다. 앞으로 기능성 화장품 소재로서의 활용 가능성을 판단하기 위하여 임상적으로 동물, 인체실험을 통한 고마리 추출물의 효능 검증 연구가 체계적으로 진행되어야 할 것이다.
Trans Abstract
Purpose
The purpose of this study was to investigate the potential of Persicaria thunbergii (P. thunbergii) extracts as physiologically active cosmetic ingredients.
Methods
To elucidate the anti-oxidative, anti-inflammatory, and anti-microbial properties of P. thunbergii, its ethanol and hot-water extracts were examined for 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging activity, nitric oxide (NO) production, protective effects against oxidative stress in HaCaT cells, anti-inflammatory activity, anti-microbial activity, and inhibition of β-hexosaminidase expression, an allergy factor.
Results
The anti-oxidative activity of the two P. thunbergii extracts was compared, and the anti-oxidative activity of the ethanol extract was found to be superior to that of the hot-water extract. The polyphenol contents of P. thunbergii ethanol and hot-water extracts were 132.00 and 89.46 μg/mL, respectively. And total flavonoid contents of P. thunbergii ethanol and hot-water extracts were 115.27, 84.94 μg/mL, respectively. The DPPH radical scavenging activity was found to be 79.80% for the ethanol extract and 70.33% for the hot-water extract at a concentration of 500 μg/mL. No significant cytotoxicity was observed in HaCaT, RAW 264.7 and RBL-2H3 cells. The protective effect of the extracts on HaCaT cell against oxidative stress induced by hydrogen peroxide (H2O2) was confirmed by 23% for ethanol extract and 18% for hot water extract. The anti-inflammatory activity of the extracts was examined in RAW 264.7 cells, and nitric oxide (NO) productionwas suppressed in a concentration-dependent manner. Both ethanol and hotwater extracts also inhibited the degranulation of immune cells in a concentrationdependentmanner, as assessed by the secretion of β-hexosaminidase. In addition, the concentration dependent anti-microbial activities of the extracts were demonstrated in several bacterial strains, such as those of Staphylococcus aureus (S. aureus), Staphylococcus epidermidis (S. epidermidis), and Propionibacterium acnes (P. acnes).
Conclusion
Based on the findings from this study, P. thunbergii extracts could be used as functional cosmetic ingredients that possess anti-oxidative, anti-inflammatory, and anti-microbial properties. In order to determine their applicability, further research should be systematically conducted to verify their efficacy through clinical studies in animals and humans.
Trans Abstract
目的
探讨Persicaria thunbergii (P. thunbergii )提取物的生理活性,鉴定其作为天然化妆品原料的应用可 行性。
方法
为了阐明P. thunbergii 乙醇和热水提取物的抗氧化,抗炎和抗微生物特性,测定2,2-diphenyl-1-picrylhydrazyl(DPPH)自由基清除活性,一氧化氮(NO)生成,对氧化应激HaCaT细胞的保护作用, 抗炎活性,抗菌活性以及抑制过敏因子β-氨基己糖苷酶表达量。
结果
比较两种Persicaria thunbergii 提取 物的抗氧化活性,发现乙醇提取物的抗氧化活性优于热水提取物的抗氧化活性。测定总多酚含量,乙醇提取 物为132.00 μg/mL,热水提取物为89.46 μg/mL。乙醇和热水提取物的总类黄酮含量分别为115.27,84.94 μg/mL。测定DPPH自由基清除活性结果,在提取物浓度为500 μg/mL时,DPPH自由基清除活性能力分别为 79.80%(乙醇提取物),70.33%(热水提取物)。细胞毒性试验显示,提取物对HaCaT细胞,RAW264.7和 RBL-2H3细胞,没有显着的细胞毒性。HaCaT细胞对过氧化氢(H2O2)诱导的氧化应激的保护作用被证实为 乙醇提取物为23%,热水提取物为18%。对RAW264.7细胞的抗炎活性检测结果显示,以浓度依赖性方式抑 制NO的生成。通过β-氨基己糖苷酶的分泌评估的,乙醇和热水提取物也以浓度依赖性方式抑制免疫细胞的脱 粒。另外,提取物的浓度依赖性抗微生物活性在几种细菌菌株中证实,例如金黄色葡萄球菌(Staphylococcus aureus ,S. aureus ),表皮葡萄球菌(Staphylococcus epidermidis ,S. epidermidis ),痤疮丙酸杆菌 (Propionibacterium acnes ,P. acnes )等。
结论
基于这项研究的发现,P.thunbergii 提取物可以用作具有抗氧化,抗炎和抗微生物特性的功能性化妆品成分。为了确定P.thunbergii 提取物的适用性,应该系统地进行 进一步的研究,以通过动物和人类的临床研究来验证其功效。
Introduction
인간의 평균 수명이 증가되고 삶의 질 향상으로 신체적, 정신적 건강을 위한 건강 기능 식품분야와 화장품 관련분야에서도 천연물에 대한 관심이 증대되고 있다. 개인의 경쟁력 중 외모에 대한 케어 확산 증가로 많은 사람들은 건강한 삶과 젊음에 대한 욕구가 팽배해지고 있다. 피부는 전신을 둘러싸며 외부환경으로부터 여러 가지 자극 및 장해, 혹은 건조로부터 생체를 보호하는 역할을 하고 있다(Jeon et al., 2014).
염증은 피부손상 및 노화의 주요 원인이며, 이 과정은 체내 세포 조직에 어떠한 기질적 변화를 가져오는 침습이 가해질 때, 생체가 재생이나 회복 등을 하기 위한 방어적 반응으로 나타나는 것이다. 이 과정에서 활성 산소종(reactive oxygen species)의 일종인 nitric oxide (NO)는 대식 세포와 같은 면역세포에 의해 생성되어 각종 생리 및 병리적 과정에 있어 중요한 역할을 한다(Lee et al., 2007). 또한 피부 알레르기 반응은 염증성 질환의 한 종류로, mast cell이 탈과립 되어 일어나는데 이때 히스타민이 분비된다. 히스타민은 mast cell에서 합성, 저장되고 급성 염증 반응에 많은 영향을 끼치는 것으로 알려져 있다. 그리고 β-hexosaminidase는 히스타민과 mast cell 내에 함께 존재하는 효소로 탈과립에 의해 누출되는 히스타민의 양과 비례하는 것으로 알려져 있어 항알레르기 효과 확인의 지표로서 이용되고 있다(Hong et al., 2014). 특히 환경오염과 화학물질, 자외선, 혈액순환장애 및 과도한 스트레스, 기능성 화장품의 남용 등 기존의 화장품에 사용되고 있는 합성물질들은 피부에 알레르기를 일으키거나 사람에 따라 유해한 영향을 미칠 수 있으므로 피부 자극이나 안정성의 문제가 대두되면서 인체에 무해한 천연물질 소재에 관한 연구가 활발히 진행 중에 있다(Bae & You, 2017).
고마리(Persicaria thunbergii, P. thunbergii)의 국내 연구로는 lipopolysaccharide (LPS)로 처리 된 RAW 264.7 세포에서 고마리 추출물의 항염증 효과(Kim et al., 2011a), persicarin과 quercitrin 등 고마리의 항산화 활성성분에 대한 보고가 있다(Lee et al., 2001). 또한 천연 복합물의 항산화(Kim et al., 2011b) 및 생리 활성이나 화장품 소재 연구로는, 참당귀 연구에서 quercetin이 강한 생리활성으로 보고 되었고(Moon et al., 2000), 황금 지상부의 항산화 및 알러지 활성 성분(Cha et al., 2006)에서 지질과산화에 대한 억제효과를 나타냈다. 그리고 파슬리 지상부의 항산화 활성성분(Choi & Moon, 2017), 갈퀴나물 지상부 에탄올 추출물의 항산화 및 항주름 효과(Kim et al., 2015), 황기에탄올 추출물 및 생물전환 추출물의 항산화, 항염증 효과에 대한 생리활성(Bae & You, 2017) 등 연구가 보고되고 있다. 이러한 천연물의 다양한 생리활성 연구가 증대되고 있으나 국내에서 자생하는 고마리 추출물에 대한 연구는 미흡한 실정이다. 따라서 본 연구에서는 고마리 추출물의 생리활성을 살펴보고, RAW 264.7 세포에서의 항염증, 항산화, 항균 효과를 확인함으로써 화장품 소재로서의 생리활성 효능을 알아 보고 기초자료로 제공하고자 한다.
Methods
1. 실험재료
1) 시료
본 실험에 사용한 고마리는 전남생약농업 협동조합(Korea)에서 구입하여, 물로 4-5 회 세척하여 불순물을 제거한 다음 실온에서 건조하여 시료로 사용하였다. 고마리 에탄올 추출(P. thunbergii 70% ethanol extraction, PEE)은 건조한 고마리 10 g을 70% 에탄올(Duksan Pure Chemicals, Korea) 1 L를 이용하여 환류 냉각추출기로 60℃ 조건에서 24 h 동안 추출하였고, 고마리 열수추출(P. thunbergii water extraction, PWE)은 고마리 10 g을 정제수 1 L를 이용하여 환류냉각 추출기로 60℃ 온도 조건에서 24 h 후 추출하고 추출액은 여과지(Whatman filter paper No. 2; GE Healthcare Life Sciences, USA)를 사용하였으며, 감압농축기(EYELA N-1000; Tokyo Rikakikai, Japan)를 이용하여 에탄올을 제거한 후 동결건조(FD5508; IlshinBioBase, Korea)하여 냉동 보관하여 사용하였다. 열수 추출물의 수율은 26.8%이고, 에탄올 추출물의 수율은 17.8%로 확인되었다.
2) 세포주 및 세포배양
본 실험에 사용한 HaCaT 세포, 마우스의 RAW 264.7 대식세포, rat basophilic leukemia 세포주인 RBL-2H3 세포는 한국세포주은행(Korean Cell Line Bank, Korea)에서 구입하였다. HaCaT 세포와 RAW 264.7 대식세포는 Dulbecco's Modified Eagle Medium (DMEM; Gibco™, Thermo Fisher Scientific, USA), RBL-2H3 세포는 minimun essential media (MEM; Gibco™)에 각각 10% fetal bovine serum (FBS; Gibco™)과 1% streptomycin/penicillin (HyClone™, GE Healthcare Life Sciences)을 첨가하여 사용하였고, 37℃, 95% 습도, 5% CO2의 습윤화된 incubator에서 배양하였다.
2. 항산화 실험
1) 총 폴리페놀 함량 측정
총 폴리페놀 함량은 Folin & Denis (1915) 방법을 수정하여 사용하였다. 고마리 추출물(1 mg/mL)을 시료 50 μL에 증류수 650 μL를 넣은 후 Folin-Denis phenol reagent (Sigma-Aldrich, USA) 50 μL를 혼합하여 3 min 동안 실온에서 반응시킨 후 10% sodium carbonate (Na2CO3; Sigma-Aldrich) 포화용액을 100 μL를 첨가하고, 최종 볼륨을 1 mL로 맞추기 위하여 증류수 150 μL를 넣어 혼합시켰다. 고마리 에탄올, 열수추출물의 농도 1 mg/mL를 37℃ water bath (HB-205WM; HANBAEK Scientific Technology, Korea)에서 1 h 반응시킨 후 microplate reader (Molecular Devices, USA)를 이용하여 725 nm에서 흡광도를 측정하였다. 동일한 조건으로 3회 반복적으로 실험하여 평균값을 측정하였으며 표준 물질은 tannic acid (Sigma-Aldrich)를 이용하였다.
2) 총 플라보노이드 함량 측정
총 플라보노이드 함량은 Davis 등의 방법(Swain et al, 1959)을 수정하여 사용하였다. 고마리 추출물 0.1 g에 methanol (B&J Brand®, USA) 10 mL을 가하여 70℃에서 30 min 동안 추출한 후 1 mg/mL로 희석하여 사용하였다. 검액 100 μL에 1 mL의 diethylene glycol (DEG; B&J Brand®)를 첨가하고, 다시 1N sodium hydroxide (NaOH; Sigma-Aldrich) 100 μL을 넣어 잘 혼합시켜 고마리 에탄올, 열수추출물의 농도 1 mg/mL를 37℃ water bath에서 1 h 반응시킨 후 microplate reader (Molecular Devices)를 이용하여 420 nm에서 흡광도를 측정하였다. 표준 곡선은 naringin (Sigma-Aldrich) 농도를 0-300 μg/mL이 되도록 조절하여 총 플라보노이드 함량을 구하였다.
3) DPPH radical 소거능 측정
DPPH (Sigma-Aldrich) radical을 이용한 항산화 활성은 Blois (1958)의 방법을 사용하였다. 고마리 추출물을 96 well plate에 각 농도별(15.5-500 μg/mL) 10 μL와 1 mM DPPH 용액 90 μL를 혼합한 후 30 min 암 상태에서 반응 한 후 잔존 radical 농도를 microplate reader (Molecular Devices)를 이용하여 517 nm에서 흡광도를 측정하였다. 동일한 조건으로 3회 반복적으로 실험하여 평균값을 측정하였으며 양성 대조군으로 butylated hydroxytoluene (BHT; Sigma-Aldrich)와 L-ascorbic acid (vitamin C; Sigma-Aldrich)를 사용하였다. DPPH radical 소거능(%)=[1-(시료 첨가군 흡광도/시료 무첨가군 흡광도)]×100에 의해 산출하였다.
3. 세포생존율 측정
HaCaT 세포와 RAW 264.7 대식세포 그리고 RBL-2H3 세포의 생존율 측정은 Mosmann (1983) 방법에 의하여 실시하였다. 96 well plate의 각 well에 logarithmic phase에 도달한 세포를 1×105 cells/well의 농도로 분주한 후 24 h 배양하여 부착화 및 안정화를 시행하였다. 24 h 배양 후 추출물의 최종 농도가 5-200 μg/mL로 배양액에 희석하여 부착 및 안정화 된 세포에 공급하고 24 h 동안 배양하였다. 배양 후 각 well에 thiazolyl blue tetrazolium bromide (MTT; Sigma-Aldrich, 5 mg/mL in phosphate buffered saline) 용액을 10 μL씩 가해주고, 다시 37℃, 5% CO2의 습윤 배양기에서 4 h 동안 반응하여 MTT가 환원되도록 하였다. 각 well에 생성된 formazan 결정을 dimethyl sulfoxide (DMSO; Sigma-Aldrich) 150 μL로 잘 녹여서 ELISA reader (Bio-Rad, USA)를 이용하여 540 nm에서 흡광도를 측정하였다. 측정은 3회 반복 실시 후 t-test를 통해 통계적으로 각각의 유의성을 확인하였다.
4. H2O2에 유발되는 산화적 스트레스에 대한 HaCaT 세포 보호 효과
H2O2에 의해 유발되는 산화적 스트레스에 대한 HaCaT 세포의 보호 효과를 관찰하기 위하여 O'Toole et al. (1996) 방법을 응용하여 실험하였다. 96 well plate에 HaCaT 세포를 1×105 cells/well의 농도로 조절하여 24 h 동안 배양한 후, 세포 생존율에 따라 추출물을 2 h 전처리 후, 최종 농도가 200 μM의 H2O2를 함유한 배양액을 투여하여 24 h 동안 반응시킨 다음 MTT assay로 생존율을 측정하였다.
5. NO 생성 저해능 측정
염증 유발에 중요한 역할을 하는 것으로 알려진 NO (Lee et al., 2006) 생성 저해능에 대한 고마리 추출물의 효과를 알아보기 위하여 RAW 264.7 세포에 LPS로 자극을 주고, 고마리 추출물을 처리하여 실험을 진행하였다. Raw 264.7 세포로부터 생성된 NO의 양은 griess reagent (Sigma-Aldrich)를 이용하여 세포 배양액 중에 존재하는 nitrite (NO2-)의 형태를 측정하였다. 96 well plate에 각 well당 1×105 cells/mL의 Raw 264.7 세포가 들어있는 부유액 100 μL를 접종하고, 24 h 배양한 후 배지를 제거하고, 무혈청 배지에 최종 농도가 각각 5, 10, 20, 50 μg/mL으로 되도록 시료를 처리한 후 염증 반응 유도 인자인 LPS 1 μg/mL를 처리하여 24 h 배양하였다. 세포배양 상등액 100 μL과 동량의 griess reagent를 가하여 96 well plate에서 차광된 상태에서10 min 동안 반응시킨 후, ELISA reader를 사용하여 540 nm에서 흡광도를 측정 하였다. Nitrite의 농도는 sodium nitrite (NaNO2; Sigma-Aldrich)와 비교하였다.
NO 생성 저해능(%)=[시료 첨가군의 흡광도/시료 무첨가군의 흡광도]×100
6. 항알레르기 활성 측정
RBL-2H3 세포를 24 well plate에 각각 2×105 cells/well의 세포가 들어가도록 분주한 다음, 각 well 당 25 ng/mL의 antidinitrophenyl immunoglobulin E (anti-DNP IgE; Sigma-Aldrich)로 감작시키고, 5%의 CO2 배양기에서 12 h 배양시켰다. 세포를 siraganian buffer [119 mM sodium chloride (Sigma-Aldrich), 5 mM potassium chloride (Sigma-Aldrich), 5.6 mM glucose (Sigma-Aldrich), 0.4 mM magnesium chloride (Sigma-Aldrich), 25 mM piperazine-N,N'-bis(2-ethanesulfonic acid) (Sigma-Aldrich), 40 mM NaOH (Sigma-Aldrich), 1 mM calcium chloride (Sigma-Aldrich), 0.1% bovine serum albumin (BSA; Gibco™), pH 7.2]로 2회 세척한 후 추출물을 농도별(5-200 μg/mL)로 첨가한 후 37℃에서 30 min 동안 다시 반응시키고, 여기에 2-4-dinitrophenyl-human serum albumin (DNP-HSA; Sigma-Aldrich) 250 ng/mL를 처리하여 30 min 동안 알레르기 반응을 유도하였다. Ice bath에서 10 min 동안 반응을 정지시킨 후 12,000 rpm에서 3 min 원심 분리하여 상등액만 회수하여 β-hexosaminidase 측정에 이용하였다.
β-Hexosaminidase 분비 저해 측정은 상등액 30 mL와 substrate buffer (2 mM 4-nitrophenyl-N-acetyl-β-D-glucosaminide (Sigma-Aldrich), 0.05 M sodium citrate (Sigma-Aldrich, pH 4.5) 30 mL를 혼합한 반응액을 1 h 동안 37 ℃에서 반응시키고, 0.1 M carbonate buffer (Sigma-Aldrich) 250 mL를 첨가하여 반응을 종결시키고, ELISA reader (Bio-Rad)를 사용하여 405 nm에서 흡광도를 측정하였다.
7. 균주 배양 및 항균 활성 측정
항균 실험에 사용한 균주는 피부 상재균 중 염증을 유발하는 S. aureus, S. epidermidis, P. acnes 로 생물자원 센터(Korean Collection for Type Culture, Korea)에서 구입하여 계대 배양하여 사용하였다. S. aureus 와 S. epidermidis의 균주 배양을 위한 배지는 각각 nutrient broth (Becton, Dickinson and Company, USA)를 사용하였으며 P. acnes 의 배지는 reinforced clostridial broth (Becton, Dickinson and Company)를 사용하였다.
8. Disc diffusion assay에 의한 항균 활성 측정
고마리 에탄올, 열수 추출물의 항균 활성은 실험 균주를 대상으로 disc diffusion assay으로 측정하였다. 배양된 균주는 1×107 CFU/mL으로 조절한 후 본 실험에 사용하였다. 평판 배지에 배양된 각 균주를 100 μL씩 도말하여 준비하였고, 고마리 에탄올, 열수 추출물을 각각 0.5, 1, 5, 10 mg/mL 농도로 40 μL씩 paper disc (diameter 8 mm; Toyo Roshi kaisha, Japan)에 천천히 흡수시킨 뒤, 건조과정을 거쳐 용매를 휘발시켰다. 대조군으로는 에탄올을 사용하였다. 배양 후 disc 주변에 생성된 저해환(clear zone, mm)의 직경(mm)을 측정하여 항균 활성을 비교하였다.
9. 통계처리
본 연구의 모든 실험결과는 동일한 조건으로 3 회 이상 반복하여 평균값으로 나타내었다. 모든 실험결과는 평균±표준편차(mean±standard deviation, M±SD)로 표기하였다. 대조군과 실험군 사이의 통계학적 유의성 검정은 one-way analysis of variance (ANOVA)검정을 적용하였으며 p<0.05 수준에서 유의성 검정을 실시하였다.
Results and Discussion
1. 항산화 측정결과
1) DPPH radical 소거능
Free radical은 안정한 활성 산소종(reactive oxygen species, ROS)으로 항산화 물질의 산화력을 검증하는데 널리 사용되는 물질이다. DPPH radical 소거 활성법은 항산화 활성과 연관성이 매우 높다고 알려져 있다. 이 방법은 DPPH가 517 nm에서 특이적인 흡수 band를 갖는 비교적 안정한 free radical의 특성을 이용한다. 고마리 에탄올, 열수 추출물을 농도별(15.5-500 μg/mL)로 DPPH 용액에 첨가하여 free radical 소거 활성능력 측정결과, 고마리 에탄올 추출물은 10.80, 22.10, 45.10, 70.90, 78.20, 79.80%의 소거능이, 열수 추출물은 3.47, 8.08, 22.89, 37.81, 55.47, 70.33%의 소거능이 확인되었다. 62.5 μg/mL의 농도에서 양성 대조군으로 사용한 L-ascorbic acid는 91.81%, BHT는 28.36%의 라디칼 소거 활성이 확인되었으며, 고마리 에탄올 추출물은 동일한 농도 62.5 μg/mL에서 45.10%의 라디칼 소거능이 확인되었다. 따라서 고마리 추출물의 농도가 증가 함에 따라 DPPH 라디칼 소거능이 증가하는 것을 확인할 수 있다(Figure 1).
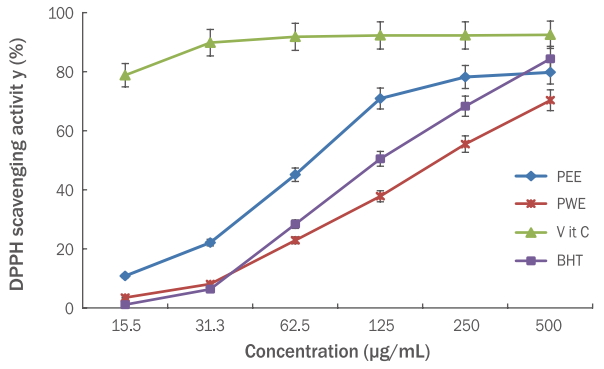
DPPH radical scavenging assay of the Persicaria thunbergii extracts.
DPPH radical scavenging assay was performed to investigate the anti-oxidant effects of PEE and PWE at the concentrations of 15.5, 31.3, 62.5, 125, 250, and 500 μg/mL. Vitamin C and BHT were used as positive controls. Results are presented as the mean±standard deviation for three independent experiments. DPPH, 2,2-diphenyl-1-picrylhydrazyl; PEE, Persicaria thunbergii 70% ethanol extract; PWE, Persicaria thunbergii water extract; BHT, butylated hydroxytoluene.
2) 총 폴리페놀 함량
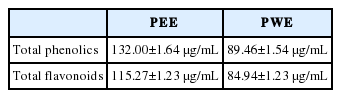
페놀성 화합물에 존재하는 phenolic hydroxyl (OH)기는 단백질과 결합하는 성질을 가지며 항산화, 항알러지 및 항균 등에 효과가 있으며 다양한 생리활성을 가지는 것으로 알려져 있으며, 총 폴리페놀 함량이 증가할수록 항산화 등의 생리활성이 증가하는 경향으로 보고되었다(Han et al., 2010). 고마리 추출물의 총 폴리페놀 함량은 tannic acid를 표준물질로 환산하여 분석한 결과, 고마리 에탄올, 열수 추출물 1 mg/mL의 총 폴리페놀 함량은 132.0±1.64, 89.46±1.54 μg/mL으로 나타냈다(Table 1).
3) 총 플라보노이드 함량
고마리 추출물의 총 플라보노이드 함량은 naringin를 표준물질로 환산하여 분석한 결과, 고마리 에탄올, 열수 추출물 1 mg/mL의 총 플라보노이드의 함량은 115.27±1.23, 84.94±1.23 μg/mL으로 나타냈다(Table 1).
2. 고마리 추출물의 HaCaT 세포에 미치는 영향
1) 세포 생존율 측정
HaCaT 세포에서의 생존율에 미치는 영향을 알아 보기 위해 고마리 에탄올, 열수 추출물을 각각 5-200 μg/mL의 농도로 처리하고 MTT assay를 진행한 결과, 100 μg/mL 이하 농도범위에서 90% 이상의 생존율이 확인 되었으므로 고마리 추출물 모두 100 μg/mL 이하 범위 농도에서 세포 독성이 보이지 않았다. 따라서 고마리 추출물 5-100 μg/mL 농도에서 H2O2에 의한 HaCaT 세포의 보호 효과 측정 시 세포 사멸에 큰 영향을 주지 않는 것으로 분석되었다(Figure 2).
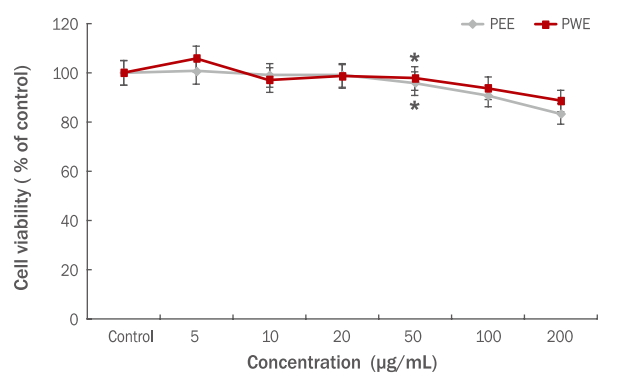
Effects of the Persicaria thunbergii extracts on the cell viability of HaCaT cells.
HaCaT cells were incubated with Persicaria thunbergii extracts (at 5, 10, 20, 50, 100, and 200 μg/mL) for 24 h, and cell viability was measured using MTT assay. Results are presented as the mean±standard deviation for three independent experiments. *p<0.05 compared with the untreated control group. PEE, Persicaria thunbergii 70% ethanol extract; PWE, Persicaria thunbergii water extract; MTT, thiazolyl blue tetrazolium bromide.
2) 고마리 추출물의 세포 보호 측정
H2O2는 산화적 스트레스를 유발시키는 물질로서 in vitro 실험에서 독성 유발 물질로 이용된다. HaCaT 세포에 H2O2로 산화적 스트레스를 유발시켜 고마리 에탄올과 열수 추출물에 대한 세포 생존율을 측정한 결과는 Figure 3과 같다. 대조군의 세포 생존율을 100%로 보았을 때 H2O2로만 처리한 실험군은 50%의 세포생존율을 나타내었으며, 고마리 추출물의 농도가 높아 질수록 세포 생존율이 증가하는 것을 확인할 수 있다.
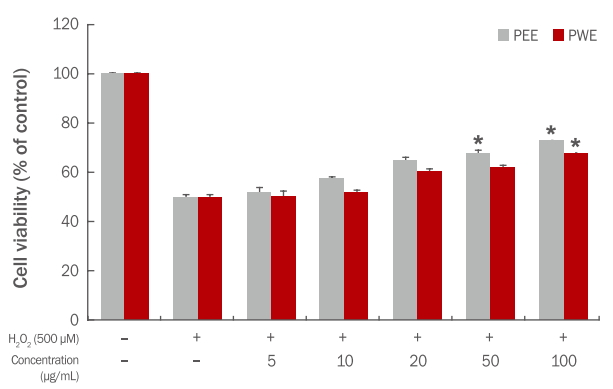
Protective effect of the Persicaria thunbergii extracts against oxidative stress induced by H2O2 in HaCaT cells.
HaCaT cells were incubated with Persicaria thunbergii extracts for 2 h followed by treatment with 500 μM H2O2 for 24 h. Cell viability was measured using MTT assay. Results are presented as the mean±standard deviation for three independent experiments. *p<0.05 compared with the control treated only with H2O2. PEE, Persicaria thunbergii 70% ethanol extract; PWE, Persicaria thunbergii water extract; H2O2, hydrogen peroxide; MTT, thiazolyl blue tetrazolium bromide.
고마리 에탄올 추출물의 경우 5-100 μg/mL의 농도에서 각각 51.70, 57.53, 65.14, 68.11, 73.15% 세포 생존율을 나타내어 100 μg/mL에서는 약 23%의 세포 보호 효과를 확인하였다. 열수 추출물에서도 50.22, 52.03, 60.40, 62.05, 68.10%의 생존율을 나타내어 100 μg/mL 농도에서 약 18% 세포 보호 효과를 확인하였다(Figure 3).
3. 고마리 추출물의 항알레르기 활성
1) RBL-2H3 세포 생존율 분석결과
비만세포는 천식, 비염, 아토피 피부염 등의 알레르기 질환 발생에 중요한 역할을 한다(Jung et al., 2013). Rat basophilic leukemia 세포주인 RBL-2H3 세포의 생존율에 고마리 에탄올과 열수 추출물이 미치는 영향을 알아보기 위하여 세포에 5-200 μg/mL 농도로 처리한 후 MTT assay를 실시하여 세포생존율을 측정하였다. 고마리 에탄올, 열수 추출물 모두 50 μg/mL 이하에서는 유의할만한 세포독성을 나타나지 않았다. 따라서 고마리 에탄올, 열수 추출물 5-50 μg/mL 농도에서 β-hexosaminidase 분비 측정 시 세포 사멸에 거의 영향이 없는 것으로 분석되었다(Figure 4).
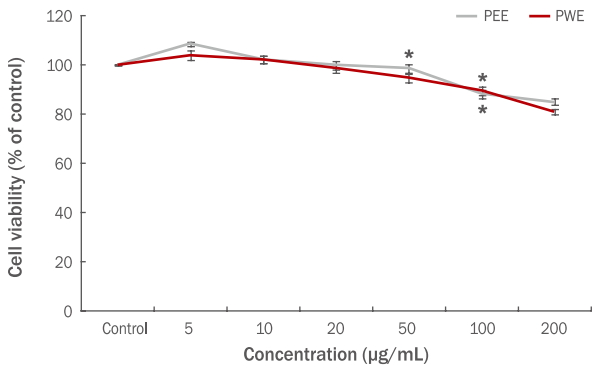
Effects of the Persicaria thunbergii extracts on the cell viability of RBL-2H3 cells.
RBL-2H3 cells were incubated with Persicaria thunbergii extracts (at 5, 10, 20, 50, 100, and 200 μg/mL) for 24 h, and cell viability was measured using MTT assay. Results are presented as the mean±standard deviation for three independent experiments. *p<0.05 compared with the untreated control group. PEE, Persicaria thunbergii 70% ethanol extract; PWE, Persicaria thunbergii water extract; MTT, thiazolyl blue tetrazolium bromide.
2) β-Hexosaminidase 분비에 미치는 영향
항원과 항체가 비만세포에 반응하여 세포 내에서 외부로 분비되는 히스타민(histamine), 프로스타글란딘(prostaglandin) 등의 과립 양을 측정하는 것은 항알레르기 효과를 확인하기에 적합한 방법이다(Hong et al., 2014).
본 연구에서는 세포외로 분비된 β-hexosaminidase 분비량을 측정하여 고마리 추출물의 항알레르기 효능을 확인하였다. 고마리 에탄올, 열수 추출물의 처리농도는 세포 생존율 측정결과에 따라 세포에 영향을 미치지 않는 농도인 5-50 μg/mL로 처리하였다. Anti-DNP IgE와 DNP-HSA에 의해 활성화된 RBL-2H3 세포에서 분비된 탈 과립의 양을 100%로 보았을 때 5, 10, 20, 50 μg/mL 농도 범위 내에서 고마리 추출물을 처리하였을 때 항원과 항체에 의해 활성화된 세포를 기준으로 에탄올 추출물이 80.21, 74.32, 70.45, 62.27, 열수 추출물은 85.27, 79.54, 76.21, 68.18%로 고마리 추출물의 농도가 높아질수록 β-hexosaminidase 방출에 대한 억제 효과를 가지는 것을 알 수 있었다. 특히 에탄올, 열수 추추물 농도가 20, 50 μg/mL일 때 β-hexosaminidase 방출에 대해 유의적으로 억제 효과를 나타냈다(Figure 5).
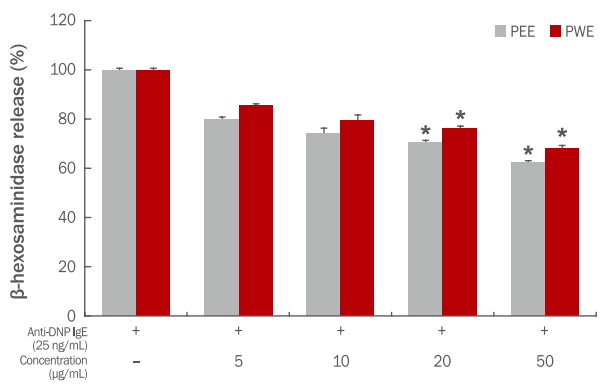
Inhibitory effects of Persicaria thunbergii extracts on the β-hexosaminidase release in IgE-antigen complex-stimulated RBL-2H3 cells.
IgE-antigen complex-stimulated RBL-2H3 cells were incubated with Persicaria thunbergii extracts at the concentrations of 5, 10, 20, and 50 μg/mL, and the inhibitory effect on β-hexosaminidase release was measured. Results are presented as the mean±standard deviation for three independent experiments. *p<0.05 compared with the untreated control group. PEE, Persicaria thunbergii 70% ethanol extract; PWE, Persicaria thunbergii water extract; Anti-DNP IgE, anti-dinitrophenyl immunoglobulin E.
4. 고마리 추출물의 항염 효과
1) Raw 264.7 세포 생존율 분석
고마리 추출물을 각각 5-200 μg/mL의 농도로 Raw 264.7 세포에 처리하여 MTT assay를 진행한 결과(Figure 6), 고마리 에탄올, 열수 추출물 모두 50 μg/mL 이하 농도범위에서 90% 이상의 생존율이 확인 되었으므로 고마리 추출물 모두 50 μg/mL 농도 범위에서 유의 할만한 세포독성을 보이지 않았다. 따라서 고마리 에탄올, 열수 추출물 5-50 μg/mL 농도에서는 항염증 측정 시 세포 사멸에 큰 영향을 주지 않은 것으로 분석되었다.

Effects of Persicaria thunbergii extracts on the cell viability of RAW 264.7 cells.
RAW 264.7 cells were incubated with Persicaria thunbergii extracts (at 5, 10, 20, 50, 100, and 200 μg/mL) for 24 h. Results are presented as the mean±standard deviation for three independent experiments. *p<0.05 compared with the control. PEE, Persicaria thunbergii 70% ethanol extract; PWE, Persicaria thunbergii water extract.
2) NO 생성억제능
최근 염증 유발에 중요한 역할을 하는 것으로 알려진 NO (Lee et al., 2006) 생성억제에 대한 고마리 추출물의 효과를 알아보기 위하여 RAW 264.7 세포에 LPS로 자극을 주고, 고마리 추출물을 처리하여 실험을 진행하였다. 생성된 NO 양은 griess 시약을 이용하여 세포 배양액 중에 존재하는 NO2-를 측정하여 확인하였다. 고마리 추출물의 처리 농도는 세포 생존율 측정결과에 따라 세포에 영향을 미치지 않는 농도인 5-50 μg/mL로 처리하였다. LPS (1 μg/mL) 처리 후 NO 생성량은 세포만 배양하였을 때 NO 생성량의 약 16배 이상 증가되었다. 고마리 에탄올 추출물은 각각 14.32, 12.37, 11.23, 7.25 μM로 NO 생성량이 측정되어 농도 의존적으로 NO 생성이 억제되는 것으로 나타났으며, 열수 추출물도 16.14, 14.56, 12.0, 10.80 μM로 측정되어 농도 의존적으로 NO 생성을 억제함으로 항염증 효과가 있음을 확인하였다. 특히 에탄올 추출물과 열수 추출물 모두 50 μg/mL 농도에서 유의적으로 NO 생성을 감소시키는 것으로 나타났다(Figure 7).
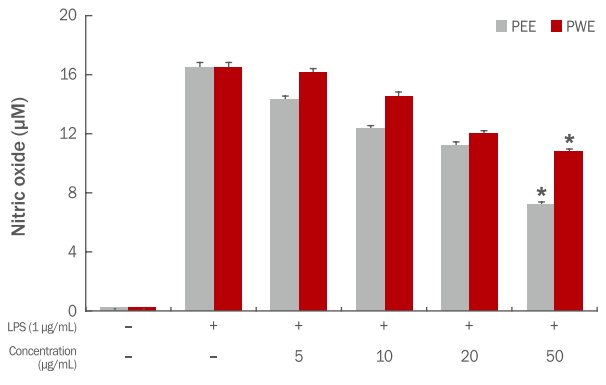
Effects of Persicaria thunbergii extracts on NO production in LPS-stimulated RAW 264.7 cells.
RAW 264.7 cells were treated with various concentrations of the Persicaria thunbergii extracts for 1 h and then stimulated with or without 1 μg/mL LPS for 24 h. The concentration of NO in the medium was determined using Griess reagent. Results are presented as the mean±standard deviation for three independent experiments. *p<0.05 compared with the untreated control group. PEE, Persicaria thunbergii 70% ethanol extract; PWE, Persicaria thunbergii water extract; LPS, lipopolysaccharide; NO, nitric oxide.
5. 항균력 분석
인간의 피부에 상주하는 다양한 균들에 의해서 많은 피부질환들이 발생하는데 그 중 가장 대표적인 질환으로는 지루성 피부염, 여드름 등을 꼽을 수 있다. 화장품은 물과 고분자성 지질로 구성되어 세균 및 진균에 탄소원과 질소원을 제공하는 미생물의 영양원으로 이용 될 수 있기 때문에 잘못 보관할 경우 미생물에 오염되기 쉽다(Ha & Cho, 2004). 또한 염증성 여드름의 치료에 주로 사용되는 항생제는 tetracycline, clindamycin, erythromycin 등이 있으나, 오랜 기간 항생제를 사용할 경우 내성이 생겨 치료효과가 떨어질 수 있다(Lee et al., 2012). 현재 지루성 피부염, 여드름에 사용되고 있는 합성 항균제와 과도한 항생제의 사용은 부작용과 안정성에 대한 문제를 야기시키고 피부에 알레르기를 유발할 수 있으므로 비교적 인체에 무해한 물질로 대체하기 위해 많은 연구들이 진행 중이다(Han et al., 2013).
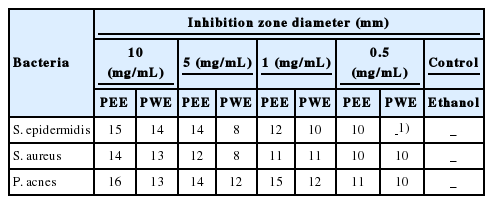
본 실험에 사용된 피부염을 일으키는 그람양성균인 S. aureus, S. epidermidis, P. acnes 에 대해 고마리 에탄올, 열수 추출물의 항균 효과는 paper disc 방법으로 측정하였으며 그 결과는 Table 2에 나타내었다. 고마리 에탄올, 열수 추출물을 농도별로 처리한 결과, S. aureus 에서 10 mg/mL 최대농도에서 각각 14, 13 mm의 clear zone을 형성하였으며, S. epidermidis에서도 10 mg/mL 최대농도에서 각각 15, 14 mm clear zone을 형성하여 높은 항균 활성을 나타내었다. P. acnes 에서도 10 mg/mL 최대 농도에서 각각 16, 13 mm로 농도 의존적으로 clear zone을 형성하여 항균 활성을 확인하였다. 이와 같이 고마리 추출물은 여드름, 아토피, 지루성 피부염과 관련된 균에서 생성 억제가 확인됨에 따라 염증 인자를 억제하는 세포 활성에 기여할 수 있을 것으로 본다.
Conclusion
본 연구는 고마리를 70% 에탄올 및 열수로 추출하여, 추출물의 항산화 효과로 총 폴리페놀과 플라보노이드 함량을 측정하였으며, DPPH radical 소거 활성을 측정하였다. H2O2에 의해 유발되는 산화적 스트레스에 대한 HaCaT 세포의 보호 효과, 항염효능을 분석하였고, β-hexosaminidase의 억제량을 측정하여 항알레르기 효능을 확인하였다. 또한 항균 효능으로 S. aureus, S. epidermidis, P. acnes 균주들의 항균 활성 실험을 진행하였다.
고마리 에탄올, 열수 추출물의 총 폴리페놀과 플라보노이드 함량을 측정한 결과, 총 폴리페놀 함량은 각각 132.00±1.64, 89.46±1.03 μg/mL 이고, 총 플라보노이드 함량은 각각 115.27±1.23, 84.94±1.23 μg/mL로 나타났으며, DPPH radical 소거 활성에서도 에탄올, 열수 추출물이 500 μg/mL의 농도에서 각각 79.80, 70.33%의 소거능이 확인되었다. 고마리 추출물의 HaCaT 세포에 대한 영향을 분석하기 위해 세포 생존율 측정결과, 100 μg/mL 이하의 농도에서 90% 이상의 생존율이 확인되었으며, 500 μM H2O2로 산화적 스트레스를 유발시켜 고마리 에탄올, 열수 추출물에 대한 세포 생존율 측정결과, 농도 100 μg/mL에서 73.15, 68.10%로 세포 생존율이 확인되었으며, 모두 농도 의존적으로 HaCaT 세포에 대한 보호 효과가 확인되었다.
β-Hexosaminidase 분비량을 측정하여 고마리 추출물의 항알레르기 효능 확인결과, 에탄올 추출물은 50 μg/mL에서 62.27%, 열수 추출물은 68.18%으로 hexosaminidase 방출에 대한 억제효과가 확인 되었다
Raw 264.7 세포에 독성을 미치지 않은 50 μg/mL 이하의 농도로 NO 생성 억제효과 측정결과, 고마리 에탄올, 열수 추출물은 농도 의존적으로 NO 생성을 감소하는 것으로 나타났다. 또한 피부염을 일으키는 S. aureus, S. epidermidis, P. acnes 를 선별하여 paper disc 방법으로 항균 효능을 측정한 결과, P. acnes 균에서 가장 우수한 항균 활성이 확인되었다.
이상의 결과를 통해 고마리 추출물은 항알레르기 및 항염, 여드름, 피부염과 관련된 균에 대한 항균 효과가 우수하여 기능성 화장품 소재로서의 효능이 확인되었다. 따라서 고마리 추출물의 기능성 화장품 소재로서 활용을 제안하며 활용 가능성을 판단하기 위하여 임상적으로 동물, 인체실험을 통한 고마리 추출물의 효능 검증 연구가 체계적으로 진행되어야 할 것으로 사료된다.