Introduction
화장품의 경우 미생물이 이용할 수 있는 유・무기물을 다량 함유하고 있어 미생물 오염 가능성이 상존하며(Ku et al., 2013), 인간에 질병을 유발하는 등 큰 문제를 초래할 수 있다(Behravan et al., 2005). 실제 2005년에서 2008년 사이에 유럽지역에서 화장품 173 종류가 회수되었는데 그 중 대부분이 Pseudomonas aeruginosa에 오염되었고, 일부에서 Candida albicans (C. albicans), Staphylococcus aureus (S. aureus)와 Klebsiella pneumoniae (K. pneumoniae)이 검출되었다(Lundov & Zachariae, 2008). 또한 국내에서도 테스터 화장품에서 비병원성 Bacillus subtilis뿐만 아니라 인간에 병원성을 나타낼 수 있는 S. aureus, C. albicans, Micrococcus sp. 등의 미생물이 다수 검출되었다는 보고가 있다. 위와 같은 병원균 또는 기회적 병원균들은 패혈증, 전신감염, 만성기도 감염증, 각막염 등을 일으킬 수 있을 정도로 심각한 영향을 미칠 수 있다(Behravan et al., 2005).
피부에 염증을 유발하는 피부 상재 균주로는 대표적으로 그람 양성균은 S. aureus, S. epidermidis (S. epidermidis), Cutibacterium acnes (C. acnes)가 존재하며(Ku et al., 2013), 표재성 피부진균으로는 무좀과 백선증을 유발하는 C. albicans, Candida tropicalis, Trichophyton rubrum 등이 있다(Lee et al., 2006). S. aureus와 S. epidermidis는 피부나 환경 중에 존재하고 있는 병원성 세균으로, 주로 염증을 통해서 고름의 형성, 발진 등의 증상으로 감염을 나타내고 식중독이나, 여드름, 중이염 중의 난치성 질환을 유발하는 것으로 알려져 있(Kim et al., 2006; Sung et al., 2007). 또한 대표적 피부질환인 아토피성 피부염 환자의 90%가 피부에서 발견되고 있다(Winston & Shalita, 1991). C. acnes는 여드름의 주 원인 균으로 혐기성 세균이며 피부 안쪽 또는 피지선에 존재하고 청소년기에 호르몬 활동이 증가하여 피지선의 분비가 활발할 때 번창한다(Jang & Ahn, 2004). 표재성 진균증은 백선, 전풍, 칸디다증과 같이 피부의 각질층, 체모 및 손톱, 발톱과 같은 케라틴에 기생하여 번식함으로써 생기는 피부 병변을 말한다(Lee et al., 2006). T. rubrum과 C. albicans는 족부백선의 우점균으로 알려져 있으며, 이는 다른 백선균에 비해 사람과의 친화성이 높아 만성감염을 일으킨다고 알려져 있다(Ferrero-Miliani et al., 2007). 칸디다혈증의 대표적인 진균은 C. albicans로 알려져 있지만 최근에는 C. tropicalis, C. parapsilosis 등 다른 균주에 의한 감염증이 늘어나고 있다(Pfaller et al., 1998).
과다 분비된 피지에 의해 모낭벽 세포에 이상각화가 일어나 모낭구가 막히면 피지가 배출되지 못하고 정체하게 된다(Suh, 2010). 이에 피부는 항상성이 깨지고, 모공 내 미생물들이 성장하기 좋은 조건으로 조성됨으로써 혐기성균, 호기성 구균, 진균 등이 번식하게 된다(Brown & Shalita, 1998; Ahn et al., 2002).
여드름은 모낭-피지선에서 발생하는 피부질환으로, 피지선에서 피지 분비가 증가함에 따라 피지선의 모공이 좁아지거나 막혀서 피지가 배출되지 못함으로써 세균이 증식하여 염증이 생기는 것이다. 사춘기 나이에 분비되기 시작하는 안드로젠은 피지 분비를 촉진시키고, 표피의 과각화를 일으키며, 이로 인해 모낭이 막힘으로써 모낭 내부가 C. acnes를 비롯한 혐기성 세균이 잘 자랄 수 있는 환경이 된다(Harper, 2004; Thiboutot, 1997). 동시에 S. epidermidis와 같은 다른 세균들이 모낭 주위에서 여드름과 여드름 합병증을 일으키는데 역할을 한다(Nishijima et al., 2002).
여드름 유발균으로는 C. acnes가 있다. C. acne는 피지 과다 분비 부위에서 번식하면서 lipase를 분비하여 피지 성분의 중성지방을 유리지방산으로 변화시킨다. 이후 모낭 주위에 밀집된 백혈구가 모낭벽을 파괴하고 모낭 내용물이 진피 내로 유입되어 염증성 여드름을 야기하며(Kim et al., 2007a), 추후 오목흉터(potted scar)나 비대흉터(hypertrophicscar)와 같은 후유증을 동반하기도 한다(Brown & Shalita, 1998). C. acnes는 지방분해 효소와 화학주성인자를 분비하여 유리지방산을 만들고 백혈구가 모낭 주위에 모이게 하며, 이들이 모낭벽을 자극한 후 파괴하여 모낭 내용물이 진피 내로 유출됨으로써 염증반응이 일어난다. 그러나 여드름은 반드시 염증 반응을 수반하는 것이 아니며, 비염증성 여드름과 염증성 여드름으로 구분된다. 비염증성 여드름은 면포(comedo)와 같은 초기 여드름 상태로 반응매개인자로는 사이토카인 중 IL-1α만이 관여하는 것으로 알려져 있다. 반면에 염증성 여드름은 구진(papule), 농포(pustule), 결절(nodule)이 속하며, 사이토카인인 IL-1α, IL-8, TNF-α와 PGE2, NO 등 모든 반응 매개 인자가 관여하는 것으로 알려져 있다(Koreck et al., 2003).
현재 여드름 치료제로 쓰이고 있는 약재로는 retinoid, benzoyl peroxide, clindamcin, erythromycin, triclosan 등과 같은 화장품 응용이 부적합한 의료용 항생제나 화학 합성품들이 대부분이며, 이들은 피부자극, 간독성, 내성 발생 등의 부작용이 알려져 있다(Kang et al., 2009). 따라서 여드름 피부에 효과적이고 피부에 안전하며 부작용을 최소화할 수 있는 천연 항균 물질에 대한 관심이 급증하고 있는 추세이며, 많은 연구자들이 천연 유래 여드름 치료제를 개발하려고 노력 중이다(Choi et al., 2015).
타트체리(tart-cherry, sour cherry, dwarf cherry, Prunus cerasus)는 신양 앵두라고도 칭하며, 벚나무아속 벚나무속의 종으로, 유럽과 아시아 남서부에 자생한다. 양벚나무와 밀접한 관계가 있지만, 과실은 더 신맛을 내는 편이고, 신맛이 나는 과육은 식용이다. 타트체리(Prunus cerasus)의 색은 사람들이 생으로 먹는 체리보다 더 붉고 선명하다. 나무는 일반 스위트 체리보다는 더 작은 편으로 잔가지가 좀 있는 편이다. 2020년대에 들어 건강에 좋다고 알려져서 타트체리 착즙 주스와 같은 건강기능식품 및 관련 상품들이 현재 유행 중에 있다. 하지만 타트체리(Prunus cerasus)를 이용한 화장품 소재로서의 연구는 미흡한 실정이다.
따라서 본 연구에서는 식용(음료)으로 사용되어 온 타트체리(Prunus cerasus)를 대상으로 화장품 소재로써 가능성을 확인하고자 항산화 활성, 항염증 효능 및 항균 활성을 조사하였다. 항산화 활성으로는 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavanging activity를 조사하였고, 항염증 효능으로는 anti-inflammatory activity를 조사하였고, 피부상재균에 대한 항균 활성은 antimicrobial activity를 조사하여 피부상재균에 대한 항균 활성 및 항염증 효능을 검증하여 보고자 한다.
Methods
1. 시료 및 시약
본 연구에 사용한 타트체리(Prunus cerasus)은 시중에 건조된 제품을 구입하여 사용하였고, 타트체리 1,200 g에 증류수 2.4 L (w/v%)를 첨가하여 homogenization (DH. WHG02018; DAIHAN Scientific Co., Ltd., Korea)로 교반 하여 분쇄한 다음 18 h 정치하였다. 그 후 원심 분리(5,000 g×30 min)를 진행하였고 상층액은 감압 농축기(Rotary Evaporator, EYELA N-1000; EYELA, Japan)를 사용하여 농축한 다음, Waterman NO 2 (Adventec, Roshi Kaisha Ltd., Japan)로 여과하여 동결 건조를 진행하였으며, 이 후 시료를 tart-cherry water extracts (TCW)로 명명하였다. 18 h 정치한 후 원심 분리한 침전물 700 g에 1.4 L (w/v%)의 EtOH을 첨가하여 24 h 4℃ 저온에서 정치한 다음, 원심 분리와 농축 과정을 반복하여 진행하였고, 농축된 시료는 동결 건조한 후, 각 실험의 단계별로 사용하였으며 tart-cherry ethanol extracts (TCE)로 명명하여 사용하였다.
피부상재균에 대한 활성 측정에 사용된 균주는 한국생명공학연구원 생물자원센터(Korean Collection for Type cultures, KCTC)에서 분양 받아 사용하였고, gram positive bacteria strain으로는 B. subtilis PM125. M. luteus (KCTC 1056), S. aureus (KCTC 1916), S. epidermis (KCTC 1917)를 여드름 균은 Cutibacterium acnes (KCTC 3314)를 대상으로 항균 활성을 조사하였다. Gram negative bacteria strain으로는 Escherichia coli (E. coli) D31, Enterobacter aerogenes (E. aerogenes), Klebsiella pneumoniae (K. pneumonia), Pseudomonas aeruginosa (P. aeruginosa), Salmonella typhi (S. typhi), Vibrio parahaemolyticus (V. parahaemolyticus) 등이며, 항생제 내성균주로는 Methicillin Resistance S. aureus CCARM 3561, 3115 및 3089등을 항생제내성균주은행(Culture Collection of Antimicrobial Resistance Microbes, CCARM)에서 분양 받아 사용하였으며, anti-fungal activity로는 C. albicans를 대상으로 활성을 측정하였다.
2. 항산화 활성
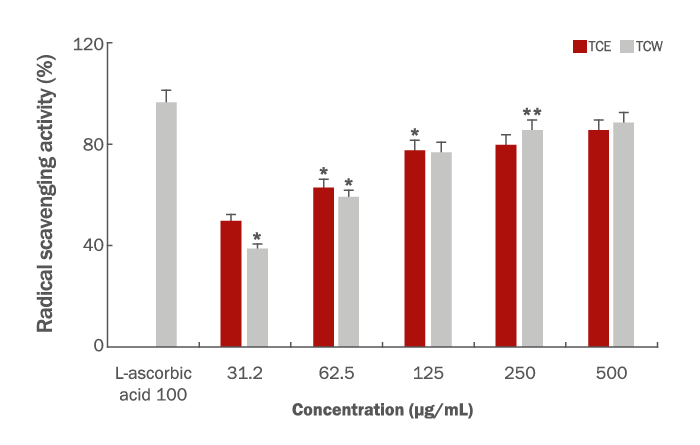
타트체리 추출물의 항산화 활성 측정은 DPPH 방법으로 radical 소거 능력을 측정하였다. 그 방법을 보면 EtOH에 용해한 0.2 mM DPPH 용액 150 μL와 농도 별 타트체리 추출물 50 μL를 96 well plate에 넣어 실온에서 15 min 반응시킨 후, ELISA Multiskan Reader (Thermo scientific, Finland)를 이용하여 517 nm에서 측정하였다. Radical 소거 활성(radical scavenging activity, RSA, %)은 시료 첨가군과 무 첨가군의 흡광도 감소율(Kim & Ko, 2020)로 나타내었고, 표준시료로는 L-ascorbic acid (Sigma-Aldrich)를 활성을 비교하였다(Bondet et al., 1997).
RAS (%)=[1-(Sample)/Control]Absorbance×100
3. 피부상재균에 대한 항균 활성 측정
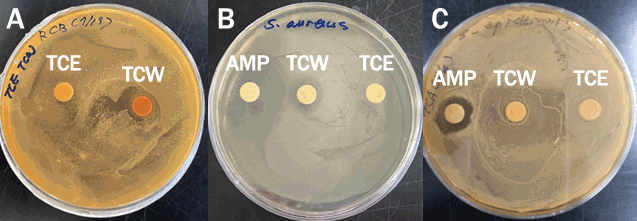
타트체리 추출물의 피부상재균에 대한 항균 활성은 변형시킨 Disk method (Lee et al., 2020)와 minimal inhibition concentrations (MIC) 방법으로 실험을 진행하였다. Disk method의 방법을 살펴보면 멸균한 Tryptic soy broth (TSB; Merck & Co. Inc., Germany) 배지에서 mid-logarithmic phase (OD570=0.1, 5×107 CFU/mL)의 농도로 배양 후, 멸균된 TSA 배지에 균 배양액 200 μL를 도말하였다. 이후, paper disc (직경 8 mm; Advantec No. 2, Toyo Roshi Kaisha Ltd., Japan)에 시료를 500 μg/disc의 농도로 disc에 100 μL씩 흡수시켜 용매를 충분히 건조한 다음 37℃ incubator에서 18 h 배양 후, disc 주변에 생성된 clear zone의 크기로 활성을 측정하였다 (Lehrer et al., 1991).
MIC 측정법은 broth dilution method를 사용하여 항균 활성을 증명하였다. 먼저 피부상재균 및 미생물들은 Muller-Hinton broth (Merck & Co. Inc., Darmstadt, Germany)에 mid-logarithmic phase (OD570=0.1, 1×105 CFU/mL)로 조절한 후, 96 well plate에 균 배양액 Muller-Hinton broth 100 μL와 농도 별로 희석한 시료 용액 100 μL를 차례대로 첨가하여 37℃ incubator 24 h 배양 후, ELISA Multiscan Reader (Thermo scientific, Finland)를 이용하여 570 nm에서 측정하였다(Kim et al., 2007b). 여드름 균주에 배양 배지는 RCM broth (Reinforced Clostridial Medium, Merk, Germany)를 사용하였으며, 3-5주 간격으로 계대 배양한 다음 사용하였고 실험 2주 전에는 3-5일 간격으로 broth 10 mL에 미생물 배양액 100 μL를 접종하여 활성도를 높였다. 혐기성 세균인 C. acnes는 배양 시 Gas Pak (Anaerocult®; Merk, Darmstadt, Germany)을 넣은 anaerobic jar에 넣어 37℃의 incubator에서 배양하였다(Collee et al., 1972).
Anti-fungal activity 측정은 liquid growth assay method로 측정하였으며, C. albicans KCTC 7965를 potato dextrose broth (PDB; Merck & Co. Inc., Germany)를 이용하여 30℃에서 48 h 배양하였다. Fungus의 농도는 mid-logarithmic phase (OD630=0.1, 1× 106 CFU/mL) 이 되도록 희석하여 96 well plate에 균배양액 100 μL와 타트체리 추출물 시료 100 μL 혼합한 후 30℃에서 48 h 배양 후, ELISA Multiscan Reader (Thermo scientific)를 이용하여 630 nm에서 측정하였다(Gibson et al., 1991). Positive control로는 ampicillin (Sigma-Aldrich)을 사용하여 비교하였다.
3. Anti-inflammatory activity
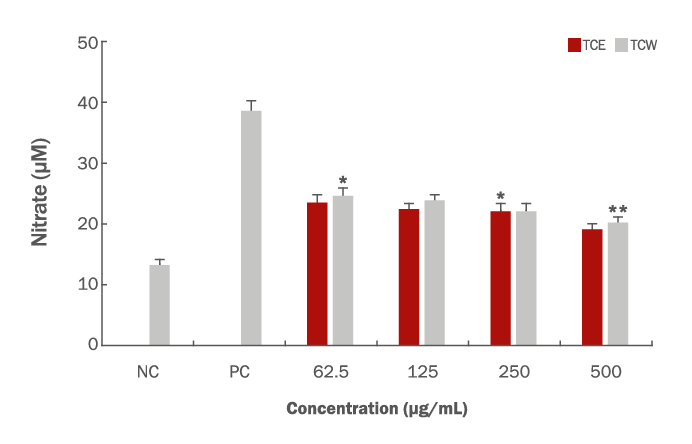
피부상재균에 대한 항균 활성과 더불어 타트체리 추출물의 anti-inflammatory activity을 확인하기 위하여 nitrate를 측정하였으며 nitric oxide (NO) 생성 저해 활성은 nitrite assay를 사용하여 측정하였다(Green et al., 1982). NO 합성의 indicator로 사용되는 NO2 농도는 LPS로 면역반응을 유도한 RAW264.7 Macrophage cell line을 이용하여 측정하였으며 cell의 농도 5×105 cells/well로 접종 후 24 h 배양한 다음 시료를 처리하여 24 h 동안 배양한 배양액을 측정에 사용하였다. 세포 배양액 내의 NO 활성은 Griess reagent (1% sulfonic acid, 0.1% N-1-naphthyl ethylenediamine dihydrochloride, 2.5% phosphoric acid)를 이용하였으며 세포 배양액 100 μL를 동량의 Griess reagent와 혼합하여 실온에서 10 min 반응시킨 후, 546 nm에서 ELISA Multiscan Reader (Thermo scientific)로 측정하였다. 모든 실험에서 fresh culture medium을 blank로 사용하였다.
4. 세포독성효과
타트체리 추출물의 안전성을 검토하기 위하여 RAW264.7 Macrophage cell line에 대한 세포 생존율을 조사하였다. RAW264.7 Macrophage cell line 한국 세포주은행에서 분양 받아 사용하였으며, 세포독성실험 방법(Kim & Kim, 2020)을 참고 및 변형하여 100 units/mL penicillin-streptomycin과 10% FBS가 함유된 Dulbecco's modified eagle medium (DMEM; Gibco, USA) 배지에서 37℃, 5% CO2 incubator로 배양하여 cell viability assay를 CCK-8 assay로 실험하였다(Chang et al., 2011). 먼저, 100 μL (1×105 cells/well)의 세포 부유액을 96 well plate에 분주 후, 5% CO2 incubator 안에서 24 h 동안 전 배양한 후, 농도별로 희석한 타트체리 추출물 시료를 10 μL 처리, 24 h 배양 후 CCK-8 용액 (Enzo Life Sciences, USA)을 첨가하여 2 h 배양한 다음 ELISA Multiscan Reader (Thermo scientific)을 이용하여 450 nm에서 흡광도 측정하였다.
Cell viability (%)=[(Exp.-Blank)/Control] Absorbance ×100%
Results and Discussion
1. Anti-oxidant activity
타트체리 추출물의 항산화 활성을 측정하기 위하여 일반적으로 많이 사용하는 DPPH method를 이용하였으며 이 방법은 비교적 간단하면서 대량으로 측정이 가능한 장점을 지니고 있다. 또한 이 물질은 radical을 갖는 물질 중 비교적 안정한 화합물로 EtOH 용액에서 purple color로 발색 되며 항산화성 물질이 DPPH radical을 소거시켜 탈색되는 원리를 이용하여 활성을 쉽고 간단히 측정할 수 있고 실제 항산화 활성과 연관성이 높은 방법이다(Lee & Lee, 2004). 타트체리 추출물의 DPPH method에 대한 항산화 활성은 강력한 L-ascorbic acid를 표준 시료로 100 μg/mL의 농도에서 96.3%의 활성과 비교하였으며 시료의 농도 31.25, 62.5, 125, 250 및 500 μg/mL에서 TCE는 49.6%, 62.9%, 77.8%, 79.7% 및 85.6%의 높은 활성을 나타내었고, TCW 또한 비슷한 형태의 활성을 보여주었다. 그 결과는 39%, 59%, 76.8%, 85.7% 및 88.4%의 농도의존적으로 활성을 나타내었다(Figure 1). 약용식물 및 천연물이 가지는 2차 대사산물 중 생리활성을 나타내는 물질은 방향성 물질과 항산화 활성 관련 물질이 많으며 미생물에 대한 항균 물질로는 alkaloid, terpenoid, phenol 화합물 등과 같은 2차 대사산물 또는 그 유도체로 알려져 있다 특히, 식물체 내의 phenol 화합물의 hydroxy group는 free radical에게 수소 원자나 전자를 공여하는 환원력이 있어 세포의 산화적 손상을 보호하여 질병을 예방 치료하는 것으로 알려져 있다(Tabanca et al., 2001). 이러한 결과로 타트체리 추출물의 높은 항산화 활성이 피부상재균에 대한 항균 활성에 높은 기대감을 가지며 여드름 및 문제성 피부에 대한 화장품 소재로서의 가치를 확인할 수 있었다.
2. Antimicrobial activity
타트체리 추출물의 피부상재균에 대한 항균 활성은 Disk method를 이용하여 clear zone의 크기(mm)로 결과를 나타내었다(Figure 2). 먼저 여드름 균주인 C. acnes에 대한 활성은 TCW가 18 mm로 나타났고, TCE는 활성을 나타내지 않았다. Positive control인 ampicillin (Sigma-Aldrich)은 활성이 다른 시료에 영향을 미쳐 정확한 활성 측정이 어려워 배제하여 TCW와 TCE만 측정하였다(dada not shown). S. aureus에 대한 활성은 TCW가 16 mm로 나타났고, TCE는 TCW만큼 명확하지 않으나 18 mm의 경미한 clear zone을 나타내었으며, positive control인 ampicillin (Sigma-Aldrich)은 39 mm의 clear zone을 나타내었다. 피부상재균인 S. aureus는 전세계적으로 식중독의 원인이 되며 저항성이 강하여 공기, 토양 등의 자연에 광범위하게 분포하며 건강한 사람과 동물의 피부에도 상존하여 있는 미생물로서 특히, Staphylococcal enterotoxin이 병을 일으키는 원인이 된다(Suk & Park, 1985; Kim et al., 1989c). 또 다른 피부 상재균인 S. epidermis에 대한 활성은 ampicillin이 24 mm의 활성을 나타내었고, TCW는 20 mm의 경미한 clear zone을 나타내었으며, TCE는 활성을 나타내지 않았다. S. epidermidis는 피부의 적당한 pH를 유지하여 외부의 세균을 방어하고, 특히 원발성 피부질환 및 여드름 증상을 악화시키며 혈구 응집 능력과 식균작용을 억제하며 면역시스템을 파괴시키는 원인 균으로 보고되어 있다(Peter & Smith, 1977; Feibleman & Rasmussen, 1980; Sohn et al., 2006). 피부상재균에 대한 항균 활성은 여드름의 주요 발생 균주인 C. acnes에 대한 활성이 가장 크게 나타내었다.
타트체리 추출물의 미생물 최소 억제 농도(minimal inhibitory concentration, MIC)를 확인하여 positive control인 ampicillin과 비교하여 Table 1에 나타내었다. 먼저 gram positive bacteria에 대한 활성이 gram negative bacteria보다 크게 나타났으며, TCE와 TCW 활성을 나타내는 농도는 같았지만 Staphylococcus sp. 인 경우 TCE가 250 μg/mL의 농도에서 활성을 나타내었고, 열수 추출물인 TCW는 125 μg/mL에서 활성을 보여주었다. 여드름 유발 균주인 C. acnes에서 62.5 μg/mL의 농도에서 활성을 나타내어 Disk method와 비교하여 같은 결과를 도출할 수 있었다.
황색포도상구균인 S. aureus는 다양한 피부 질환에 이차적으로 발생하여 피부나 연부조직에 감염을 잘 일으키며 아토피 피부염 환자에 감염되는 경우가 흔하며 세균성 피부 질환의 원인세균으로 보고되어 있다(Anne & Jonathan, 2003). 특히, 항생제 내성 균주인 Methicillin Resistance Staphylococcus aureus (MRSA) stains에서 세균성 피부 질환 77%가 발견되어 본 연구에서는 MRSA에 대한 활성을 조사하여 보고하고자 한다. 그 활성을 살펴보면 MRSA CCARM 3089에서 250 μg/mL, MRSA CCARM 3115와 MRSA CCARM 3561 두 균주는 >500 μg/mL으로 활성을 확인하였다. 이러한 결과로 타트체리 추출물은 항생제 내성 균주보다 피부상재균에 대한 항균 활성이 크게 나타내었으며 C. acnes에 대하여 세균의 증식을 억제하는 경향이 가장 크게 나타내었고 향후, 여드름 증상 개선하는 화장품 원료로서 충분한 가능성을 확인할 수 있었다. Gram negative bacteria에 대한 활성은 200-500 μg/mL의 농도에서 활성을 나타내었다. E. coli D31와 Pseudomonas aeruginosa는 TCE, TCW 둘 다 250 μg/mL의 농도에서 억제하는 경향을 보였고, Enterobacter aerogenes, Klebsiella pneumoniae, Salmonella typhi, Vibrio parahaemolyticus 등은 500 μg/mL 농도에서 활성을 나타내었다. 타트체리 추출물은 gram negative bacteria보다 gram positive bacteria에서 조금 활성을 나타내는 것으로 판명되었고, 이러한 결과는 타트체리 추출물의 세균막과의 반응에 있어서 gram negative bacteria와 gram positive bacteria의 차이에 의한 상호작용으로 인해 활성의 차이를 보이며 향후, 이러한 항균 활성 메커니즘을 규명하기 위한 심도 있는 연구가 절실한 것으로 생각된다.
또한, C. albicans를 대상으로 anti-fungal activity를 측정하였으나 활성을 나타내지 않았다(Table 1).
3. Anti-inflammatory activity
염증은 신체를 방어하기 위한 면역반응으로 조직 손상에 대한 구조나 기능을 회복하고 세포내의 항상성을 유지하는 매우 중요한 시스템이다. 면역세포 중 하나인 Macrophage (대식세포)는 면역반응에서 NO, Prostaglandin E2 (PGE2), lysosomal enzyme, free radical 및 염증성 사이토카인과 같은 염증매개물질 생성에 관여하고 이를 조절한다(Ferrero-Miliani et al., 2007). NO는 NO synthase (NOS)에 의해 L-arginine이 산화되어 생성되며, NOS에는 neuronal NOS (nNOS), inducible NOS (iNOS), endothelial NOS (eNOS)가 있다. Constitutive NOS (cNOS)로 불리는 nNOS와 eNOS는 정상적인 체내 생리기능을 담당하는 반면, iNOS는 특정 자극에 의해 발현되며 이들 중 iNOS에 의한 NO 생성이 절대적으로 많다. 특히 대식세포가 LPS로 자극될 때 inducible nitric oxide synthase (iNOS)가 발현되어 많은 양의 NO를 생성하게 된다. LPS는 gram positive bacteria의 세포벽에 존재하는 당지질 화합물로서 Macrophage 표면의 receptor와 결합하여 iNOS, COX-2, 염증성 사이토카인 발현의 전사인자로서 중요한 역할을 하며 이렇게 생성된 NO는 활성산소(reactive oxygen species, ROS)와 결합하여, 과산화 질소 등의 또 다른 독성 유리기 물질을 만들어내고, 각 종 인체 질환을 악화시키는 원인이 된다(Suh, 2010; Gao et al., 2020). 타트체리 추출물의 면역조절 반응을 알아보기 위해 RAW264.7 cell을 대상으로 NO 측정을 확인하였고, LPS로 염증반응을 유도하여 항염증 반응을 확인하였다(Figure 3). 그 결과를 보면 시료를 처리하지 않은 비교군의 하나로 LPS 반응을 유도하지 않은 negative control은 13.3 μM, LPS로 염증 반응을 유도한 positive control로는 38.4 μM의 nitrate 생성양을 확인할 수 있었고, TCE와 TCW는 시료의 농도 62.5, 125, 250 및 500 μg/mL의 농도를 처리한 결과 23.4, 22.3, 22.1, 19 μM로 나타났으며, TCW의 경우 24.5, 23.7, 22.1 및 20.1 μM로 나타내었고 농도의존적으로 nitrate 생성을 저해하는 결과를 확인할 수 있었다.
4. Cell viability
타트체리 추출물의 NO 생성을 저해하는 것이 세포독성으로 인한 cell population의 저하에서 기인하는지 관찰하기 위해 CCK-8 assay kit를 사용하여 RAW264.7 cell을 대상으로 세포생존율을 측정하였다. 시료의 농도는 62.5, 125, 250 및 500 μg/mL의 농도별로 처리하여 시료를 처리하지 않은 대조군을 100%로 정의하여 나타내었다(Figure 4). 먼저 TCE의 경우 104%에서 91%의 세포생존율을 나타내었고 500 μg/mL의 농도에서 91%의 생존율을 확인할 수 있었다. TCW의 경우, 시료의 농도에 따라 각각 101, 98, 95 및 92%의 세포생존율을 보여주었고, 500 μg/mL의 농도에서는 92%로 세포의 독성을 나타내는 것으로 조사되었다. 위의 결과로 세포 독성에 의한 cell population의 저하에 의해 NO 생성 저하에 영향을 크게 미치는 않는 것으로, 이후 NO과 cell population에 관한 깊이 있는 연구가 필요할 것으로 판단된다.
Conclusion
본 연구는 식용(음료)으로 사용되어 온 타트체리(Prnus cerasus) 추출물을 대상으로 열수추출물(TCW)과 에탄올 추출물(TCE)의 항산화 활성, 항염증 효능과 더불어 gram negative & positive bacteria에 대한 항균 활성을 조사하여 화장품 소재로써 가능성을 확인하였다. 특히 피부상재균인 S. epidermis, S. aureus, C. acnes에 대한 활성을 확인할 수 있었고, 특히 여드름 유발 균주인 C. acnes에 대한 타트체리 열수 추출물(TCW)이 타트체리 에탄올(TCE) 추출물보다 강한 활성을 나타내었다. DPPH 방법으로 조사한 항산화 활성은 시료의 농도 500 μg/mL에서 TCE (85.6%), TCW (88.4%)의 높은 radical 소거 활성을 나타내었다. 피부상재균에 대한 항균 활성으로는 TCW가 C. acnes (18 mm), S. epidermis (16 mm) 및 S. aureus (20 mm)로 clear zone의 크기를 확인할 수 있었으며, TCE가 S. epidermis (18 mm)로 clear zone의 크기를 확인할 수 있었고, C. acnes, S. aureus에 대한 항진균 활성은 나타내지 않았다. 그리고 TCW와 TCE 모두 C. albicans에 대한 항진균 활성은 나타내지 않았다. RAW264.7 macrophage cell에 대한 세포 독성은 500 μg/mL의 농도에서 TCE (91%), TCW (92%)의 세포 생존율을 보였으며, NO를 측정한 결과 농도의존적으로 NO 생성을 저해하는 것으로 조사되었다.
위의 결과를 바탕으로 타트체리(Prnus cerasus) 추출물은 항산화 활성에 탁월한 효능을 보여주었고, 화장품 소재 및 바이오 제품 원료로서의 가능성을 확인할 수 있었다.