Introduction
피부노화의 대표적인 원인인 외인성 노화는 자외선(Ultraviolet, UV)에 의한 노화라고 할 수 있다(Chung et al., 2002; Gilchrest, 1996). 자외선은 200-400 nm 파장대의 빛으로 태양에서 오는 광선의 약 5%를 차지할 정도로 적은 양이지만 적외선이나 가시광선과는 달리 피부노화에 직접적인 영향을 미친다고 알려져 있다(Gonzalez et al., 2008). 자외선은 파장대에 따라 UVA (320-400 nm), UVB (290-320 nm), 그리고 UVC (200-290 nm)로 구분된다(Matts, 2006). 오존층에서 대부분의 UVC는 흡수가 되고, 실제 지구 표면에 도달하여 피부노화에 영향을 미치는 자외선은 UVA와 UVB이다. 많은 양의 자외선에 노출되거나 적은 양이라도 장기간 빈번하게 자외선을 받게 되면 색소침착, 홍반 등의 피부질환과 깊은 주름이 생기거나 피부가 거칠어지는 피부노화가 유발된다(Bickers et al., 2006).
피부색은 혈관 속에 함유된 혈액 내 헤모글로빈과 표피에 존재하는 멜라닌 색소(melanin), 피하조직에 분포하는 β-카로틴 등에 의해 결정된다. 그 중에서도 멜라닌 색소의 분포와 양에 의해 외관상의 피부색이 주로 결정된다. 멜라닌은 자외선을 받은 멜라닌형성세포(melanocyte)의 멜라닌합성반응 과정(melanogenesis)을 통해 생성되고, 피부색을 어둡게 변화시켜 자외선으로부터 피부를 보호하는 기능을 한다. 멜라닌에는 적갈색의 수용성 중합체인 피오멜라닌(pheomelanin)과 흑색의 불용성 중합체인 유멜라닌(eumelanin)으로 구성되어 있다(Yoon et al., 2013). 멜라닌합성은 L-tyrosine이라는 아미노산을 기질로 하여 tyrosinase (TYR)를 주효소로 하고 tyrosinase related protein-1 (TYRP1), TYRP2에 의해 3,4-dihydroxyphenylalanine (L-DOPA)를 거쳐 DOPA quinone으로 산화된 후 복잡한 기전을 거쳐 최종적으로 피오멜라닌과 유멜라닌이 만들어 진다. 이 중 TYR 효소는 멜라닌 생성반응을 조절하는 핵심 효소로, 대표적인 미백 소재인 코직산, 알부틴(arbutin), 닥나무추출물, 감초추출물 등은 TYR 효소의 활성 억제를 타겟으로 하고 있다(Baek et al., 2009; Kim et al., 2005). 특별히 알부틴은 멜라닌의 전구체인 L-tyrosine과 경쟁적으로 작용하여 TYR 효소의 활성을 저해하는 역할을 하며, 코직산은 tyrosinase의 활성부위에 결합하는 구리 2가이온(Cu2+)를 chelating하여 멜라닌의 전구물질인 L-DOPA와 DOPA quinone이 생성되는 것을 억제한다고 알려져 있다. 알부틴과 코직산은 강력한 미백효능이 있지만 피부자극과 같은 안전성 문제 등의 일부 부작용이 있어 천연유래 신소재 개발 등 신규 효능물질 발굴에 많은 연구가 진행되고 있다(Han et al., 2014; Kim et al., 2015).
브라질린(Brazilin; 7, 11b-dihydrobenz[b]indeno[1,2-d] pyran-3,6a,9,10 (6H)-tetrol)은 말레이시아, 인도, 중국 남부지역 등의 열대 아시아에 분포하는 콩과 식물인 소목(Caesalpinia sappan L.)의 지표물질로 알려져 있다. 브라질린은 천연색소, 식품 첨가물 또는 산 및 알칼리 지시약 등으로 널리 사용되어져 왔다(Puchtler et al., 1986). 최근의 연구결과에서는 고혈압, 향균작용, 월경폐색, 어혈에 의한 타박손상, 혈당저하, 항산화, 항염작용, 항노화 등의 다양한 생리학적 효능이 보고된 바 있다(Moon et al., 1992; Hwang et al., 1998; Bae et al., 2005; Shim, 2016; Hwang et al., 2018; Shim, 2019).
브라질린이 피부미백 개선에 효능이 있는지에 대한 연구는 전무한 실정이다. 본 연구에서는 브라질린의 미백 효능과 관련되어 B16F10 세포의 표지인자인 TYRP1과 TYRP2, TYR, MITF 등의 유전자 발현에 미치는 영향을 확인해 보고, α-melanocyte stimulating hormone (α-MSH)에 의해 증가된 멜라닌의 생산량이 브라질린에 의해 감소되는지 입증하고자 한다. 이를 통해 브라질린의 향후 미백 화장품 및 바이오 소재로서의 가능성을 제시하고자 한다
Materials and Methods
1. 실험재료 및 세포배양
마우스 유래 흑색종 세포인 B16F10 세포주는 한국세포주은행(Korean Cell Line Bank, Korea)에서 구매하여 사용하였으며, 세포배양을 위해 Dulbecco’s modified Eagle’s medium (DMEM, Welgene, Korea)에 10%의 fetal bovine serum (FBS, Equitech-Bio, USA)와 1%의 penicillin/streptomycin (Thermo Fisher Scientific, USA)을 첨가하여 5% CO2, 37℃, 100% 인큐베이터에서 배양하였다.
2. 세포 생존율 측정
세포 생존율은 CCK-8 (cell counting kit-8, Abbkine, China) 분석법을 이용하였다. B16F10 세포를 조직배양접시에 접종한 후 브라질린(ChemFaces, China)을 농도 별로 희석하여 처리하였다. 브라질린을 농도 별로 처리한 B16F10 세포를 24 h 배양한 후 CCK-8 시약을 첨가하여 1 h 동안 5% CO2, 37℃ 인큐베이터에서 배양하였다. 450 nm에서 흡광도를 측정하기 위해 ELISA reader (BioTek, USA)를 사용하였으며, 세포를 첨가하지 않은 배지만 넣은 대조군의 흡광도를 기준으로 세포 생존율을 산출하였다.
3. Mushroom tyrosinase activity 측정
Mushroom Tyrosinase (EC 1.14.18.1, Sigma, USA)의 농도가 276 units/mL가 되도록 1/15M phosphate buffer (pH 6.8)에 녹여 냉동실에 동결 보관하고, 사용 시 빙상에서 녹여 사용하였다. tyrosine (Sigma)은 차광 병에서 deionized water (Sigma)에 녹여서 사용하였으며, 본 용액은 사용 직전에 제작하여 사용하였다.
Mushroom tyrosinase (13.8 units/ml) 150 μL, 1/15M phosphate buffer를 넣은 후, 상온에서 5 min간 pre-incubation시켰다. 여기에 tyrosine을 넣은 후 5 min간 반응시킨 후 475nm에서 흡광도를 측정하였다. 각 실험군은 모두 독립적으로 3번 반복 실험하였고, 아래의 수식으로 소재의 효소 저해율(%)을 산출하였다.
저해율 =[1-(시료첨가군의 흡광도/무첨가군의 흡광도)]×100
4. RNA 추출 및 실시간 유전자 중합효소 연쇄반응(real-time RT-PCR)
Thermo Fisher Scientific사의 TRIzol Reagent (USA)를 사용하여 total RNA를 추출하였다. 추출한 total RNA로부터 cDNA의 합성은 TOPscript one step RT-PCR kit (Enzynomics, Korea)를 사용하여 합성하였으며, B16F10 세포의 표지인자의 발현을 비교 측정하기 위하여 StepOnePlus realtime PCR machine (Applied Biosystems, USA)을 사용하여 real-time RT-PCR을 진행하였다. 실험에 사용된 특정 Taqman Gene expression assay®는 Table 1에 표기하였다.
5. Melanin 생성량 측정
Melanin 생성량 측정은 Hosoi의 방법을 일부 변경하여 사용하였다(Hosoi et al., 1985). B16F10 세포를 24 well plate에 1×105 cells/well 농도로 접종하였다. 24 h동안 안정화 시킨 후에 α-MSH (200 nM, Sigma)와 브라질린을 농도 별로 처리하였다. 72 h 배양 후 배지를 제거한 다음 phosphate-buffered saline (PBS, Welgene)로 3차례 washing 한 후, 1 N NaOH (Sigma) 용액을 100 μL를 첨가하여 60℃에서 2 h 동안 melanin을 용해시킨 후에 405 nm의 파장에서 흡광도를 측정하였다. 양성대조군은 100 μg/mL의 arbutin (Sigma)을 사용하였다. Melanin 생성 억제는 α-MSH 처리군에 대한 생성량을 퍼센트로 표시하여 평균치로 나타내었다. 실험은 독립적으로 3번 반복하였다
Results & Discussion
1. 브라질린 농도별 B16F10 세포의 생존율 분석
B16F10 세포에 대한 브라질린의 세포독성을 확인하기 위하여 CCK-8 assay를 실시하였다. 대조군은 시료를 처리하지 않았고 브라질린은 0.1, 1, 10, 100, 1000 ng/mL, 10, 100 μg/mL의 농도로 처리하여 세포생존율을 측정하였다(Figure 1). 10 μg/mL 이상의 농도를 처리할 때 B16F10 세포의 생존율이 유의성있게 감소하였다. 1000 ng/mL의 농도 이하로 처리시에는 B16F10 세포의 생존율이 대조군과 비교하여 유사함을 확인하여 본 실험에서는 10, 100, 1000 ng/mL의 브라질린을 처리하여 미백 효능 실험을 진행하였다.
2. 브라질린에 의한 Tyrosinase 효소 저해 활성 효과
Tyrosinase 효소는 아미노산인 L-tyrosine을 기질로 하여 L-DOPA를 생성하고, L-DOPA는 tyrosinase 효소에 의하여 dopaquinone을 걸쳐 최종적으로 멜라닌이 형성된다. Tyrosinase 효소는 멜라닌합성반응을 조절하는 효소로, 대표적인 미백 화장품 원료인 알부틴, kojic acid, 감초추출물, 닥나무추출물 등은 tyrosinase 활성을 억제하는 소재로 개발되어 사용되고 있다(Baek et al., 2009; Kim et al., 2005). 본 실험에서 브라질린의 tyrosinase 효소 저해 활성을 평가하기 위하여 kojic acid를 양성대조군으로 사용하고 브라질린을 각각 10, 100, 1000 ng/mL의 농도로 처리하여 tyrosinase 효소 활성을 측정한 결과, 브라질린의 농도의존적으로 tyrosinase 효소의 활성을 저해함을 확인할 수 있었다(Figure 2). 브라질린 100, 1000 ng/mL에서 각각 22.9, 59.9%의 tyrosinase 저해 효능을 나타내어 우수한 미백효과가 있음을 확인하였다.
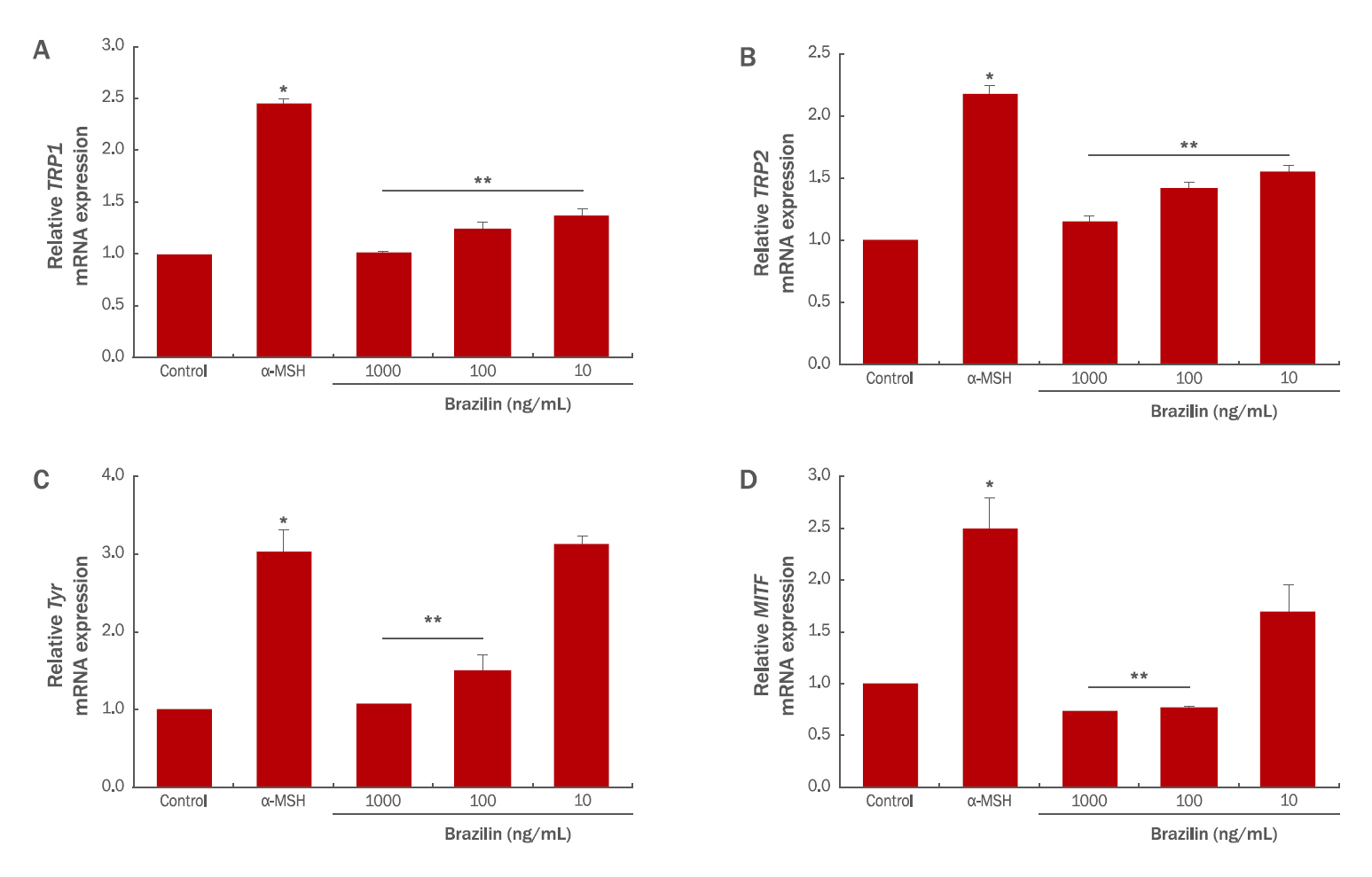
3. α-MSH와 브라질린 처리에 따른 B16F10 세포의 mRNA 발현
자외선은 직접적으로 멜라닌형성세포를 자극하여 멜라닌을 합성하지 않고, 여러 단계의 신호전달을 거쳐 멜라닌을 생성하게 한다. 자외선은 표피층에 존재하는 각질형성세포를 자극하여 멜라닌형성세포 자극 호르몬인 α-melanocyte stimulating hormone (α-MSH)의 생성을 유발하여, 각질형성세포 외부로 분비시키고, 분비된 α-MSH는 멜라닌형성세포의 수용체인 melanocortin 1 receptor (MC1R)에 결합하여 멜라닌 합성에 관련된 신호전달을 통해 멜라닌 생성을 유발한다(Yoon et al., 2013). 본 실험에서는 B16F10 세포의 멜라닌 생성을 유발하기 위하여 200 nM의 α-MSH를 처리하여 B16F10 세포의 흑화를 유도하였다. 또한 브라질린을 처리하여 B16F10 세포가 α-MSH 처리에 의해 발현하는 표지인자인 TRP1, TRP2, TYR, MITF의 발현양을 실시간 유전자 중합효소 연쇄반응을 통하여 확인하였다. α-MSH 처리에 의해 B16F10 세포는 TRP1, TRP2, TYR, MITF과 같은 멜라닌형성세포의 표지인자의 발현이 증가한다. B16F10 세포에 브라질린을 처리하고 실시간 유전자 중합효소 연쇄반응을 통하여 표지인자 발현을 확인한 결과, α-MSH 처리군 대비 1000 ng/mL의 브라질린을 처리한 실험군에서 TRP1, TRP2, TYR, MITF의 발현이 각각 59, 47, 65, 71% 감소하는 효과를 보였다(Figure 3).
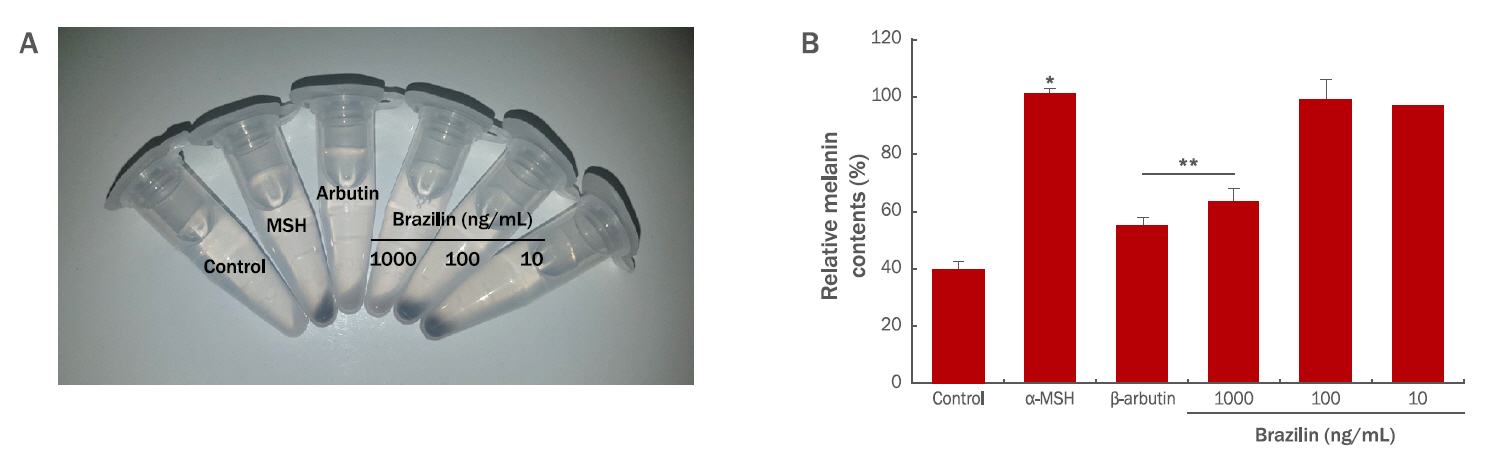
4. 브라질린의 멜라닌 생성률 저하 효과
브라질린을 처리하여 멜라닌형성에 필수적인 표지인자의 mRNA 발현량이 감소됨을 확인한 이후, B16F10 세포에서 멜라닌 생성이 감소되는지를 알아보기 위해 멜라닌 생성률을 확인하였다(Figure 4). 브라질린을 각각 10, 100, 1000 ng/mL 농도로 처리한 B16F10 세포를 수획하여 멜라닌의 양을 측정한 결과, 멜라닌의 생성이 농도 의존적으로 저해됨을 확인하였다. 브라질린을 1000 ng/mL 처리할 때 멜라닌의 생성률이 대조군 대비 감소함을 확인할 수 있었다(Figure 4A). 또한 육안으로 확인한 결과를 수치화하여 확인한 결과, 브라질린을 1000 ng/mL 처리할 때 멜라닌의 생성률이 37% 감소하여 대조군 대비 유의성 있게 감소하였다(Figure 4B). 이 결과는 멜라닌 생성에 필수적인 표지인자의 mRNA 발현량에 대한 실시간 유전자 중합효소 연쇄반응의 실험결과와 동일한 경향성을 지니며, 브라질린은 mRNA의 발현에 영향을 미칠 뿐 아니라 멜라닌 생성에서도 일관성있는 미백 효능을 지닌다고 볼 수 있다.
항산화제, 특별히 ascorbic acid는 활성산소종을 제거하는 능력이 있어 eumelanin 생성과정에서의 중간산물인 DOPA quinone을 L-DOPA로 환원시켜 멜라닌 합성을 저해하는 중요한 미백소재로 알려져 있다(Tomita & Seiji, 1977; Panzella et al., 2018). 브라질린 역시 항산화효과가 있다고 보고되었으며 또한 섬유아세포에서 항산화효소인 SOD3의 발현을 특이적으로 증가시킨다고 알려져 있다(Shim et al., 2018). 이러한 항산화효능에 의해 브라질린이 미백에 효과가 있음이 본 실험결과에서도 나타난 것으로 보여진다. 추후 브라질린에 의해 멜라닌형성세포에서의 항산화 효과 및 SOD1, SOD2, SOD3, Catalase와 같은 항산화효소의 발현양상 등에 대한 추가적인 연구도 진행되어야 할 것으로 사료된다.
Conclusion
일상생활에서 접하는 자외선은 살균작용, 비타민 D 합성 등의 유익한 기능이 있으나, 또 다른 측면에서는 주름생성, 탄력저하, 색소침착, 피부홍반, 염증 등의 증상을 유발하고, 활성산소종의 연쇄 반응을 통해 노화가 진행된다(Talwar et al., 1995; Kim et al., 2011). 또한 자외선과 같은 환경적 요인에 의한 노화는 성체 내 존재하는 구성세포의 감소, 혹은 기능저하에 의해 정상적인 기능을 하는 조직으로의 재생, 기능을 하지 못하게 된다(Jones et al., 2011; Kirkwood, 2005).
본 연구를 통해 브라질린을 B16F10 세포에 처리할 적절한 농도를 확인할 수 있었다. 1000 ng/mL의 농도에서는 세포의 생존율에 영향을 미치지 않음을 Figure 1에서 확인하였다. Tyrosinase 효소의 활성억제효능 측정결과에서 100, 1000 ng/mL 농도의 브라질린이 tyrosinase 효소의 활성을 유의성있게 감소시킬 수 있음을 확인하였다(Figure 2). TRP1, TRP2, TYR 과 MITF의 유전자 발현 측정에서 브라질린이 α-MSH에 의해 증가된 표지인자 발현을 유의성 있게 감소시키는 결과를 나타내었다(Figure 3). 추가적으로 브라질린이 B16F10 세포에서 멜라닌의 생성을 감소시킴을 확인하였다(Figure 4). 이러한 결과를 바탕으로 브라질린이 새로운 미백효능 후보물질로서의 가능성을 보여준다.
브라질린의 미백 효과를 확인한 결과는 본 연구가 최초로, 추후 피부미용에 실질적으로 응용이 될 수 있고, 피부 노화를 예방할 수 있는 가능성을 제시한 결과라고 사료된다. 추가적으로 브라질린이 B16F10 세포에서 어떠한 신호전달 기전으로 미백에 영향을 미치는지에 대해 추가연구와 심도있는 임상연구가 필요할 것으로 보인다.