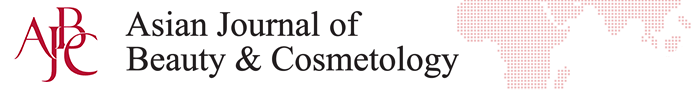Introduction
피부는 신체의 외부 표면을 둘러싸고 있는 가장 큰 기관으로 외부 환경으로부터 신체 내부를 보호하는 장벽으로 체온조절, 수분손실과 미생물에 대한 감염으로부터 신체를 보호하는 다양한 기능을 가지고 있다(Rittié & Fisher, 2002; Zhang & Duan, 2018). 구조적으로 피부는 표피(epidermis), 진피(dermis) 그리고 피하지방(subcutaneous fat)으로 구성되어 있으며 표피를 구성하는 세포는 각질형성세포(keratinocyte)로 이루어져 있으며 그 외에 멜라닌세포(melanocyte), 랑게르한스세포(langerhan cell) 및 머켈세포(merkel cell)로 이루어져 있다. 피부의 노화는 크게 내인성 노화와 외인성 노화(광노화)로 나눌 수 있으며 내인성 노화의 임상적 특징은 비교적 경미하며, 잔주름, 피부건조증, 탄력감소 등을 들 수 있다(KFDA 2019a). 그러나 자외선과 같이 외부 환경에 의한 외인성 피부노화는 내인성 노화에 비하여 굵고 깊은 주름과 잔주름이 발생하며, 심한 경우 피부건조증, 탄력감소, 색소성 질환, 양성종양, 피부암 등을 증가시킨다(KFDA, 2019a). 특히 자외선 B (UVB, 290-320 nm)는 matrix maetalloproteinase (MMPs)의 생성을 유도하고, 피부각질세포 내 DNA 손상과 조직의 산화적 스트레스를 유발하는 광노화의 주요 원인이다(Ma et al., 2003; Kalbina & Strid, 2006; Ryu et al., 2019). 노화된 피부에서 가장 대표적으로 나타나는 변화는 콜라겐(collagen) 섬유의 양적 구조적 변화이다(Fisher et al., 1997; Quan & Fisher, 2015). 콜라겐 분해의 증가와 생합성 감소가 동시에 일어나게 되면 콜라겐의 항상성에 이상이 야기되고 결국 콜라겐의 감소가 유발되고 이러한 변화는 피부주름과 탄력 감소를 초래한다고 한다(Varani et al., 2000). Matrix metalloproteinase (MMPs) 효소는 세포외기질(extracellular matrix) 단백질을 분해할 수 있는 기능을 가지며 특히 MMP-1은 collagenase 1으로 알려져 있으며, typeⅠ와 Ⅲ collagen을 기질로 한다. MMP-3는 stromelysin 1이라고도 하며, 기저막의 type collagen을 분해하며 zymogen인 proMMP-1을 활성화시킨다 (Brennan et al., 2003; KFDA, 2019a; Lee & Park, 2019).
로열젤리(royal jelly)는 5-15일령의 어린 일벌이 꽃가루와 꿀을 먹고 머리에 있는 인두선(hypopharyngeal gland)에서 분비하는 양봉산물로 유충과 여왕벌의 먹이로 사용되는데 여왕벌에는 전유충 기간과 성장 후에도 급여되고, 일벌과 수벌의 유충은 부화 후 3일간만 급여된다. 로열젤리는 유백색의 점액상 물질로 산성이며, 다소 자극성 냄새를 갖고 있으며, 수분, 단백질, 지방, 탄수화물, 비타민, 무기물 이외에 생리활성물질로 이루어진 복합물질이다. 로열젤리의 주요성분은 10-hydroxydecanoic acid (10-HDA)와 major royal jelly protein (MRJP)로 알려져 있으며 우리나라에서는 10-HDA를 로열젤리의 규격으로 설정되어 있다(KFDA, 2019b). 오래전부터 전 세계적으로 로열젤리는 자양강장제와 같은 건강기능식품으로 널리 사용되고 있으며, 항종양, 면역강화, 항염증, 항고혈압, 항노화 및 콜라겐 생성과 피부보습 등의 약리적 효능이 알려져있다. 특히 아시아 지역에서는 화장품, 건강 보조제 및 음료 등의 시장으로 크게 확대되고 있으며, 국산 로열젤리가 피부 멜라닌세포의 세포 내 티로시나아제(tyrosinase) mRNA 전사를 억제함으로써 티로시나아제 활성과 멜라닌 합성을 감소시키는 것으로 확인하고, 피부 관련 기능성 소재로서 활용가치가 높은 것으로 보고한 바 있다(Han et al., 2011). 국내는 물론 해외에서도 로열젤리에 대한 피부재생, 피부미백 및 보습 등 탁월한 효능이 보고되어 있으나, 아직까지 국내에서는 건강기능식품원료로 인정되어 있지 않아 고부가 가치 소재로의 활용에 제약을 받고 있다.
따라서 본 연구는 국내 양봉농가에서 생산한 동결건조 로열젤리의 영양성분 및 10-HDA 함량을 분석하고 자외선과 피부 상처에 의한 피부손상으로부터 피부건강 유지에 도움을 주는 건강 기능식품 원료로서의 가능성을 평가하고자 하였다.
Materials and Methods
1. 공시시료
시험에 사용한 로열젤리는 한국양봉협회 (Korea)로부터 2019년에 채취한 생 로열젤리를 구입 후 동결건조하여 사용하였다. 동결건조 한 로열젤리의 10-HDA 함량 분석은 Ultra high performance liquid chromatography (UPLC; Waters, USA)을 사용하였다(Kim et al., 2014). 동결건조한 로열젤리의 수분, 단백질 등은 분석하였다. 동결건조 로열젤리를 용량플라스크에 넣은 후 메탄올을 사용하여 5 mg/mL의 농도가 되도록 만들고 40℃에서 30 min 간 초음파 추출기를 사용하여 추출한 후 0.2 μm 필터를 사용하여 여과하였다. 표준품 10-HAD (Nacalai tesque, Japan) 역시 로열젤리와 동일한 방법으로 전처리 하였다.
2. 동결건조 로열젤리의 성분 분석
생로열젤리와 동결건조 로열젤리의 수분 분석은 식품공전의 일반 시험법 식품성분시험법에 따라 상압가열건조법을 사용하여 분석하였다. 조단백질과 조지방, 회분 역시 식품공전 일반시험법 식품성분 시험법으로 분석하였다(KFDA, 2019c). 10-HDA 분석은 식품공전 로열젤리가공식품 10-HDA분석법에 따라 고속액체크로마토그래피(HPLC; Agilent, USA)를 이용하여 정량분석 하였으며10-HDA를 표준품으로 사용하였다(KFDA, 2019c). 비타민 조성은 건강식품 공전의 비타민 시험법에 따라 시료의 전처리 및 함량 분석을 실시하였다. 무기질 중 나트륨(Na), 마그네슘(Mg), 칼륨(K), 칼슘(Ca), 망간(Mn), 철(Fe), 구리(Cu), 아연(Zn), 인(P)은 식품공전의 일반시험법과 건강기능식품공전의 건강기능식품 시험법에 제시된 건식분해법에 따라 검체를 건조하여 탄화시키고 450-550℃에서 완전히 회화시킨 후 염산을 추가하여 유리여과기로 여과한 다음 유도 결합 플라즈마 발광분석기 (ICAP 7400 Duo; Thermo Fisher Scientific, USA)를 이용하여 함량을 측정하였다. 몰리브덴(Mo) 및 셀레늄(Se) 역시 건식분해법에 의하여 시료를 전처리하고 함량 분석은 Agilent ICP-MS 7700 (Santa Clara, USA)을 사용하였다. 염소(Cl) 분석은 식염 1 g을 함유하는 양의 검체를 회화시킨 후 물에 녹이고 여과하여 크롬산 칼륨시액을 첨가한 다음 질산은 용액으로 적정하여 염소의 양을 산출하였다.
3. 세포배양
본 연구에서 사용된 각질형성세포(HaCaT cell)는 한국세포주은행(Korea)으로 구입하여 사용하였다. HaCaT 세포는 Dulbecco's modified eagle medium (DMEM; Thermo Fisher Scientific) 배지에 10% fetal bovine serum (FBS; Thermo Fisher Scientific, USA)와 1% penicillin/strptomycine (penicillin 100 IU/mL, streptomycin 100 μg/mL; Thermo Fisher Scientific)를 첨가하여 37℃, 5% CO2 조건의 배양기에서 배양하였다.
4. 세포 생존율 측정
동결건조 로열젤리와 10-HDA 대한 HaCaT 세포 생존율 및 증식 효능은 EZ-Cytox cell viability assay kit (Dogen, Korea)를 사용하여 측정하였다. HaCaT세포를 96 well plate에 최종 농도가 2×105 cells/mL가 되도록 분주한 뒤 37℃, 5% CO2 incubator에서 24h 배양하였다. 배양 된 세포에 동결건조 로열젤리와 10-HDA를 각각 다양한 농도별로 처리하고 24 h 배양 후 EZ-Cytox 시약 10 μL를 처리한 다음 4 h 동안 배양 후 microplate reader (BioSurplus; Spectramax M2, USA)를 이용하여 480 nm에서 흡광도를 측정하였다. 세포 재생 효능은 대조군에 대한 생존율로 나타내었다.
5. 세포 이주 및 재생 효능 평가
피부 상처 세포 모델(wound healing assay)은 HaCaT세포를 6 well plate에 최종 농도가 2×105 cells/mL가 되도록 분주한 뒤 37℃, 5% CO2 배양기에서 세포가 90% 이상 증식한 상태가 될 때까지 배양하였다(Kim et al., 2019). 충분히 세포가 안정화 되었을 때 멸균한 200 μL pipette tip (Thermo Fisher, USA)으로 배양 접시를 긁어 상처를 유도하였다. 동결건조 로열젤리와 10-HDA를 농도별로 처리 한 후 시간대별로 세포의 이동 정도를 현미경 (EVOS XL core; Thermo Fisher, USA)을 이용하여 관찰하였다. 또한 재생 효능은 EZ-Cytox cell viability assay kit를 사용하여 측정하였다.
6. Matrix metalloproteinase (MMP)-1과 MMP-3 발현량 측정
HaCaT 세포는 6 well plate에 3×104 cells/mL로 분주한 다음 37℃, 5% CO2 배양기에서 24 h 배양 후 PBS로 세척한 다음 UVB lamp (LF-215.LM; UVITEC Cambridge, UK)를 이용하여 4 mW/cm2 조사량을 10 s 노출시켜 40 mJ/cm2으로 조사하였다(Ryu et al., 2019). 양성대조군인 vitamin C, 동결건조 로열젤리와 10-HDA를 농도별 처리하고 24 h 동안 배양하였다. 배양 후 MMP-1,3의 발현은 human MMP-1 ELISA kit (Abcam, UK)와 human MMP-3 ELISA kit (Abcam)를 사용하여 프로토콜에 따라 측정하였다. MMP-1 또는 MMP-3 항체가 코팅 된 plate에 배양액 및 antibody cocktail을 각각 50 μL/well씩 분주한 후 1 h 동안 실온에서 반응하였다. 세척작업 3회 후 TMB solution 100 μL/well를 첨가하여 암 조건에서 10 min 간 발색 반응한 후 stop solution 100 μL/well를 처리하여 450 nm에서 흡광도를 측정하였다.
7. Total RNA 분리 및 real-time PCR
HaCaT 세포를 6 well plate에 3×104 cells/mL 농도로 24 h 배양한 후 PBS로 세척한 다음 UVB lamp를 이용하여 40 mJ/cm2으로 조사하였다. 양성대조군인 vitamin C, 동결건조 로열젤리와 10-HDA를 농도별 처리하고 24 h 동안 배양하였다. Total RNA 분리는 RNeasy mini kit (Qiagen, Germany)를 이용하였고 제조사의 권장 방법에 따라 사용하였다. 먼저 상층액을 제거하고 PBS로 1회 washing 후 RLT buffer를 가하여 세포를 용해한 뒤 70% 에탄올을 첨가하여 total RNA를 추출하였다. cDNA합성은 PrimeScript II 1st strand cDNA synthesis kit (Takara, Japan)를 이용하여 진행하였다. PCR tube에 total RNA 6 μL와 random hexamer 1 μL, dNTP mixture 1 μL, RNase free water 2 μL를 첨가하여 65℃ 5 min, 4℃에서 5 min 반응시켰다. 이후 반응물에 5X buffer 4 μL, primescript RTase 1 μL, RNase inhibitor 0.5 μL, RNase free water 4.5 μL를 혼합하여 30℃ 10 min, 42℃ 1 h, 95℃ 5 min 반응을 통하여 cDNA를 합성하였다. 타깃 mRNA 발현을 평가하기 위하여 real-time PCR은 SYBR Premix Ex Taq (Takara, Japan)를 이용한 후 CFX96 touch real-time PCR detection system (Biorad, USA)에서 수행하였다. PCR증폭은 95℃에서 10 min 동안 예비 가열 후 denaturation은 94℃에서 20 s, annealing은 각 specific primer sequences에 맞는 온도에서 20 s, extension은 72℃에서 30s의 조건으로 40회 반복하였으며, 72℃에서 10 min 동안 안정화 과정을 진행하였다. 각각의 specific primer sequence는 Table 1과 같다.
Results and Discussion
양봉농가에서 생산한 생(生)로열젤리는 수분 함량이 60% 이상이며 주 성분인 단백질 함량이 11% 이상으로 냉장 및 상온에서 쉽게 변질될 우려가 있어 산업화에 걸림돌이 되었다. 본 연구에서는 다양한 산업화 원료로 활용하기 위하여 이러한 단점을 보완한 동결건조 로열젤리를 사용하여 자외선에 의한 피부 노화 억제, 피부 상처에 의한 피부세포 재생 및 이주 효능을 평가하고 로열젤리의 생리활성이 주요 성분으로 알려진 10-HDA에서 기인하는지를 알아보고자 하였다.
1. 국산 동결건조 로열젤리의 성분 분석
시험에 사용한 동결건조 로열젤리는 국내 양봉농가에서 생산한 로열젤리를 동결건조하여 시험에 사용하였다. 동결건조 로열젤리의 주요 영양성분 및 10-HDA 함량은 Table 2와 같다. 시험에 사용한 국산 동결건조 로열젤리는 우리나라 식품공전의 동결건조 로열젤리 제품의 규격 기준인 수분 함량 5% 이하, 단백질 함량은 30에서 41% 그리고 10-HDA함량 4%이상 조건을 모두 충족하였으며 10-HDA함량은 기준규격보다 30% 이상 함량이 높았다(KFDA, 2019b). 로열젤리는 비타민B1, B2 그리고 Niacine (B6)이 확인되었으며 niacin 함량이 매우 높았다(Figure 1A). 또한 무기물 성분도 풍부했으며, 특히 칼륨과 마그네슘, 칼슘 함량이 높은 것으로 확인되었다(Figure 1B). 국산 동결건조 로열젤리는 높은 10-HDA, 단백질 그리고 비타민과 무기물 성분으로 기존의 생로열젤리의 저장 및 이용에 있어 단점을 보완할 수 있어 다양한 식품 소재로 활용 가능성이 높아졌다.
2. 국산 동결건조 로열젤리와 10-HDA의 피부 세포 독성 평가
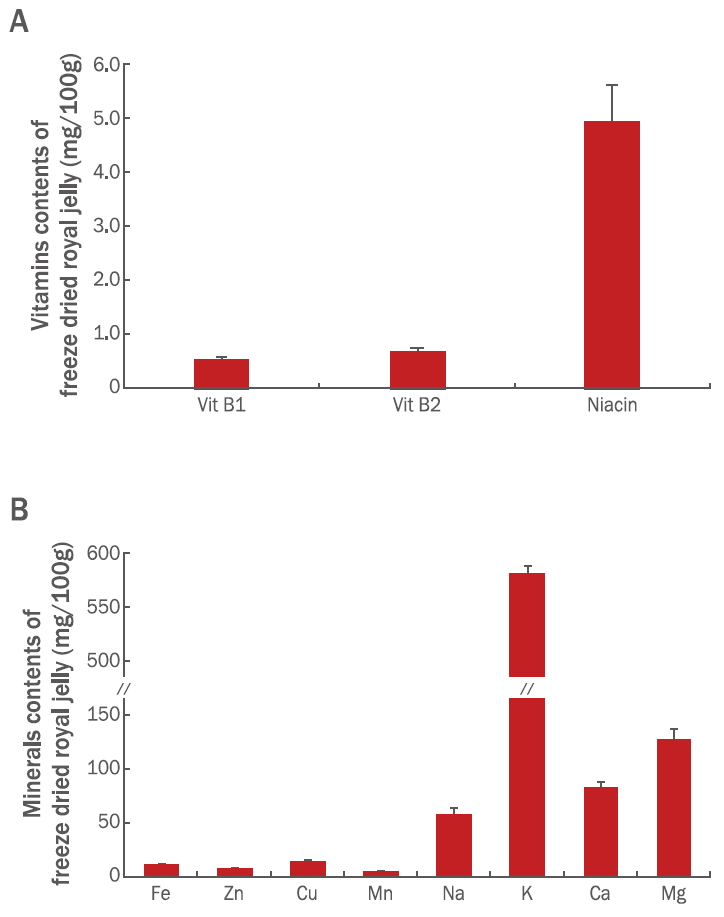
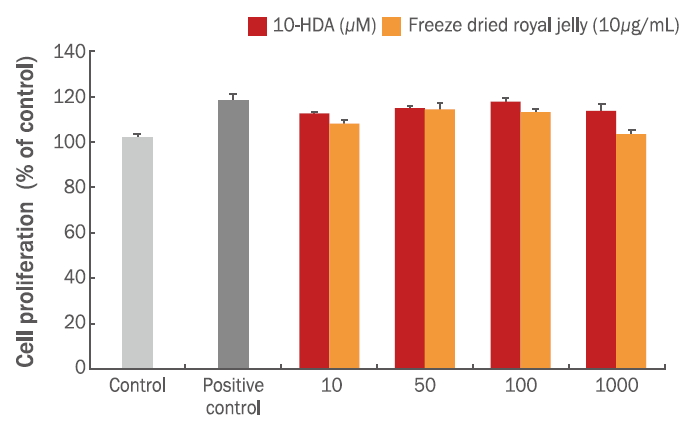
피부 각질형성세포는 피부 재생과 상처치유 등 피부조직의 재형성 과정에서 매우 중요한 역할을 한다고 알려져 있다(Choung et al., 2013). 피부 각질형세포인 HaCaT 세포주는 화학적 또는 물리적 자극에 의한 손상을 받게 되면 다양한 케모카인(chemokine)과 사이토카인이 발현됨과 동시에 피부 손상 부위로 이동하여 피부 세포의 증식을 유도한다고 알려져 있다(Choung et al., 2013). 10-HDA는 로열젤리의 주요 지표 물질로 항암, 항균, 항염증 등 다양한 분야에 생리활성효과를 나타내는 것으로 보고되어 왔으며(Fujiwara et al., 1990; Nagai & Inoue, 2004; Han et al., 2011) 피부세포 증식 및 상처 치유에 효과가 있는 것으로 알려져 있다(Lin et al., 2019). 본 연구에서는 국산 동결건조 로열젤리의 피부 항노화 기능성 화장품 소재로 개발하고자 HaCaT세포를 활용하여 10-HDA의 피부세포의 성장 및 이주능을 평가하고자 하였다. 동결건조 로열젤리 및 10-HDA의 HaCaT세포에 대한 독성을 보이지 않는 실험 최대 농도를 설정하기 위하여 세포독성을 평가하였다. Figure 2에서 보는 바와 같이 동결건조 로열젤리는 100 μg/mL 이상에서도 세포 독성을 유발하지는 않았으나 100 μg/mL 이상의 농도로 처리했을 경우엔 동결건조 로열젤리가 충분히 용해 되지 않아 배지가 혼탁해지는 것을 확인할 수 있었다. 10-HDA 역시 1,000 μM 이상에서도 세포 독성은 유발하지 않았으나 배지가 혼탁해지는 것을 알 수 있었다. 이러한 연구결과를 바탕으로 배지에 충분히 용해 될 수 있는 실험 최대 농도로 동결건조 로열젤리는 100 μg/mL, 10-HDA는 1,000 μM 이내로 설정하고 이 범위 내에서 피부세포의 재생 효과를 검증하고자 피부세포상처 모델(wound healing assay)을 이용하여 동결건조 로열젤리와 10-HDA의 피부세포 재생 및 이주능을 평가하였다.
3. 국산 동결건조 로열젤리와 10-HDA의 피부 세포 증식 효과
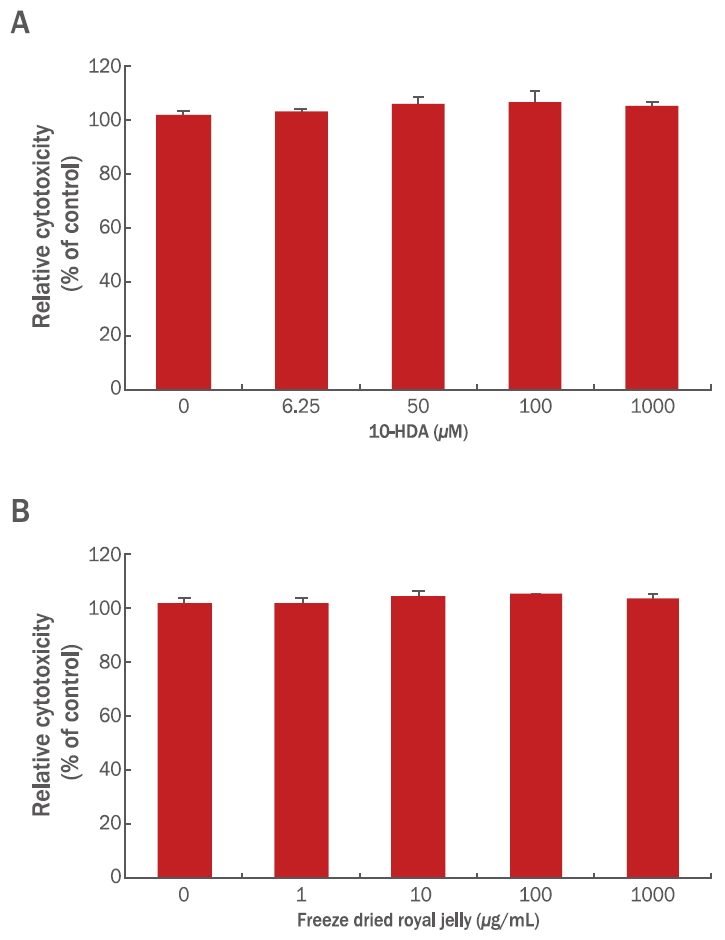
Figure 3과 같이 동결건조 로열젤리는 100 μg/mL 의 농도에서 피부세포 재생율이 가장 높았으며, 10-HDA에서는 100 μM로 처리한 시험구에서 세포 재생율이 가장 높았다. Figure 4와 같이 HaCaT 세포에 동결건조 로열젤리와 10-HDA를 각각 농도별로 처리했을 때 농도 및 시간 의존적으로 무 처리구에 비하여 세포 성장 및 세포이동이 증가하는 것으로 확인되었다. 동결건조 로열젤리 100 μg/mL의 농도와 10-HDA 100 μM 농도에서 48 h 후 HaCaT 세포의 성장 및 이동한 면적은 양성 대조군으로 사용한 vitamin C와 같은 효과를 나타내었다. 따라서 이러한 결과를 통해 국산 동결건조 로열젤리 및 지표 성분인 10-HDA의 피부세포 성장과 이주를 촉진함으로써 피부세포의 증식을 유도하는 것으로 확인되었다.
4. 국산 동결건조 로열젤리와 10-HDA의 MMP-1 및 MMP-3 발현 억제 효과
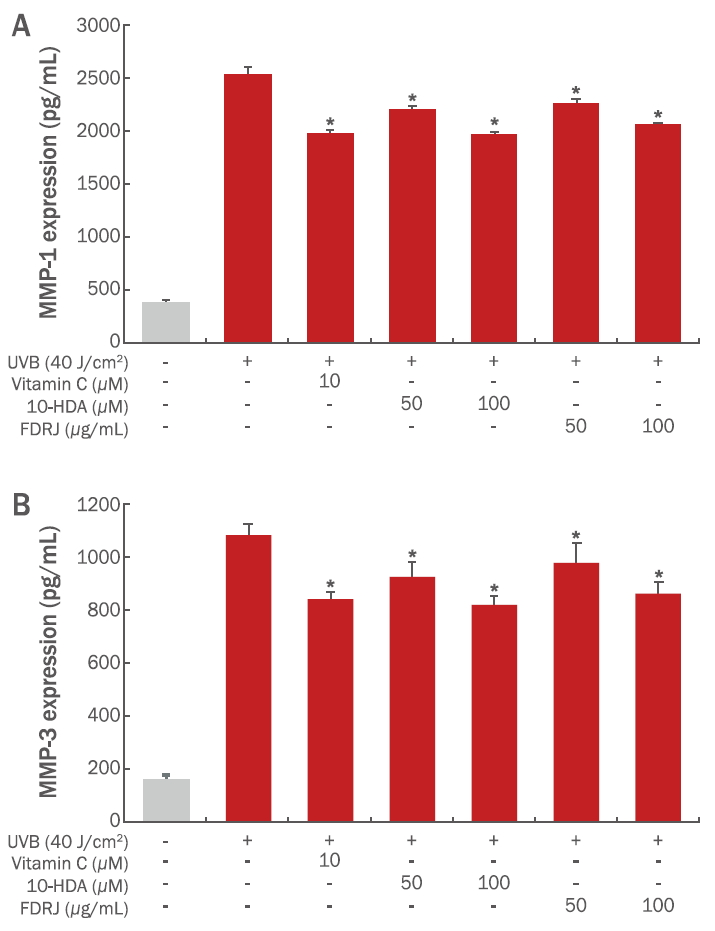
노화와 자외선 등으로 인한 피부 노출은 MAPK (mitogen-activated protein kinase)를 활성화시킨다(KFDA, 2019a). MAPK에서 가장 많이 영향을 받는 인자는 AP-1이다. AP-1은 Jun과 Fos family 단백질로 이루어진 전사인자로 c-Jun과 c-Fos의 heterodimer 형태로 존재 할 때 전사활성이 가장 높다. 사람의 피부가 자외선에 노출되지 않았을 때는 c-Fos와 JunD의 이합체로 존재하나, 자외선, 외부 환경적 자극 등에 의하여 c-Jun과 c-Fos 단백질의 발현이 증가하게 되고, c-Jun은 JNK와 p38에 의한 인산화에 의하여 활성화된다(KFDA, 2019a). AP-1은 세포와 분화에 관련되는 많은 유전자의 발현을 조절하고 몇몇 MMPs의 발현을 강력히 조절한다(Scharffetter-Kochanek et al., 2000). MMPs는 zinc이온을 요하는 endoprotease로 세포외기질 단백질을 분해하는 효소이다. AP-1에 의해 발현이 조절되는 MMP중 MMP-1은 collagenase 1으로 알려져 있으며, typeⅠ와 Ⅲ collagen을 기질로 한다. MMP-3는 stromelysin 1이라고도 하며, 기저막의 type Ⅳ collagen을 분해하며 zymogen인 proMMP-1을 활성화시킨다. MMP-9은 gelatinase B로 collagenase에 의해 분해된 산물을 더 작게 가수분해한다(Pyun et al., 2012). 자외선에 의하여 MMP-1가 fibillar collagen (types Ⅰ와 Ⅲ)으로 쪼개면서 콜라겐을 분해시키고, 연이어 MMP-3, MMP-9를 증가시킨다. 따라서 MMP-1과 MMP-3의 발현을 억제함으로써 피부 노화 억제 및 손상된 피부의 재생을 유도하는 주요한 요인이 될 수 있다(Pyun et al., 2012). 본 연구에서는 피부세포 성장과 이주에 효과적인 동결건조와 10-HDA를 각각 HaCaT 세포에 다양한 농도별로 처리했을 때의 MMP-1과 MMP-3 효소 발현량을 ELISA kit를 이용하여 조사하였다. 그 결과 동결건조 로열젤리와 10-HDA 를 처리했을 때 MMP-1과 MMP-3의 발현량이 무 처리군에 비해 유의하게 감소되는 것으로 확인되었다(Figure 5). 특히 동결건조 로열젤리의 농도 100 μg/mL과 10-HDA는 농도 100 μM에서 MMP-1과 MMP-3의 발현이 가장 크게 억제되는 것으로 확인되었다.
5. 국산 동결건조 로열젤리와 10-HDA의 MMP-1 및 MMP-3 유전자 발현 억제 효과
동결건조 로열젤리와 10-HDA는 UVB 조사에 의해 발현이 증가된 MMP-1과 MMP-3 발현을 대조군 대비 유의한 수준으로 감소시키는 것으로 확인하였다. 따라서 본 연구에서는 피부 세포 성장과 이주에 효과적인 동결건조 로열젤리 100 μg/mL 와 10-HDA 100 μM를 각각 HaCaT 세포에 처리했을 때의 MMP-1과 MMP-3유전자의 발현량을 조사하였다. 그 결과 동결건조 로열젤리와 10-HDA를 처리했을 때 UVB 조사에 의해 증가된 MMP-1과 MMP-3의 유전자 발현량은 대조군 대비 유의하게 감소 되는 것으로 확인되었다(Figure 6). 이를 통해 동결건조 로열젤리와 10-HDA는 손상된 피부의 재생과 이주는 물론 피부 노화 억제에도 효과가 있음을 확인하였다.
Conclusion
오래 전부터 로열젤리는 면역 강화, 항노화, 항염, 항산화 작용이 뛰어나 민간과 한방에서 널리 사용되어 오고 있으나 고시형 기능식품원료에서 제외되어 국내 로열젤리 시장은 다소 침체되어 있는 상황이다. 본 연구에서는 실온에서 쉽게 변질되기 쉬운 생로열젤리의 단점을 보완한 국산 동결건조 로열젤리의 효능을 과학적으로 구명하고 기능성식품 소재로의 활용하기 위한 기능성 지표 성분을 탐색하고자 하였다. 국산 동결건조 로열젤리는 단백질과 탄수화물, 지질은 각각 38.8±3.6,37.4±5.52, 7.0±1.74%을 함유하고 10-HDA 6.2±0.69% 등 주요 성분을 함유하였다. 동결건조 로열젤리는 각질형성세포인 HaCaT 세포의 wound healing 모델을 이용한 동결건조 로열젤리와 10-HDA의 피부 재생 및 이주 효능을 측정한 결과 각각 100 μg/mL, 100 μM의 농도에서 피부 재생과 이주 효율이 유의적으로 증가하는 것으로 관찰되었다. 뿐만 아니라 동결건조 로열젤리와 10-HDA는 자외선에 의해 유도된 피부세포 노화의 원인인 콜라겐 감소에 관여하는 MMP-1과 MMP-3 생성 및 mRNA 발현을 효과적으로 억제하는 것으로 분석되었다. 따라서 본 연구결과를 통해 국산 동결건조 로열젤리는 피부 주름 개선용 천연물질 건강기능식품 원료로서 활용 가능성이 높으며 이러한 효능은 로열젤리의 주요성분인 10-HDA에서도 동일한 효능을 갖는 것으로 확인되었다.