인간 진피유래 줄기세포 배양액에 의한 인각각질형성세포의 노화 개선 효과
Human Dermal Stem/Progenitor Cell-derived Conditioned Medium Ameliorates Ultraviolet A-induced Damage of Normal Human Epidermal Keratinocytes
人皮肤干细胞培养基对紫外线A诱导衰老的人表皮角质形成细胞的改善
Article information
Abstract
목적
본 연구는 진피유래 줄기세포 배양액이 ultraviolet A (UVA)에 의해 노화가 유도된 인간각질형성세포의 보습 효과를 확인하기 위하여 수행되었다.
방법
UVA 처리에 의해 노화가 유발된 인간각질형성세포에서 진피유래 줄기세포 배양액의 보습 효과를 확인하기 위해서 진피유래 줄기세포 배양액의 2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디컬 소거능, 세포 생존율, 각질형성세포 보습인자 및 분화마커의 발현 양상, hyaluronic acid (HA) 단백질의 생성 정도를 확인하였다.
결과
진피유래 줄기세포 배양액의 보습 효과를 확인하기 위하여 hyaluronan synthase 2 (HAS2), aquaporin 3 (AQP3), keratin 1 (KRT1), keratin 10 (KRT10) mRNA 발현을 확인한 결과, UVA 조사에 의해 감소한 HAS2와 AQP3 유전자 발현이 진피유래 줄기세포 배양액에 의하여 각각 2.29배, 4.82배 증가하였다. 인간각질형성세포의 과각질화에 관여하는 KRT1과 KRT10 유전자의 발현은 UVA 조사군 대비 진피유래 줄기세포 배양액에 의하여 각각 47%, 58% 감소함을 확인하였다. 또한 HA 단백질의 생성이 진피유래 줄기세포 배양액에 의해 46% 증가함을 확인하였다.
결론
본 연구를 통해 진피유래 줄기세포 배양액의 보습 효능을 확인하였고, 진피유래 줄기세포 배양액이 피부미용 및 화장품, 의약품 산업 등에 응용될 수 있다고 여겨지며 그 가능성을 확인하기 위해 추가적인 기전연구가 필요할 것이다.
Trans Abstract
Purpose
The present study aimed to define the epidermal moisturizing effects of human dermal stem/progenitor cell-derived conditioned medium (hDSPC-CM) on normal human epidermal keratinocytes (NHEKs).
Methods
To investigate the epidermal moisturizing effects of hDSPC-CM on NHEKs, I measured 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical-scavenging activity and gene expression and performed cell viability assay and hyaluronic acid (HA)–enzyme-linked immunosorbent assay (ELISA).
Results
In the present study, I elucidated the effects of hDSPC-CM on the mRNA expression of hyaluronan synthase 2 (HAS2), aquaporin 3 (AQP3), keratin 1 (KRT1), and keratin 10 (KRT10) and HA production. Real-time polymerase chain reaction (real-time PCR) revealed that hDSPC-CM increased HAS2 and AQP3 expression in NHEKs, and HA-ELISA revealed that hDSPC-CM increased HA production in NHEKs. On the other hand, hDSPC-CM decreased KRT1 and KRT10 expression in NHEKs.
Conclusion
The results revealed that hDSPC-CM is a potent moisturizing cosmetic ingredient for epidermal moisturization. Based on this study, I anticipate further studies on mechanisms underlying the effects of hDSPC-CM on epidermal keratinocytes to develop not only cosmetics but also healthcare medicines.
Trans Abstract
目的
探讨人皮肤干细胞培养基对紫外线A (ultraviolet A, UVA)诱导衰老的人表皮角质形成细胞的保湿作用。
方法
为探讨 人皮肤干细胞培养基对紫外线A诱导衰老的人表皮角质形成细胞的保湿作用,对人皮肤干细胞培养基进行2,2-diphenyl-1- picrylhydrazyl (DPPH)自由基消除能力,细胞生存率,角质形成细胞保湿因子和分化标志物的表达程度,hyaluronic acid (HA)的蛋白质形成程度。
结果
为确认人皮肤干细胞培养基的保湿效果,测定 hyaluronan synthase 2 (HAS2), aquaporin 3 (AQP3), keratin 1 (KRT1), keratin 10 (KRT10) mRNA表达程度,其结果显示,在UVA照射下,减少的HAS2와AQP3遗传因 子的表达,因人皮肤干细胞培养基的使用,分别增加了2.29,4.82倍。与UVA照射群相比使用人皮肤干细胞培养基群的人 角质形成细胞过角质化相关的遗传因子KRT1和KRT10的表达,分别减少了47%, 58%。此外,人皮肤干细胞培养基的使 用,使HA蛋白质的形成也增加了46%。
结论
通过研究确认了人皮肤干细胞培养基的保湿作用,认为人皮肤干细胞培养 基可用于皮肤美容,化妆品,医药品。因此为确认其可行性有必要进一步研究人皮肤干细胞培养基的机制。
Introduction
피부는 외부 자극으로부터 신체의 항상성을 유지시켜 주는 보호기관이다. 즉, 외부의 화학적, 물리적, 생물학적 장벽기능을 수행하고 있으나 다양한 환경적 요인과 접촉하고 있기 때문에 손상을 받게 된다(Lee et al ., 2007; Yoon et al ., 2013). 외부의 주요 스트레스 요인은 자외선, 미세먼지, 오염물질, 미생물의 번식 등을 대표적인 예로 들 수 있으며 이들은 활성산소종(reactive oxygen species, ROS)을 생성하여 피부 세포의 손상과 사멸을 유도하고 피부의 탄력저하, 주름생성 등의 피부노화를 가속화 시킨다(Kim et al., 2011; Yoon et al., 2013).
성체줄기세포는 스스로 재생 가능하며 많은 성인 조직에 존재한다(Weissman, 2000; Weissman et al ., 2001). 성체줄기세포는 손상된 세포를 대체할 수 있는 세포 치료에 적용하거나 조직과 장기가 어떻게 발달하는지 이해하는데 중요한 연구수단이다. 성체줄기세포의 일종인 간엽줄기세포(mesenchymal stem cells, MSCs)는 처음에는 골수에서 동정되었다(Jiang et al ., 2002; Pittenger et al ., 1999). MSC는 골아세포, 지방세포 및 연골세포와 같은 중배엽 계통과 신경세포, 간세포 및 췌장 베타세포와 같은 외배엽 및 내배엽 유래 세포로 분화할 수 있다(Jiang et al ., 2002; Phinney & Prockop, 2007; Pittenger et al ., 1999; Weissman et al ., 2001). 성체줄기세포의 한 종류인 피부 줄기세포가 진피에 존재하며, 피부 줄기세포가 MSC와 유사한 특성을 지니고 있다는 선행 연구가 기 보고되었다(Biernaskie et al ., 2009; Chen et al ., 2007; Shim et al ., 2012; Shim et al ., 2013a; Toma et al ., 2001). 피부 줄기세포는 손상된 진피를 회복시키고 피부의 항상성을 유지하는 역할이 설치류와 인간에서 연구되어왔다. Toma 등은 skin-derived progenitors (SKPs)라고 명명한 피부 줄기세포가 신경 줄기세포와 유사한 특성을 지니며 연골세포, 지방세포, 골아세포 등과 같은 중배엽 유래 세포로 분화할 수 있음을 입증했다. 또한 이들 세포는 신경세포 및 간세포를 포함한 외배엽 및 내배엽 기원의 세포로 분화할 수 있음을 보여주었다(Toma et al ., 2001). 또 다른 연구에 따르면 단일 세포 클론 분석을 사용하여 인간 진피 내의 성체줄기세포의 존재를 확인할 수 있었다(Chen et al ., 2007). Shim 등은 인간 진피유래 섬유아세포(normal human dermal fibroblasts, NHDFs)의 진피유래 줄기세포(human dermal stem/progenitor cells, hDSPCs)가 integrin beta 1 (CD29)의 결합 파트너인 IV형 콜라겐에 부착하는 능력을 토대로 hDSPC를 분리하여 보고하였다(Shim et al ., 2012; Shim et al ., 2013a). hDSPC가 nonhDSPC와 비교했을 때 줄기세포의 특성인 콜로니 형성 능력과 외배엽 및 중배엽 유래 세포로 분화될 수 있음을 보고 하였는데, 이는 hDSPC가 성체줄기세포의 특성인 다분화능이 있음을 의미한다.
Sasaki 등은 이전에 MSC의 이식이 손상된 마우스 피부의 상처 치유를 향상시킨다는 것을 보여 주었다(Sakaki et al ., 2008). MSC가 급성 혹은 만성 피부 상처를 가진 사람에게 주입될 때 상처 치유가 향상된다는 것이 다른 연구에 의해 입증되었다(Falanga et al ., 2007). 그러나 MSC가 특정 세포 계통으로 분화할 수 있는 능력에도 불구하고 이식 후 MSC 이식 효율이 낮으며, MSC 자체의 효과보다는 MSC가 분비하는 성장 인자와 같은 분비물에 의해 상처치료가 유도됨을 보여주고 있다(Iso et al ., 2007). 최근 연구에 따르면 골수유래 MSC 배양 배지는 높은 수준의 사이토카인(cytokine)을 함유하고 있으며, 대식세포의 혈관 내피 이동을 자극하고, Balb/c 마우스의 상처 치유를 향상 시킨다고 알려져 있다(Chen et al ., 2008). Shim 등의 연구에 따르면 IV형 콜라겐을 통해 동정한 hDSPC의 배양액인 hDSPC-conditioned medium (hDSPCs-CM)이 피부의 내인성 및 외인성 노화가 유발된 NHDFs를 개선함을 보고한바 있다(Jung et al., 2015; Shim et al., 2013b).
hDSPC-CM이 인간 각질형성세포(NHEKs)에서 보습에 효능이 있는지에 대한 연구는 전무한 실정이다. 본 연구를 통하여 hDSPC-CM이 ultraviolet A (UVA) 조사와 같은 유해한 외부 환경에 의해 노화된 표피를 개선할 수 있는 가능성을 밝히고자 한다. hDSPC-CM의 보습 효과와 관련하여 AQP3 와 HAS2 유전자의 발현에 영향을 미치는지 확인해보고, UVA 조사에 의해 감소된 NHEKs의 hyaluronic acid 단백질 생산이 hDSPC-CM에 의해 개선되는지 확인하고자 한다. 또한 UVA에 의해 유도된 NHEKs의 과각질화가 hDSPC-CM에 의해 개선되는지를 입증하고자 한다. 이를 통해 향후 hDSPC-CM의 피부미용 및 보습 화장품 소재로서의 가능성을 제시하고자 한다.
Methods
1. 진피유래 줄기세포 배양액(hDSPC-CM) 제작
인간 진피유래 섬유아세포는 Cell Applications (USA)에서 구입하여 사용하였다. 인간 진피유래 섬유아세포는 10% fetal bovine serum (FBS; Welgene, Korea), 100 μg/mL streptomycin (Gibco™, Thermo Fisher Scientific, USA), 100 U/mL penicillin (Gibco™)을 포함한 Dulbecco’s modified Eagle medium (DMEM; Gibco™)에 37℃, 5% CO2 조건에서 배양하였다. 진피유래 줄기세포를 분리하기 위해 3rd passage 이내의 인간섬유아세포를 사용하였다.
인간섬유아세포에서 소량 존재하는 hDSPC를 분리하기 위해 100 mm 조직 배양 접시에 IV형 콜라겐 (Sigma-Aldrich, USA) 20 μg/mL, 5 mL으로 4℃에서 12 h 동안 코팅하였다. IV형 콜라겐을 걷어낸 후, 인간섬유아세포 중 37℃의 인큐베이터 내에서 5 min 안에 부착하는 세포를 hDSPC, 5 min 이내에 부착하지 못하고 부유상태로 존재하는 세포를 non-hDSPC로 명명하였다. 전체 인간섬유아세포의 약 5–10%가 5 min 내에 접시에 부착되었다(Shim et al., 2012).
진피유래 줄기세포 배양액(hDSPC-CM)을 얻기 위해, hDSPC를 무혈청 DMEM을 이용하여 1×105 cells/mL 농도로 60 mm Hydrocell™ dish (Nunc™, Thermo Fisher Scientific)에서 배양하였다. 배양 48 h 후, hDSPC-CM을 채취하여 300×g에서 5 min 간 원심분리하고 0.22 μm 필터(Pall, USA)로 여과하였고, 보관 시에는 -80℃의 deep freezer (Nihon freezer, Japan)에 보관하였다(Shim et al ., 2013b).
2. 인간각질형성세포(NHEKs) 배양
인간각질형성세포와 세포배양에 사용할 배양액인 KGMGold™ keratinocyte growth medium은 Lonza (Switzerland)에서 구매하였다. 인간각질형성세포는 37℃, 5% CO2의 인큐베이터에서 배양하였고, 보습효능을 확인하기 위한 실험에 3rd passage 이내의 인간각질형성세포를 사용하였다(Park & Shim, 2016).
3. UVA 조사
인간각질형성세포의 외인성 노화를 위해, UVA를 다음과 같은 조건으로 처리하였다. 인간각질형성세포가 접종되어 있는 35 mm 조직 배양 접시에 phenol red 무첨가 DMEM을 1 mL 접종한 후 Bio-Link 자외선 조사기(Vilber Lourmat, France)를 이용하여 3 J/cm2의 UVA를 조사하였다.
4. DPPH assay를 이용한 라디컬 소거능 검증
hDSPC-CM과 non-hDSPC-CM을 phenol red와 혈청이 첨가되지 않은 DMEM으로 100–0.0001%의 농도로 연속 희석하였다. 50 μL 용량의 샘플을 0.1 mM 농도의 DPPH (Sigma-Aldrich) 500 μL와 혼합하고, 실온에서 20 min 간 반응시켰다. Epoch microplate reader (BioTek instruments, USA)로 DPPH 유리 라디칼의 증감을 517 nm에서 측정하였다. 양성대조군으로는 ascorbic acid (Sigma-Aldrich)를 사용하였다. 라디컬 소거능(%)은 다음과 같이 계산하였다.
라디컬 소거능(%)=[(대조군의 흡광도-샘플의 흡광도)/대조군의 흡광도]×100
5. 세포 생존율 측정
Cell counting kit-8 (CCK-8) assay를 이용하여 세포 생존율을 측정하였다. 인간각질형성세포를 96 well 조직 배양 접시에 3×103 개의 세포를 전 배양한 후, hDSPC-CM과 nonhDSPC-CM을 100%, 50%, 10%의 농도로 DMEM 배지에 각각 희석하여 처리하였다. 각각의 배양액을 처리하여 24 h 배양한 후, CCK-8 (Dojindo Molecular Technologies, Japan)을 phenol red 무첨가 DMEM을 사용해 DMEM:CCK-8=9:1로 희석하여 세포에 처리하고 30 min 동안 5% CO2, 37℃ 인큐베이터에서 반응을 유도하였다. Epoch microplate reader를 이용하여 450 nm 파장에서 흡광도를 측정하였으며, 세포 없이 배지만 넣은 대조군의 흡광도를 기준으로 하여 hDSPC-CM과 non-hDSPC-CM을 처리한 세포의 세포 생존율을 산출하였다.
6. 현미경 관찰
DMEM과 hDSPC-CM 혹은 non-hDSPC-CM을 각각 1:1로 희석한 배양액을 UVA를 조사한 인간각질형성세포에 24 h 처리한 후 위상차 현미경(CKX41; Olympus, Japan)을 사용하여 관찰하였다.
7. 실시간 유전자 중합효소 연쇄반응(real-time PCR)
TRIzol reagent (Thermo Fisher Scientific)를 사용하여 세포의 total RNA를 추출하였다. cDNA의 합성은 ReverTra Ace® qPCR RT kit (Toyobo, Japan)로 합성하였으며, 인간각질형성세포의 보습인자 및 각질화 마커의 발현 양상을 분석하기 위해 real-time PCR (Applied Biosystems™, Thermo Fisher Scientific)을 수행하였다. Table 1에 실험에 사용된 Taqman Gene expression assay를 명기하였다.
8. HA-ELISA assay
hDSPC-CM이 HA 단백질 생성에 미치는 영향을 확인하기 위하여 35 mm 조직 배양 접시에 20×104 개의 인간각질형성세포를 37℃, 5% CO2 인큐베이터에서 24 h 전 배양한 후, 자외선 조사기를 통해 UVA (3 J/cm2)를 조사하였다. UVA 조사 후, DMEM과 hDSPC-CM을 1:1로 희석 후 처리하여 48 h 동안 인큐베이터 내에서 배양하였다. HA-ELISA kit (Corgenix, USA)를 사용하여 제공된 프로토콜을 따라 인간각질형성세포에서 분비되는 HA 단백질의 양을 측정하였다.
9. 통계분석
본 연구에서의 통계처리는 Student’s t-test를 사용하여 유의 수준 0.05 이하 (p <0.05)로 검정하였다.
Results and Discussion
1. hDSPC-CM의 라디컬 소거능
본 실험에 사용된 DPPH assay는 항산화제의 라디컬 소거능을 확인하는데 사용되는 대표적인 시험법으로, 본 실험에서 hDSPC-CM과 non-hDSPC-CM을 100%에서 0.0001%의 농도로 각각 연속 희석하여 라디컬 소거능을 측정하였다. 과도한 활성산소종의 생성은 노화나 암 등의 질환을 유발하며, 활성산소종은 피부 광노화에 있어 중요한 역할을 하는 것으로 알려져 있다(Pryor, 1982). 자색을 띄는 DPPH는 안정한 라디컬로, 전자를 공여 받으면 노란색으로 변색된다. 양성대조군인 ascorbic acid는 농도 의존적으로 DPPH 소거능을 보였고, 본 연구에서 hDSPC-CM에 대한 전자공여능을 확인한 결과 농도 의존적으로 DPPH 라디컬 소거능이 증가하였으며, 특별히 고농도의 hDSPC-CM에서 항산화 효과를 지님을 확인하였다(Figure 1).
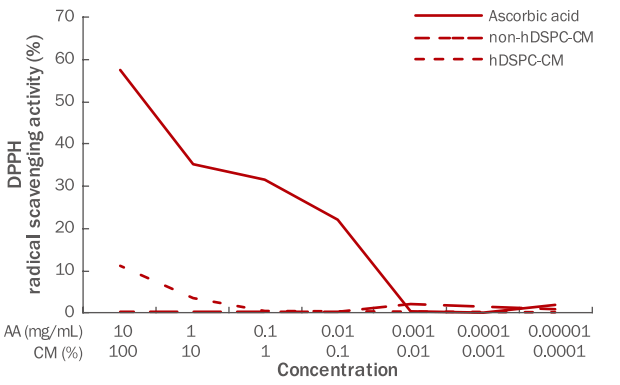
Free radical scavenging effects of hDSPC-CM using the DPPH radical scavenging assay.
The anti-oxidative effects of hDSPC-CM were confirmed by assessing DPPH radical scavenging activity using ascorbic acid as a positive control. The anti-oxidative ability of the hDSPC-CM increased in a concentration-dependent manner. DPPH, 2,2-diphenyl-1-picrylhydrazyl; hDSPC-CM, human dermal stem/progenitor cell-derived conditioned medium; AA, ascorbic acid.
2. 인간각질형성세포에서 hDSPC-CM의 생존율 확인
hDSPC-CM에 의한 인간각질형성세포의 세포 생존율을 알아보기 위하여 CCK-8 assay를 수행하였다. 세포 없이 배지만 넣은 대조군을 기준으로 hDSPC-CM은 100%, 50%, 10%의 농도로 각각 처리하여 세포 생존율을 측정하였다(Figure 2A). 100, 50% 농도의 hDSPC-CM을 처리할 때 인간각질형성세포의 생존율이 대조군 대비 유의성 있게 증가하였고, 본 실험에서는 50% 농도의 hDSPC-CM을 처리하여 추가실험을 진행하였다. 위상차 현미경을 통하여 대조군, UVA 처리군, UVA 조사 후 hDSPC-CM과 non-hDSPC-CM 처리시의 인간각질형성세포의 모양을 확인한 결과, 각 조건별 상이함을 보이지 않았으나, UVA 조사에 의해 감소되었던 인간각질형성세포가 hDSPC-CM 처리에 의해 증가되는 양상을 보였다(Figure 2B).

Cell viability and morphological aspects of hDSPC-CM in NHEKs.
(A) NHEKs (3×103 cells/well) were seeded in 96-well plate and incubated with hDSPC-CM for 24 h. Cell viability was determined by CCK-8 assay. The cell viability under hDSPC-CM was greatest when treated with a 100% and 50% concentration of hDSPC-CM compared with the untreated control group. Results are presented as the M±S.D. of the percentage of control OD in triplicate. * means compared to control NHEKs (* p<0.05). (B) NHEKs were seeded in 6-well culture plate and treated with UVA or hDSPC-CM/non-hDSPC-CM (50%) for 24 h. Cell morphologies were confirmed using a phase-contrast microscopy. hDSPC-CM, human dermal stem/ progenitor cell-derived conditioned medium; NHEKs, normal human epidermal keratinocytes; CCK-8, cell counting kit-8; M±S.D., mean±standard deviation; OD, optical density; UVA, ultraviolet A; non-CM, non-hDSPC-CM; CM, hDSPC-CM.
UVA는 파장의 길이에 따라 장파장의 UVA (320–400 nm), 중파장의 UVB (290–320 nm), 단파장의 UVC (200–290 nm)로 구분된다(Kim et al ., 2011; Lee et al ., 2007). 특별히 UVA와 UVB는 DNA 손상과 세포사멸 수용체 활성화를 유도할 뿐 아니라 활성산소종을 생성하여 세포사멸을 유도하고(Assefa et al ., 2005), UVA와 UVB에 의해 촉진된 활성산소종의 생성은 직접적 혹은 간접적으로 노화, 염증반응, 광감작, 조직의 암화 등을 유도한다(Bickers & Athar, 2006). Figure 1에 나타난 hDSPC-CM의 활성산소 소거능을 통하여, Figure 2B에서의 hDSPC-CM 처리에 의한 인간각질형성세포의 생존율 증가가 hDSPC-CM의 라디컬 소거능에 의한 것으로 추측되며 이에 대한 심도있는 추가연구가 요구된다.
3. UVA 조사와 hDSPC-CM 처리에 의한 유전자 발현변화
인간각질형성세포에 UVA (3 J/cm2)를 처리한 후 hDSPC-CM을 처리하여 인간각질형성세포의 보습인자인 HAS2 와 AQP3 유전자의 발현양상을 real-time PCR 기법을 사용하여 확인하였다. UVA 조사에 의해 HAS2 , AQP3 와 같은 보습인자의 발현이 유의적으로 감소하였다. hDSPC-CM을 처리하고 인간각질형성세포의 표지인자 발현을 확인한 결과, UVA 처리군 대비 HAS2 의 발현이 2.29배, AQP3 의 발현이 4.82배 가량 증가하는 효과를 보였다(Figure 3). 세포 외부의 수분을 세포 내로 이동시키는 수송단백질인 AQP3 와, HA를 생성하는 효소인 HAS2 의 발현을 증가시키는 결과를 토대로, hDSPC-CM이 표피에 보습 효능이 있을 것으로 사료된다(Hara-Chikuma & Verkman, 2008; Hašová et al ., 2011; Sougrat et al ., 2002).
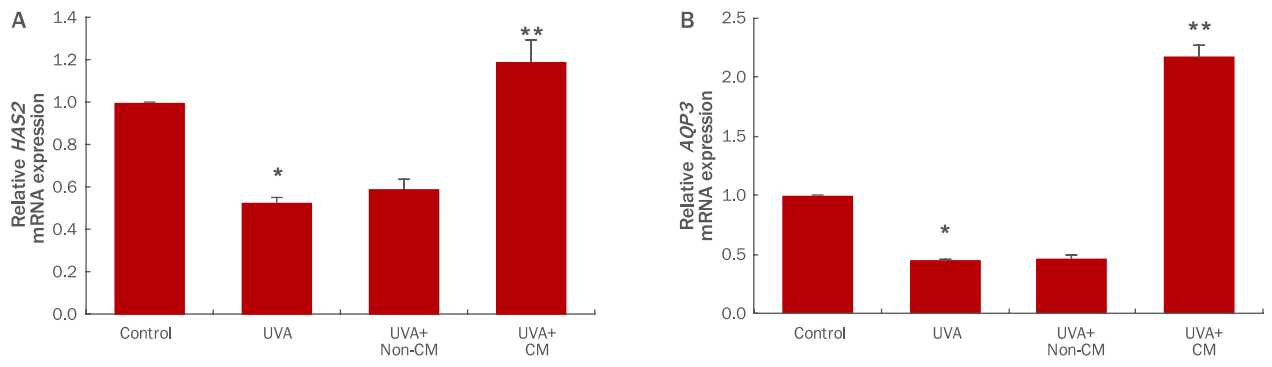
Evaluation of the effect of hDSPC-CM treatment on UVA-irradiated NHEKs.
Real-time PCR analysis of the epidermal keratinocyte markers HAS2 (A) and AQP3 (B). hDSPC-CM increased the expression of HAS2 (2.29 times) (A) and AQP3 (4.82 times) (B) compared to UVA-treated group. Values represent M±S.D. of three independent experiments. * means compared to control NHEKs, ** means compared to UVA-irradiated NHEKs (*, **p<0.01). HAS2, hyaluronan synthase 2; AQP3, aquaporin 3; UVA, ultraviolet A; hDSPC-CM, human dermal stem/progenitor cell-derived conditioned medium; NHEKs, normal human epidermal keratinocytes; Real-time PCR, real-time polymerase chain reaction; M±S.D., mean±standard deviation; non-CM, non-hDSPC-CM; CM, hDSPC-CM.
4. hDSPC-CM의 HA 생성 효과
HAS2는 각질형성세포에서 HA를 생성하는 효소로 알려져 있다(Karvinen et al ., 2003; Kim et al ., 2004). hDSPC-CM을 처리하여 HAS2 유전자의 발현량이 증가된 인간각질형성세포에서 HA 단백질의 생성 역시 증가되는지를 알아보기 위해 HA에 대한 효소결합 면역흡착법(ELISA)를 사용하여 측정하였다(Figure 4). UVA 조사에 의해 34% 정도 생성이 감소되었던 HA가 hDSPC-CM에 의해 UVA 처리군에 비해 약 46% 증가됨을 확인하였다. 본 결과는 HAS2 mRNA에 대한 real-time PCR 실험 결과와 일치하며, hDSPC-CM은 HAS2 mRNA 레벨에서의 발현을 증가시킬 뿐만 아니라 HA 단백질의 생성 역시 증가시킬 수 있음을 보여준다.
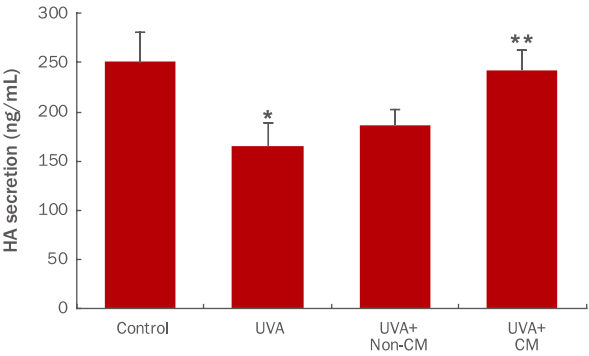
Effects of hDSPC-CM on HA synthesis in NHEKs.
NHEKs were seeded in 35-mm cell culture dishes and treated with hDSPC-CM for 48 h. Media were collected and assessed using HA-ELISA. hDSPC-CM increased the secretion of HA compared to UVA-treated group (1.46 times). Data represent the M±S.D. of three independent experiments. * means compared to control NHEKs, ** means compared to UVA-irradiated NHEKs (*, **p<0.05). HA, hyaluronic acid; UVA, ultraviolet A; hDSPC-CM, human dermal stem/ progenitor cell-derived conditioned medium; NHEKs, normal human epidermal keratinocytes; ELISA, enzyme-linked immunosorbent assay; M±S.D., mean±standard deviation; non-CM, non-hDSPC-CM; CM, hDSPC-CM.
5. hDSPC-CM의 분화마커 발현에 미치는 효과
각질형성세포는 기저층에서 각질층으로 순차적으로 분화가 진행되어 탈락되는 각질 턴오버를 거치게 된다. 기저층에 존재하는 각질형성세포가 유극층, 과립층, 각질층으로 분화되면서 keratin 14 (KRT14), keratin 5 (KRT5 )와 같은 마커의 발현을 된 각질형성세포의 분화마커인 FLG , LOR , KRT1 , KRT10 의 발현을 real-time PCR로 확인하였다(Figure 5). UVA (3 J/cm2) 조사에 의해 FLG , KRT1 , KRT10 유전자 발현이 현저히 증가하였고, LOR 유전자에는 큰 영향을 미치지 않았다. 여기에 hDSPC-CM 처리시 KRT1 , KRT10 유전자의 발현이 UVA 처리군 대비 각각 47%, 58% 감소됨을 확인할 수 있다(Figure 5C, D). 이는 UVA가 각질형성세포의 과분화를 유도하여 과각질화를 유발하지만, hDSPC-CM이 KRT1 , KRT10 유전자의 발현을 유의적으로 감소시켜 분화가 과도하게 진행되는 현상을 억제시킴을 확인하였다.
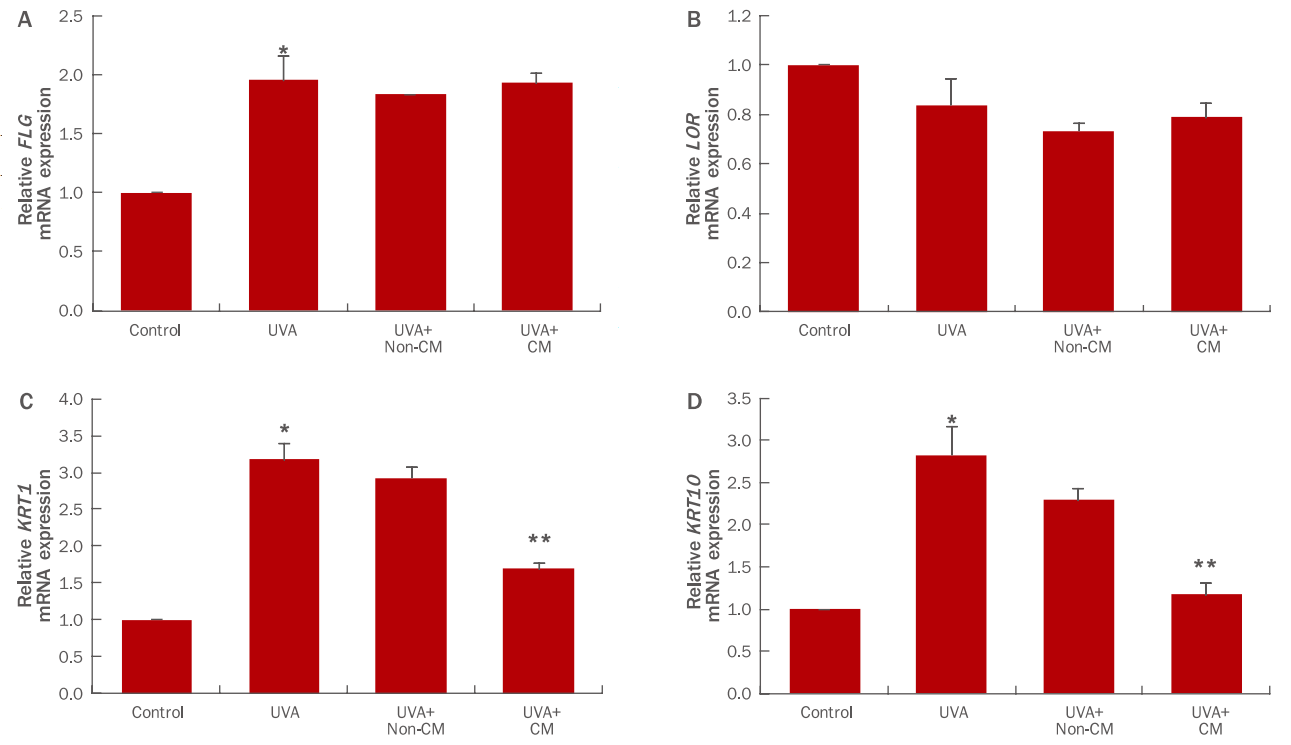
Differentiation marker expressions in UVA-irradiated NHEKs treated with hDSPC-CM.
Real-time PCR analysis of the differentiated epidermal keratinocyte markers FLG (A), LOR (B), KRT1 (C), and KRT10 (D). hDSPC-CM decreased the expression of KRT1 (47%) (C) and KRT10 (58%) (D) compared to UVA-treated group. Graphs indicate M±S.D. of three independent experiments. * means compared to control NHEKs, ** means compared to UVA-irradiated NHEKs (*, **p<0.05). FLG, filaggrin; LOR, loricrin; KRT1, keratin 1; KRT10, keratin 10; UVA, ultraviolet A; hDSPC-CM, human dermal stem/progenitor cell-derived conditioned medium; NHEKs, normal human epidermal keratinocytes; Real-time PCR, real-time polymerase chain reaction; M±S.D., mean±standard deviation; non-CM, non-hDSPC-CM; CM, hDSPC-CM.
Conclusion
피부는 노화에 의해 주름이 생성되고 두꺼워지며 염증 등의 반응이 나타나게 된다. 특별히 자외선과 같은 외부인자에 의해 피부는 활성산소종의 연쇄 반응으로 피부질환이 발생하거나 노화가 촉진된다(Kim et al ., 2011; Talwar et al ., 1995). 또한 유전자 발현을 감소시킴으로써 인간각질형성세포의 과각질화를 억제할 수 있음을 확인하였다(Figure 5). 이는 hDSPC-CM이 피부보습을 개선하는 후보물질로서의 가능성을 제시하고 있다.
hDSPC-CM의 피부보습의 효능을 인간각질형성세포에서 확인한 연구는 본 연구가 최초로, 본 연구를 바탕으로 hDSPC-CM의 피부미용 및 화장품 산업에 응용이 될 수 있을 것으로 보인다. 추후 liquid chromatography–mass spectrometry (LC-MS) 기법 등을 활용한 hDSPC-CM 내 지표물질 규명을 통해 항노화 및 보습에 관여하는 타깃물질을 발굴하는 연구도 수행되어야 할 것이다. 또한 hDSPC-CM이 어떠한 기전에 의해 표피의 보습에 관여하는 지에 대해 연구와 hDSPC-CM이 인체에 미치는 영향에 대한 임상연구가 필요할 것으로 사료된다.
Acknowledgements
이 논문은 2017년도 정부(미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임 (No.2017R1C1B5076217).
