아로니아 잎 추출물을 이용한 화장품 소재 개발
Efficacy of Cosmetic Materials Using Aronia melanocarpa Leaf Extracts
黑果腺肋花揪叶提取物作为化妆品原料的开发
Article information
Abstract
목적
아로니아 잎 추출물의 화장품 기능성 소재로서 활용 가능성을 알아보기 위하여 항산화, 미백, 항염증, collagen 합성량을 측정하였다.
방법
아로니아 잎을 에탄올, 열수 추출하여 시료로 사용하였다. 1,1-diphenyl-2-picrylhydrazyl (DPPH) 소거능과 총 폴리페놀 함량, 총 플라보노이드 함량을 측정하였으며, B16F10 mouse melanoma 세포주를 사용하여 미백효과를 측정하였다. 마우스의 RAW 264.7 대식세포에 lipopolysaccharide (LPS)를 처리하여 nitric oxide (NO) 억제 효과를 확인 하였으며, human dermal fibroblast (HDF)에서 ELISA kit를 이용하여 procollagen 합성량을 측정하였다.
결과
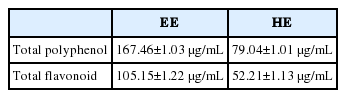
아로니아 잎 에탄올, 열수 추출물의 총 폴리페놀 함량은 167.46±1.03, 79.04±1.01 μg/mL으로 확인되었으며, 총 플라보노이드 함량은 105.15±1.22, 52.21±1.13 μg/mL로 나타났다. DPPH radical 소거능은 아로니아 에탄올 추출물의 효과가 높게 확인되었다. B16F10 세포에서 아로니아 잎의 tyrosinase 저해활성 및 melanin 저해율의 경우, 에탄올 추출물이 100 μg/mL 농도에서 21%, 24%의 저해 효과가 확인되었으며, 열수 추출물은 18%, 18%의 저해 효과가 확인되었다. α-melanocyte-stimulating hormone (α-MSH) 유도에 의한 tyrosinase 저해활성 및 melanin 저해율도 아로니아 에탄올 추출물의 효과가 더 높게 확인되었다. 아로니아 잎의 항염증 효과는 에탄올 추출물의 NO 생성 억제능이 더 우수하였다. 아로나이 잎 에탄올, 열수 추출물의 200 μg/mL 농도에서 각각 58%, 41%의 procollagen 합성이 증가하여 양성대조군 보다는 낮은 procollagen 합성이 확인 되었지만 HDF 세포에서 procollagen 합성을 증가시킴으로써 주름개선 효과를 가지는 것을 확인 할 수 있었다.
결론
이상의 결과를 통해 아로니아 잎은 에탄올 추출물이 열수 추출물 보다 항산화, 미백 그리고 항염증 및 collagen 합성 효과가 더 우수하였으며, 기능성 화장품 소재로서의 활용 가능하리라고 생각된다.
Trans Abstract
Purpose
To determine the anti-oxidant, whitening, anti-inflammatory and collagen synthesis effects of Aronia melanocarpa (A. melanocarpa) leaf extracts for use as cosmetic ingredients.
Methods
Ethanol and hot water leaf extracts of A. melanocarpa were used as test samples. Total polyphenol and flavonoid contents of the leaf extracts were quantified. The anti-oxidant activity of leaf extracts was measured using the 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging assay. The whitening effect of leaf extracts was measured in the mouse melanoma cell line B16F10. The inhibitory effect of leaf extracts on the production of nitric oxide (NO) was measured using lipopolysaccharide (LPS)-stimulated RAW 264.7 mouse macrophages. The amount of procollagen synthesized with and without leaf extracts was measured in human dermal fibroblasts (HDF) using ELISA.
Results
The total polyphenol contents in the ethanol and hot water leaf extracts of A. melanocarpa were 167.46±1.03 μg/mL and 79.04±1.01 μg/mL, respectively, and the total flavonoid contents were 105.15±1.22 μg/mL and 52.21±1.13 μg/mL, respectively. The DPPH radical scavenging effect of ethanol extracts was higher than that of hot water extracts. In the mouse melanoma cell line B16F10, the tyrosinase inhibitory activity and melanin inhibition rate using 100 μg/mL ethanol extracts and 100 μg/mL hot water extracts were 21% and 24%, 18% and 18%, respectively. The tyrosinase inhibitory activity and melanin inhibition induced by α-melanocytestimulating hormone (α-MSH) were higher in ethanol extracts than in hot water extracts. The anti-inflammatory effect of ethanol extracts, measured as the inhibition of NO production in LPS-stimulated RAW 264.7 mouse macrophages, was higher than that of hot water extracts. Procollagen synthesis was lower than the positive control group due to the respective 58% and 41% increases in procollagen synthesis with the concentration of 200 μg/mL.
Conclusion
Data showed that A. melanocarpa leaf extracts isolated using ethanol exhibited higher anti-oxidant, whitening, anti-inflammatory, and collagen synthesis effects than those isolated using hot water. Thus, ethanol leaf extracts can be considered as a candidate for use as ingredients in cosmetic products.
Trans Abstract
目的
探索黑果腺肋花揪叶提取物用作化妆品原料的可行性,并测定其抗氧化剂,美白,抗炎和胶原合成作用。
方法
使用黑果腺肋花揪叶的乙醇和热水提取物作为测试样品,测定其提取物的总多酚和类黄酮含量。使用1,1-diphenyl-2-picrylhydrazyl(DPPH)自由基清除测定法测量其提取物的抗氧化活性。在小鼠黑素瘤细胞系B16F10中,测量其提取物的美白作用。使用lipopolysaccharide(LPS)刺激的RAW264.7小鼠巨噬细胞测量其提取物的nitric oxide(NO)抑制生成作用。利用ELISA kit在人皮肤成纤维细胞(human dermal fibroblasts,HDF)中测量其提取物的原胶原蛋白合成量。
结果
黑果腺肋花揪叶乙醇和热水叶提取物的总多酚含量分别为167.46±1.03 μg/mL 和79.04±1.01 μg/mL,总类黄酮含量分别为105.15±1.22 μg/mL和52.21±1.13 μg/mL。乙醇提取物的DPPH自由基清除作用高于热水提取物。在小鼠黑色素瘤细胞系B16F10中,酪氨酸酶抑制活性和黑色素抑制率结果显示:使用100 μg/mL乙醇提取物时,分别为21%和24%;使用100 μg/mL热水提取物时,分别为18%和18%。α-melanocyte-stimulating hormone(α-MSH)诱导的酪氨酸酶抑制活性和黑素抑制在乙醇提取物中比在热水提取物中高。其提取物的抗炎作用结果显示,乙醇提取物的NO抑制作用高于热水提取物。黑果腺肋花揪叶乙醇和热水叶提取物在浓度为200 μg/mL时,其原胶原蛋白合成量分别增加58%和41%。虽然其增加量低与阳性对照组,但在HDF细胞中增加了原胶原蛋白的合成,从而确认了其皱纹改善效果。
结论
通过以上的结果,黑果腺肋花揪叶的乙醇提取物比热水提取物在抗氧化、美白、抗炎、胶原合成等效果方面更为优秀,因此作为功能性化妆品原料充分具有可行性。
Introduction
생활수준의 향상과 노령화 사회의 가속화로 인하여 현대인들은 외적인 미에 대한 관심이 증가하면서, 화장품 산업은 피부의 미백에 도움을 주는 제품이나 주름개선에 도움을 주는 등 특정 기능이 강조된 기능성 화장품 사업이 크게 성장하고 있다. 이에 따라 식물 등 천연물로부터 얻어지는 기능성 물질들을 원료로서 이용하려는 연구가 활발히 진행되고 있다(Kang et al. , 2015).
인간의 피부 색깔은 환경, 인종, 성별 등의 요인과 멜라닌(melanin), 카로틴 및 헤모글로빈 양과 같은 여러가지 요인에 의해 결정되지만 피부의 과색소 침착과 관련된 주요한 원인은 표피 내 멜라닌 색소의 이상적 증가에 기인한다(Lee et al. , 2005). 멜라닌은 자연계에 널리 분포하는 페놀류의 고분자 물질로서 단백질과 검은 색소의 복합체이다. 멜라닌은 인체 내에서 독성물질에 대한 제거 작용을 하여 세포를 보호하지만 과잉 생산 시 인체에 기미, 주근깨를 형성하고 피부 노화를 촉진시키며 피부암을 유발하는 것으로 알려져 있다. 이러한 멜라닌의 생합성 경로를 보면 tyrosine이 tyrosinase에 의해서 DOPA로 전환되고 다시 tyrosinase에 의해 DOPA quinone으로 전환되어 최종적으로 멜라닌을 생성하게 된다(Yu et al ., 2015).
피부에서 자주 나타나는 변화인 염증(inflammation)은 "균의 감염, 열, 외상, 항원항체 반응 등 생체조직의 기질변화를 초래하는 침습에 대한 생체의 방어 기전"이라고 정의하고 있다. 염증이 발생한 부위는 발적, 발열, 동통, 종창, 기능장애와 같은 염증의 5대 징후가 발생된다(Hong & Roh, 2005). 염증반응은 피부손상 및 노화의 주요 원인이며, 이 과정은 체내 세포 조직에 어떠한 기질적 변화를 가져오는 침습이 가해질 때, 생체가 재생이나 회복 등을 하기 위한 방어적 반응으로 나타나는 것이다(Park et al. , 2015). 이 과정에서 활성산소종(reactive oxygen species)의 일종인 NO는 nitric oxide synthase에 의해 형성 되는 저분자 라디칼로 기존에 알려진 염증 유발 뿐만 아니라 피부주름과 melanin 생성에도 중요하게 관여한다는 것이 밝혀지면서 천연물질을 이용한 NO의 생성 저해 연구가 활발히 진행되고 있다(Lee et al. , 2014).
피부 노화는 유전적 요인, 나이가 들어감에 따른 호르몬의 변화, 대사적 과정 등의 내적 요인과 오염된 환경, 야외활동 증가에 따른 장기적 자외선 노출과 사회활동에서 오는 스트레스 증가에 따른 활성산소의 증가 등 다양한 외적 요인이 피부 조직의 콜라겐과 엘라스틴을 변성시켜 피부 탄력을 저하시키고 피부 주름을 생성함으로써 피부 노화를 촉진한다(Yang et al. , 2016).
아로니아 베리(Aronia melanocarpa )는 장미과의 낙엽 관목으로 북아메리카에서 자생하며, black chokeberry로도 불린다. 최근에는 한국에서도 재배되고 있다. 아로니아 베리는 주로 안토시아닌과 같은 폴리페놀류, 플라보노이드 및 탄닌 등을 함유하고 있으며, 천연 항산화제 함량이 많은 기능성 식품으로 언급되고 있다. 안토시아닌 류는 특유의 색 때문에 천연 색소로도 이용되고 있다(Lee et al. , 2013).
아로니아 베리의 연구는 항산화(Hwang & Thi, 2014) 이외에도 항알레르기(Jeong, 2008), 주름개선(Kim et al. , 2014), 항염증 효과 (Yang et al. , 2015), 항비만 활성(Kim et al. , 2016), 화장품 소재로서 생리활성 연구(Shin & Choe, 2015), 아로니아 추출물을 이용한 모발의 염색 특성(Kim & Park, 2014), 아로니아 첨가에 따른 특성(Lee, 2017; Park et al. , 2015) 등이 보고 되었지만, 아로니아 잎에 대한 연구는 미비한 상태이다.
따라서 본 연구에서는 아로니아 잎을 이용하여 피부 미용분야에서의 항산화, 미백효과, 항염, 콜라겐 합성능을 확인하여 화장품 기능성 소재로서의 가능성 여부를 확인하고자 한다.
Methods
1. 시료조제
본 실험에 사용한 아로니아 잎은 전북 고창(Korea)에서 재배한 어린 잎을 따서 건조하여 시료로 사용하였다. 에탄올 추출(70% ethanol extraction, EE)은 아로니아 잎 10 g에 70% 에탄올 1 L를 이용하여 60℃ 온도 조건에서 24 h 동안 추출하였으며, 열수 추출(hot water, HE)은 아로니아 잎 10 g에 증류수 1 L를 이용하여 90℃ 온도 조건에서 24 h 동안 추출하였다. 추출액은 여과지(Whatman No. 2; GE Healthcare Life Sciences, USA)를 사용하여 여과하였고, 감압농축기(EYELA N-1000; Tokyo Rikakikai, Japan)를 이용하여 감압농축한 후 동결건조(FD5508; IlshinBioBase, Korea)하여 냉동 보관하였다.
2. 세포주 및 세포배양
본 실험에 사용한 B16F10 mouse melanoma 세포, 마우스의 RAW 264.7 대식세포 그리고 HDF 세포는 한국세포주은행(Korea)에서 구입하였다. B16F10 melanoma 세포는 Minimum Essential Medium (MEM; GibcoTM, USA), RAW 264.7 대식세포와 HDF 세포는 Dulbecco's Modified Eagle's Medium (DMEM; GibcoTM)에 각각 10% fetal bovine serum (FBS; Invitrogen, USA)과 1% streptomycin/penicillin (PEST; Hyclone, USA)을 넣어 배양액으로 각각 37℃, 5% CO2의 습윤화된 incubator에서 적응시켜 배양하였다.
3. 폴리페놀 함량 분석
폴리페놀 함량은 Folin & Denis (1915) 방법에 따라, 추출물(1 mg/mL) 50 μL에 증류수 650 μL 넣고 Folin-Denis reagent (Sigma-Aldrich, USA)를 50 μL 가하여 3 min 동안 실온에서 반응시킨다. 반응시킨 후 10% sodium carbonate (Na2CO3; Sigma-Aldrich) 포화용액을 100 μL 첨가하고, 최종 볼륨을 1 mL 맞추기 위해 증류수 150 μL 넣어 잘 혼합시켰다. 37℃ water bath에 1 h 반응시킨 후 UV-Vis spectrophotometer (Ultrospec 2000; Pharmacia Biotech, Sweden)을 이용하여 725 nm에서 흡광도를 측정하였다. 표준곡선은 tannic acid (Sigma-Aldrich) 농도 0-500 μg/mL이 되도록 하고 이로부터 총 폴리페놀 함량을 구하였다.
4. 플라보노이드 함량 분석
플라보노이드 함량은 추출물(1 mg/mL) 100 μL에 1 mL diethylene glycol (Sigma-Aldrich)을 첨가하고, 다시 1 N sodium hydroxide (NaOH; Sigma-Aldrich) 100 μL 넣어 잘 혼합시켜 37℃ water bath에 1 h 반응시킨 후 UV-Vis spectrophotometer을 이용하여 420 nm에서 흡광도를 측정하였다. 표준곡선은 naringin (Sigma-Aldrich) 농도를 0-300 μg/mL 되도록 하여 작성하고 이로부터 총 플라보노이드 함량을 구하였다.
5. DPPH radical 소거작용 측정
DPPH (Sigma-Aldrich) radical을 이용한 항산화 활성은 Blois (1958)의 방법을 약간 변형하여 사용하였다. 1 mM DPPH 용액 100 μL와 추출물(12.5-400 μg/mL)을 100 μL씩 취하여 혼합한 후 30 min 암 상태에서 방치한 후 잔존 radical 농도를 SpectraMAX 190 Microplate Reader (Molecular Devices, USA)를 이용하여 517 nm에서 측정하였다. 활성 비교를 위하여 항산화 물질로 잘 알려진 butylated hydroxyanisole (BHT), ascorbic acid (vitamin C)와 비교하였다. 전자공여능(%)은 [1-(시료의 흡광도/대조군의 흡광도)]×100에 의하여 산출하였다.
6. MTT assay를 이용한 세포독성 측정
B16F10 melanoma 세포와 RAW 264.7 대식세포 그리고 HDF 세포의 생존율 측정은 Mosmann (1983) 방법에 의하여 실시하였다. 96-well plate의 각 well에 logarithmic phase에 도달한 세포를 1×105 cells/well의 농도가 되도록 조절하여 분주하고, 24 h 배양하여 부착화 및 안정화를 시행하였다. 24 h 배양이 끝난 후 추출물을 최종 농도 5-200 μg/mL가 되도록 배양액에 희석하여 부착 및 안정화된 세포에 공급하고 24-48 h 동안 배양하였다. 배양완료 후 각 well에 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) 용액(5 mg/mL in phosphate buffered saline)을 10 μL씩 가해주고, 다시 37℃, 5% CO2의 습윤 배양기에서 4 h 동안 반응하여 MTT가 환원되도록 하였다. 각 well에 생성된 formazan 결정을 dimethyl sulfoxide 150 μL로 잘 녹여서 SpectraMAX 190 Microplate Reader를 이용하여 540 nm에서 흡광도를 측정하였다.
7. B16F10 melanoma 세포에서 tyrosinase 저해활성 및 melanin 저해율 측정
Tyrosinase 저해활성 측정은 B16F10 melanoma 세포를 24-well plate에 각 well 당 1×105 cells/well을 가하여 배양기에서 24 h 동안 배양하여 안정화시켰다. 배양 후 아로니아 잎 추출물을 농도 별로 처리하여 48 h 배양한 후 배지를 PBS로 2번 세척하였다. 1% (W/V) Triton X-100 (Sigma-Aldrich)을 10 mM sodium phosphate buffer pH 6.8로 만들어 150 μL로 세포를 모은 다음에 2000 rpm에서 5 min 원심분리 해서 각각의 상층액 40 μL에 기질인 3,4-dihydroxy-L-phehylalanine (L-DOPA; Sigma-Aldrich) 200 μL을 가해 37℃에서 1 h 배양하였다. SpectraMAX 190 Microplate Reader를 이용하여 dopa chrome의 양을 490 nm에서 흡광도 측정하였다.
Melanin 저해율은 원심 분리한 pellet을 이용하여 농도 별로 1N NaOH 100 μL에 증류수 200 μL를 가해서 60℃에서 1 h 배양한 다음 완전히 녹인 후, SpectraMAX 190 Microplate Reader를 이용하여 405 nm에서 흡광도를 측정하였다.
8. α-MSH 유도에 의한 tyrosinase 저해활성 및 melanin 저해율 측정
외부자극에 따른 B16F10 melanoma 세포 내 tyrosinase의 활성 및 과생성 멜라닌에 아로니아 잎 추출물이 영향을 미치는지 알아보기 위해 외부자극제로 α-MSH (Sigma-Aldrich) 0.5 mM을 사용하였다. 24-well plate에 각 well당 세포를 1×105 cells/well로 접종한 후 37℃, 5% CO2 incubator에서 24 h 동안 배양을 하였다. 배지를 제거하고 아로니아 잎 추출물 20, 50, 100 μg/mL 농도로 전 처리하고 1 h 후 α-MSH (0.5 mM)를 세포에 처리하여 48 h 배양 후, tyrosinase 활성도 및 과생성 멜라닌의 생성량을 측정함으로써 외부자극제에 따른 멜라닌화에 대한 추출물의 영향을 알아보았다.
9. Nitrite 양의 측정
RAW 264.7 대식세포로부터 생성된 NO의 양은 Griess (Sigma-Aldrich) 시약을 이용하여 세포배양액 중에 존재하는 NO2-의 형태를 측정하였다. 96-well plate에 각 well당 1×105 cells/mL의 RAW 264.7 대식세포가 들어있는 부유액 100 μL를 접종하고, 24 h 배양한 후 배지를 제거하고, 무혈청 배지에 최종 농도가 각각 5, 10, 20, 50 μg/mL으로 되도록 시료를 처리한 후 염증 반응 유도 인자인 LPS 1 μg/mL를 처리하여 24 h 배양하였다. 세포배양 상등액과 동량의 griess 시약을 혼합하여 96-well plate에서 10 min 동안 반응시킨 후, SpectraMAX 190 Microplate Reader를 사용하여 540 nm에서 흡광도를 측정하였다. Nitrite의 농도는 sodium nitrite (NaNO2)와 비교하였다.
10. ELISA kit를 이용한 콜라겐 합성량 측정
Procollagen type I 콜라겐 합성량은 ELISA Kit (MK101; Takara Bio Inc., Japan)를 사용하여 측정하였다. HDF 세포를 24-well plate에 각 well당 5×104 개를 깔고, 10% FBS를 첨가한 DMEM 배지에 추출물을 첨가하여 48 h 동안 배양하고, 상층액을 회수하였다. 그 후 회수된 상층액을 이용하여 Kit에서 제공된 96-well plate에 coating하고, 4℃에서 세척하여, 3% bovine serum albumin (BSA in TPBS)를 넣고 2 h blocking 하였다. Primary antibody인 anti-collagen antibody를 37℃에서 90 min 처리한 후 TPBS로 3회 세척하였다. Secondary antibody인 anti-mouse IgG (whole mouse, alkaline phosphatase conjugated)를 90 min 반응시킨 후 TPBS로 3회 세척하였다. Alkaline phosphatease substrate solution [1 mg/mL p-nutrophenyl phosphate (PNPP) in diethanolamine buffer)] 상온에서 30 min 반응시킨 후 SpectraMAX 190 Microplate Reader를 이용하여 405 nm에서 흡광도를 측정하였다.
11. 통계분석
본 연구의 모든 실험 결과는 3회 이상 반복하여 평균값으로 결과값을 도출하여 ANOVA 검정을 적용하였다. 대조군과 실험군 간의 결과는 mean±standard deviation (M±S.D.)로 나타냈으며 Student's t-test로 통계처리의 유의성을 검정하였다.
Results and Discussion
1. 총 폴리페놀 및 플라보노이드 함량
폴리페놀계 물질들은 식물체에 특수한 색깔을 부여하고 산화환원반응에서 기질로 작용한다. 또한 폴리페놀계 물질들은 한 분자 내에 2개 이상의 phenolic hydroxyl (OH)기를 가진 방향족 화합물들을 가르키며, 플라보노이드와 탄닌이 주성분으로 충치예방, 고혈압 억제, 항에이즈, 항산화, 항암 등의 다양한 생리활성을 가진다(Park et al., 2008).
본 실험에서 사용한 아로니아 잎 에탄올, 열수 추출물 1 mg/mL 농도에서 총 폴리페놀 함량은 tannic acid를 표준 곡선으로 하여 측정한 결과, 167.46±1.03, 79.04±1.01 μg/mL으로 나타났다(Table 1). 플라보노이드는 방향족 폴리페놀로서 크게 isoflavones, chalcones, flavanones, flavones, flavonols, flavanon-3-ols, anthocyanidins, flavan-3-ols, proanthocyanidins, flavans, flavan-3,4-diols 및 dihydrochalcones의 13가지로 분류되며 생체 내 산화작용을 억제한다고 알려져 있다. 이 성분은 항산화력을 나타내는 지표라고 할 수 있으며, 면역조절제로 사용되어 왔고, 최근 항균작용, 항진균 바이러스작용, 혈관계 조절작용, 강장작용, 항염증작용, 항암작용 등의 다양한 생리활성이 밝혀지고 있다(Kim & Jang, 2016). Naringin을 표준 곡선으로 측정한 아로니아 잎 에탄올, 열수 추출물 1 mg/mL 농도에서 총 플라보노이드 함량은 각각 105.15±1.22, 52.21±1.13 μg/mL로 나타났다(Table 1).
2. DPPH radical 소거 활성
DPPH법은 항산화능을 측정하는 방법 중 하나로, DPPH가 517 nm에서 특이적인 흡수 band를 갖는 비교적 안정한 free radical이라는 특성을 이용한다. 보라색의 DPPH가 항산화능을 가진 물질로부터 전자나 hydrogen radical을 받으면 환원되어 노란색으로 탈색되고, 그 감소를 흡광도로 측정한다(Pak et al. , 2016). 아로니아 잎 에탄올, 열수 추출물을 농도 별(12.5-400 μg/mL)로 DPPH 용액에 첨가하여 free radical 소거 활성 능력을 측정한 결과, 에탄올 추출물은 12.20, 22.18, 30.72, 45.14, 66.35, 80.12%의 소거능이, 그리고 열수 추출물은 9.12, 18.28, 22.24, 35.34, 56.25, 68.52%의 소거능이 확인 되었다(Figure 1).
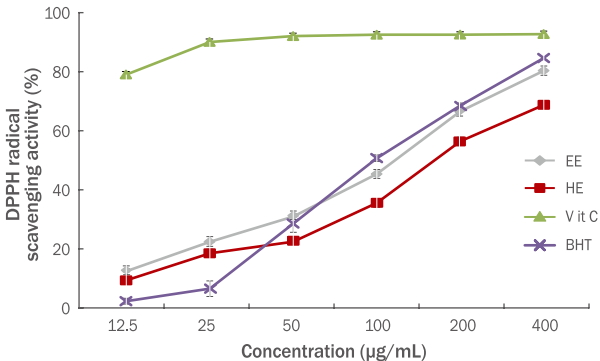
DPPH radical scavenging activities of A. melanocarpa leaf extracts.
DPPH radical scavenging assays were conducted to investigate the anti-oxidant effects of A. melanocarpa leaf in EE and HE at varying concentration levels of 12.5, 25, 50, 100, 200, and 400 μg/mL, respectively. DPPH, 1,1-diphenyl-2-picrylhydrazyl; EE, 70% ethanol extracts; HE, hot water extracts; Vit C, ascorbic acid; BHT, butylated hydroxytoluene group; A. melanocarpa, Aronia melanocarpa.
3. 아로니아 잎 추출물의 미백효과
1) B16F10 melanoma 세포의 세포 생존율 분석결과
아로니아 잎 에탄올, 열수 추출물이 B16F10 melanoma 세포주의 세포 생존율에 미치는 영향을 알아보기 위하여 각각 5, 10, 20, 50, 100, 200 μg/mL의 농도로 2 일 동안 처리하고 배양한 후 MTT 방법으로 세포의 생존율을 관찰하였다. Figure 2에서 보는 바와 같이 대조군의 세포 생존율을 100%로 하였을 때, 아로니아 잎 추출물은 100 μg/mL 이하 농도범위에서 90% 이상의 생존율이 확인되었으므로 아로니아 잎 추출물 모두 100 μg/mL 농도 범위에서 세포독성을 보이지 않았다. 따라서 아로니아 잎 에탄올, 열수 추출물 5, 10, 20, 50, 100 μg/mL 농도에서 미백효과 측정 시 세포 사멸에 큰 영향을 주지 않는 것으로 분석되었다.

Effect of A. melanocarpa leaf extracts on the cell viability of the mouse melanoma cell line B16F10.
B16F10 melanoma cells were incubated with A. melanocarpa leaf extracts at varying concentration levels (5, 10, 20, 50, 100, and 200 μg/mL) for 24 h and cell viability was measured using the MTT assay. Values represent the M±S.D. of three independent experiments. Statistically significant differences are indicated with an asterisk (* p<0.05, compared with untreated control cells). EE, 70% ethanol extracts; HE, hot water extracts; A. melanocarpa, Aronia melanocarpa; MTT, 3-(4,5-dimethylthiazol-2-yl)-2,5- diphenyltetrazolium bromide; M±S.D., mean±standard deviation.
2) B16F10 melanoma 세포에서 tyrosinase 저해활성 및 melanin 저해율
피부는 자외선에 노출되면 tyrosine에서 출발하여 일련에 산화 중합 반응을 거쳐 생성된 melanin에 의해 기미, 노인성 홍반 등을 유발하며 피부 노화가 촉진된다. 이 과정에서 중요하게 작용하는 효소가 tyrosinase이며, tyrosinase 효소의 억제는 멜라닌 생합성을 억제할 수 있는 것으로 알려져 있다(Kim et al, . 2011). 아로니아 잎 추출물의 B16F10 melanoma 세포의 세포내 tyrosinase 활성 저해 효과를 측정한 결과 Figure 3과 같다. 양성대조군인 arbutin은 25% tyrosinase 활성이 저해 되었으며, 아로니아 잎 에탄올 추출물과 열수 추출물은 100 μg/mL의 농도에서 각각 21%, 18%의 저해활성이 확인되었고, 50 μg/mL의 농도에서 각각 18%, 4%의 저해활성이 확인되었다.

Inhibitory effect of A. melanocarpa leaf extracts on the tyrosinase activity in the mouse melanoma cell line B16F10.
B16F10 melanoma cells were seeded at 1×105 cells/well. After 24 h, cells were treated with varying concentrations of A. melanocarpa leaf extracts cultured for 48 h. The tyrosinase activity was measured at 490 nm. Arbutin (250 μM) was used as a positive control. Values represent the M±S.D. of three independent experiments. Statistically significant differences are indicated with asterisks (* p<0.05, **p<0.01 compared with untreated control cells). EE, 70% ethanol extracts; HE, hot water extracts; A. melanocarpa, Aronia melanocarpa; M±S.D., mean±standard deviation.
멜라닌 색소의 생합성은 tyrosinase 효소를 비롯하여 다양한 효소들에 의해 조절되고 있어 아로니아 잎 에탄올, 열수 추출물의 멜라닌 생합성 저해 정도를 확인한 결과 Figure 4와 같다. 양성대조군인 arbutin은 멜라닌을 28% 저해하였으며, 아로니아 잎 에탄올과 열수 추출물은 100 μg/mL의 농도에서 각각 멜라닌을 24%, 18% 저해하였고, 50 μg/mL의 농도에서 각각 멜라닌을 20%, 14% 저해하였다.
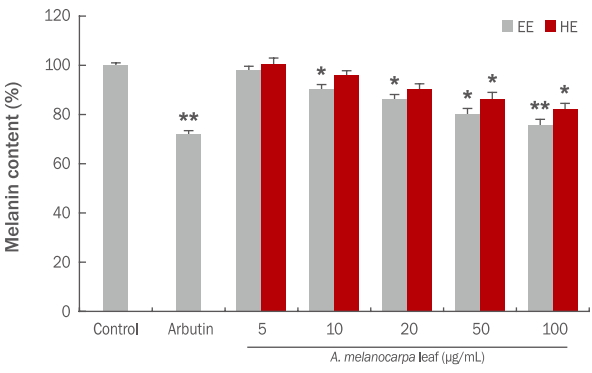
Effect of A. melanocarpa leaf extracts on melanin synthesis in the mouse melanoma cell line B16F10.
B16F10 melanoma cells were seeded at 1×105 cells/well. After 24 h, cells were treated with varying concentrations of A. melanocarpa leaf extracts cultured for 48 h. The melanin content was measured at 405 nm. Arbutin (250 μM) was used as a positive control. Values represent the M±S.D. of three independent experiments. Statistically significant differences are indicated with asterisks (* p<0.05, **p<0.01 compared with untreated control cells). EE, 70% ethanol extraction; HE, hot water extraction; A. melanocarpa, Aronia melanocarpa; M±S.D., mean±standard deviation.
3) α-MSH 유도에 의한 tyrosinase 저해활성 및 melanin 저해율
α-MSH는 melanocyte의 세포막에 존재하는 melanocortin 1 receptor (MC1-R)을 통해 adenylate cyclase를 활성화시켜 세포내 cyclic adenosine monophosphate (cAMP)의 양을 증가시키고, 순차적으로 protein kinase A (PKA)를 활성화시켜 tyrosinase의 발현을 유도하거나 발현된 tyrosinase의 활성을 유도하는 것으로 알려져 있다(Hong et al. , 2005). 아로니아 잎 에탄올, 열수 추출물이 α-MSH에 의해 유도된 B16F10 melanoma 세포의 tyrosinase 저해활성 및 melanin 합성에 미치는 영향을 확인하기 위하여 10, 20, 50, 100 μg/mL 농도로 전 처리하고 1 h 후 α-MSH 0.5 mM를 세포에 처리하여 48 h 배양 후, tyrosinase 활성도 및 과생성 멜라닌의 생성량을 측정함으로써 외부자극제에 따른 멜라닌화에 대한 추출물의 영향을 알아보았다.
실험 결과 B16F10 melanoma 세포에 0.5 mM의 α-MSH를 투여하였을 때 대조군에 비하여 tyrosinase 활성도가 81% 증가하였다. 아로니아 잎 에탄올, 열수 추출물은 100 μg/mL 처리시 α-MSH군에 비하여 tyrosinase 활성도가 각각 51%, 36% 감소하였으며, 양성대조군인 arbutin은 61% 감소하였다(Figure 5).
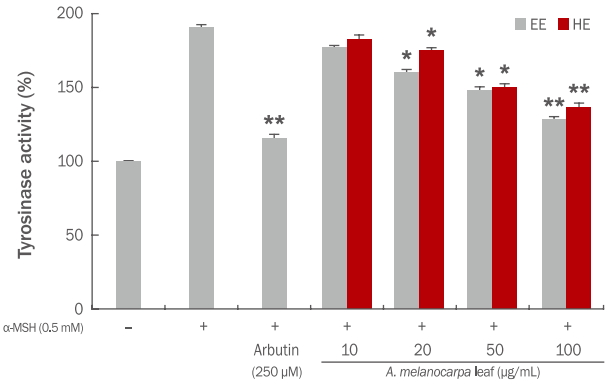
Inhibitory effect of A. melanocarpa leaf extracts on tyrosinase activity in the mouse melanoma cell line B16F10 stimulated using 0.5 mM α-MSH.
B16F10 melanoma cells were seeded at 1×105 cells/well. After 24 h, cells were treated with varying concentrations of A. melanocarpa leaf and α-MSH for 48 h. Then, tyrosinase activity was measured at 490 nm. Arbutin (250 μM) was used as a positive control. Values represent the M±S.D. of three independent experiments. Statistically significant differences are indicated with asterisks (* p<0.05, **p<0.01 compared with α-MSH treated cells). EE, 70% ethanol extracts; HE, hot water extracts; A. melanocarpa, Aronia melanocarpa; α-MSH, α-melanocyte-stimulating hormone; M±S.D., mean±standard deviation.
Melanin 저해율 측정 결과, B16F10 melanoma 세포에 0.5 mM의 α-MSH를 투여하였을 때 대조군에 비하여 멜라닌 생성량이 92% 증가하였다. 아로니아 잎 에탄올, 열수 추출물은 100 μg/mL 처리시 α-MSH군에 비하여 각각 63%, 54%의 멜라닌 생성이 감소하였으며, 양성대조군인 arbutin은 76% 감소하였다(Figure 6).

Inhibitory effect of A. melanocarpa leaf extracts on melanin synthesis in the mouse melanoma cell line B16F10 stimulated by 0.5 mM α-MSH.
B16F10 melanoma cells were seeded at 1×105 cells/well. After 24 h, cells were treated with varying concentrations of A. melanocarpa leaf extracts and α-MSH cultured for 48 h. Melanin contents were measured at 405 nm. Arbutin (250 μM) was used as a positive control. Values represent the M±S.D. of three independent experiments. Statistically significant differences are indicated with asterisks (* p<0.05, **p<0.01 compared with α-MSHtreated cells). EE, 70% ethanol extraction; HE, hot water extraction; A. melanocarpa, Aronia melanocarpa; α-MSH, α-melanocytestimulating hormone; M±S.D., mean±standard deviation.
4. 아로니아 잎 추출물의 항염증 효과
1) 세포 생존율 분석결과
아로니아 잎 에탄올, 열수 추출물을 각각 5-200 μg/mL의 농도로 Raw 264.7 대식세포에 처리하여 MTT assay를 진행한 결과는 다음과 같다(Figure 7). 아로니아 잎 에탄올, 열수 추출물은 100 μg/mL 이하 농도범위에서 90% 이상의 생존율이 확인되었으므로 아로니아 잎 추출물 모두 100 μg/mL 농도 범위에서 유의할만한 세포독성을 보이지 않았다. 따라서 아로니아 잎 에탄올, 열수 추출물 5-100 μg/mL 농도에서는 항염증 측정 시 세포사멸에 큰 영향을 주지 않은 것으로 분석 되었다.

Effects of A. melanocarpa leaf extracts on the viability of RAW 264.7 cells.
RAW 264.7 cells were incubated with A. melanocarpa extracts at varying concentration levels (5, 10, 20, 50, 100, and 200 μg/ mL) for 24 h. Values represent the M±S.D. of three independent experiments. Statistically significant differences are indicated with an asterisk (* p<0.05, compared with control). EE, 70% ethanol extracts; HE, hot water extracts; A. melanocarpa, Aronia melanocarpa; M±S.D., mean±standard deviation.
2) Nitric oxide 생성억제 효과
활성산소 중 하나이며, 최근 염증 유발에 중요한 역할을 하는 것으로 알려진 nitric oxide (NO) 생성에 대한(Jeoung et al. , 2009) 아로니아 잎 추출물의 효과를 알아보기 위하여 RAW 264.7 대식세포에 LPS로 자극을 주고, 아로니아 잎 에탄올, 열수 추출물을 처리하여 실험을 진행하였다. 생성된 NO 양은 griess 시약을 이용하여 세포배양액 중에 존재하는 NO2-를 측정하여 확인하였다. 아로니아 잎 추출물의 처리 농도는 세포 생존율 측정 결과에 따라 세포에 영향을 미치지 않는 농도인 5-100 μg/mL로 처리하였다. LPS (1 μg/mL) 처리 후 NO의 생성량은 세포만 배양하였을 때에 비하여 약 127배 이상 증가되었다. 아로니아 잎 에탄올, 열수 추출물은 100 μg/mL 농도에서 각각 8.15, 10.25 μM NO 생성량이 측정되어, NO 생성 억제에 따른 높은 항염증 활성을 가지는 것을 알 수 있었다(Figure 8).
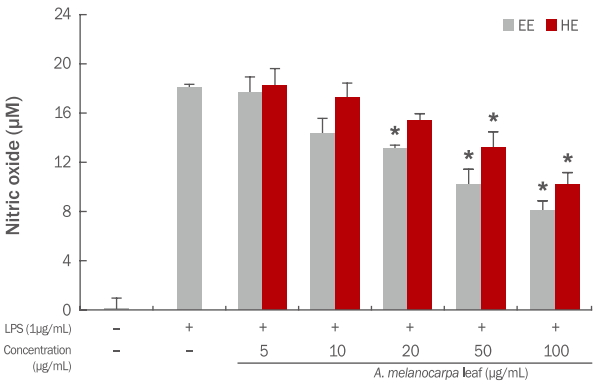
Effects of A. melanocarpa leaf extracts on NO production in LPS-stimulated RAW 264.7 cells.
RAW 264.7 cells were treated with varying concentrations of A. melanocarpa leaf extracts for 1 h, and stimulated with or without LPS (1 μg/mL) for 24 h. NO concentration in the medium was determined using Griess assay. Results are represented as M±S. D. of the three independent experiments. Statistically significant differences are indicated with asterisks (* p<0.05, **p<0.01, compared with control). EE, 70% ethanol extracts; HE, hot water extracts; LPS, lipopolysaccharide; A. melanocarpa, Aronia melanocarpa; NO, nitric oxide; M±S.D., mean±standard deviation.
5. 아로나이 잎 추출물의 주름개선 효과
1) 세포 생존율 분석결과
아로니아 잎 에탄올, 열수 추출물을 각각 5-200 μg/mL의 농도로 HDF 세포에 처리하여 MTT assay를 진행한 결과는 다음과 같다(Figure 9). 아로니아 잎 에탄올, 열수 추출물은 모든 농도에서 90% 이상의 생존율이 확인되었으므로 아로니아 잎 추출물 모두 200 μg/mL 농도 범위에서 유의할만한 세포독성을 보이지 않았다. 따라서 아로니아 잎 에탄올, 열수 추출물 5-200 μg/mL 농도에서 procollagen 합성 실험을 진행하였다.

Effects of A. melanocarpa leaf extracts on the viability of HDF cells.
Human dermal fibroblasts were incubated with A. melanocarpa leaf extracts at varying concentration levels (5, 10, 20, 50, 100, and 200 μg/mL) for 48 h and cell viability was measured using MTT assay. Results are represented as M±S.D. of the three independent experiments. Statistically significant differences are indicated with an asterisk (* p<0.05, compared with control). EE, 70% ethanol extraction; HE, hot water extraction; A. melanocarpa, Aronia melanocarpa; MTT, 3-(4,5-Dimethylthiazol-2-yl)-2,5- diphenyltetrazolium bromide; M±S.D., mean±standard deviation.
2) Procollagen의 합성량 측정
피부의 대표적인 탄력 섬유인 콜라겐(collagen)은 엘라스틴(elastin)과 함께 망상으로 조직되어, 약 1,500개 정도의 아미노산으로 구성된 독특한 삼중 나선 구조를 이루고 있다. 이들 섬유아조직 아미노산은 과도하게 생성된 활성산소 종으로 인하여 콜라겐과 엘라스틴 등의 탄력섬유에 지질 과산화가 일어나 비정상적인 교차결합 및 사슬절단이 발생하게 되므로 표면적 노화현상을 나타내게 된다(Yang, 2012). 콜라겐은 피부에서 주름 형성과 밀접한 연관이 있다고 알려져 있고 콜라겐이 부족할 경우 주름을 유발할 수 있다. 콜라겐은 전구물질인 procollagen의 형태로 합성되며, 콜라겐 중합반응 시 콜라겐 분자로부터 절단 및 분리된다고 알려져 있다. 즉 프로펩타이드의 양을 측정하여 세포내에서의 콜라겐 생합성 정도를 파악할 수 있다(Lee et al. , 2015). 콜라겐의 합성량 측정은 HDF 세포에 아로나아 잎 에탄올, 열수 추출물을 처리하여 procollagen type I C-peptide (PICP)의 함량을 ELISA kit를 이용하여 측정하였다. 그 결과는 Figure 10과 같다. Transforming growth factor beta 1 (TGF-β) 20 ng/mL로 처리하였을 경우 음성 대조군에 비해 procollagen 합성이 62% 증가 하였으며, 아로니아 잎 에탄올, 열수 추출물 200 μg/mL로 처리하였을 경우 procollagen 합성이 각각 58%, 41% 증가하였다. 아로니아 잎 추출물은 양성대조군 보다는 낮은 procollagen 합성이 확인 되었지만 HDF 세포의 procollagen 합성이 증가함을 확인 할 수 있었다.
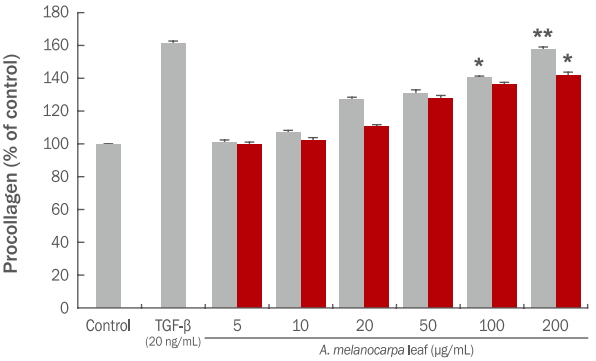
Effects of A. melanocarpa leaf extracts on procollagen synthesis in HDF cells.
Human dermal fibroblasts were treated with A. melanocarpa leaf extracts for 48 h, and procollagen synthesis was determined as described in Materials and Methods. TGF-β (20 ng/mL) was used as a positive control. Values represent the M±S.D. of three independent experiments. Statistically significant differences are indicated with asterisks (* p<0.05, **p<0.01, compared with untreated control cells). EE, 70% ethanol extracts; HE, hot water extracts; TGF-β, transforming growth factor beta 1; A. melanocarpa, Aronia melanocarpa; HDF, human dermal fibroblasts; M±S.D., mean±standard deviation.
Conclusion
본 연구는 아로니아 잎을 70% 에탄올 및 열수로 추출하여 기능성 화장품 소재로서의 가능성을 확인하고자 하였다. 추출물의 항산화 효과를 확인하기 위하여 총 폴리페놀과 총 플라보노이드 함량을 측정하였으며, DPPH radical 소거 활성을 측정하였다. B16F10 mouse melanoma 세포주를 사용하여 미백효과를 측정하였다. 마우스의 RAW 264.7 대식세포에 LPS를 처리하여 NO 억제 효과를 확인 하였으며, HDF 세포에서 ELISA kit를 이용하여 콜라겐 합성량을 측정하였다.
아로니아 잎 에탄올 추출물과 열수 추출물의 총 폴리페놀과 총 플라보노이드 함량을 측정한 결과, 에탄올 추출물에서 각각 167.46±1.03 (총 폴리페놀), 105.15±1.22 (총 플라보노이드) μg/mL으로 높게 나타났으며, DPPH radical 소거 활성에서도 에탄올 추출물이 400 μg/mL의 농도에서 80.12%의 소거능이 확인되었다. 아로니아 잎 추출물이 B16F10 세포에 미치는 영향을 분석하기 위해 세포 생존율을 측정한 결과, 100 μg/mL 이하의 농도에서는 90% 이상의 생존율이 확인되어 5, 10, 20, 50, 100 μg/mL 농도에서 미백효과를 측정하였다. 아로니아 잎 에탄올 추출물 100 μg/mL 농도에서 tyrosinase 저해활성 및 멜라닌 생성 저해율은 21%, 24%의 효과가 확인 되었다. α-MSH 유도에 의한 tyrosinase 저해활성 및 멜라닌 생성 저해율도 아로니아 에탄올 추출물이 효과가 더 높게 확인되었다.
RAW 264.7 대식세포에 독성을 미치지 않은 100 μg/mL 이하의 농도로 NO 생성 억제 효과를 측정한 결과, 아로니아 잎 에탄올 추출물이 열수 추출물 보다 높게 NO 생성을 감소시키는 것으로 나타났다. 아로나이 잎 에탄올, 열수 추출물은 200 μg/mL 농도에서 각각 58%, 41%의 procollagen 합성이 증가하여 양성대조군 보다는 낮은 procollagen 합성이 확인되었지만 HDF 세포에서 procollagen 합성을 증가하는 효과를 확인 할 수 있었다.
이상의 결과를 통해 아로니아 잎은 에탄올 추출물이 열수 추출물 보다 항산화, 미백, 항염증 효과가 우수하였고 그리고 콜라겐 합성 효과를 확인되어, 기능성 화장품 소재로서의 활용가능성을 제시 할 수 있었다.