자외선 B에 의해 손상된 인간 각질형성세포(HaCaT)에 대한 Syringic Acid의 염증 억제 및 콜라겐 생성 효과
Anti-inflammatory and Collagen Production Effect of Syringic Acid on Human Keratinocyte (HaCaT) Damaged by Ultraviolet B
紫丁香酸对UVB诱导损伤的人角质形成细胞(HaCaT)的炎症抑制和胶原蛋白生成作用
Article information
Abstract
목적
본 연구는 자외선 B로 인해 손상된 인간 각질형성세포(HaCaT)에 대한 syringic acid의 염증 억제 및 콜라겐 생성 효과를 확인하여 기능성 화장품 소재로서 활용 가능성을 알아보기 위함이다.
방법
Syringic acid의 염증 억제 및 콜라겐 생성과 관련된 유전자 발현은 quantitative real-time polymerase chain reaction (qRT-PCR)을 통해 확인하였고, ELISA 분석으로 type I procollagen의 생성량 변화를 확인하였다.
결과
Syringic acid는 자외선 B로 인해 손상된 인간 각질형성세포(HaCaT)에서 염증과 관련된 유전자인 interleukin 6 (IL6), interleukin 1 beta (IL1β), cyclooxygenase 2 (COX2) 및 tumor necrosis factor alpha (TNFα)의 발현을 농도의존적으로 감소시켰다. 또한 콜라겐 전구체인 procollagen type I의 유전자 발현을 농도의존적으로 증가시켰으며 결과적으로 procollagen type I의 생산량도 농도의존적으로 증가시켰다.
결론
본 연구를 통하여 syringic acid는 농도의존적으로 자외선 B에 의해 손상된 인간 각질형성세포의 염증을 억제하고, 피부 내 콜라겐 생성을 증가시킬 수 있는 천연유래 phytochemical 화장품 원료로서 활용가능하리라 사료된다. 다만 실제 화장품 원료로 피부에 적용하기 위해서는 추가적인 인체 대상 실험이 필요할 것으로 보인다.
Trans Abstract
Purpose
The objective of this study is to examine the applicability of syringic acid as a cosmeceutical ingredient by examining its effects of inflammation suppression and collagen production for HaCaT (Cultured Human Keratinocyte) damaged by ultraviolet B.
Methods
The gene expressions of syringic acid related to inflammation suppression and collagen production were confirmed through the quantitative real-time polymerase chain reaction (qRT-PCR). Changes in type I procollagen production were confirmed through the ELISA analysis.
Results
Syringic acid reduced the expressions of the inflammation related genes-interleukin 6 (IL6), interleukin 1 beta (IL1β), cyclooxygenase 2 (COX2) and tumor necrosis factor alpha (TNFα)-in HaCaT damaged by ultraviolet B in a concentration dependent manner. It also increased the gene expression of the collagen precursor, procollagen type I, in the same manner, consequently increasing the production of procollagen type I in a concentration dependent manner.
Conclusion
This study demonstrated the applicability of syringic acid as a natural phytochemical cosmeceutical ingredient that can suppress inflammation and produce collagen for HaCaT damaged by ultraviolet B in a concentration dependent manner. However, further human tests will be required to apply it to human skin as an actual cosmeceutical ingredient.
Trans Abstract
目的
探讨丁香酸对UVB损伤的人角质形成细胞(HaCaT)炎症抑制作用和胶原蛋白生成效果,从而确认丁香酸作为功能性化妆品原料适用可行性。
方法
通过定量实时聚合酶链反应(qRT-PCR)确认与炎症抑制和胶原产生有关的丁香酸的基因表达。通过ELISA分析确认type I procollagen生成量变化。
结果
丁香酸以浓度依赖性方式降低紫外线B损伤的HaCaT中炎症相关基因,如白细胞介素6(IL6 ),白细胞介素1β(IL1β ),环氧合酶2(COX2)和肿瘤坏死因子α(TNFα)的表达。另外,胶原前体I型前胶原的表达以浓度依赖性的方式增加,结果,I型前胶原的产生也以浓度依赖性方式增加。
结论
在本研究中,丁香酸可作为植物化学美容的原料,可以抑制紫外线B对人角质形成细胞的炎症反应,呈剂量依赖性,增加皮肤胶原蛋白的产生。然而,需要进一步的人体测试将其作为实际的药妆成分应用于人体皮肤。
Introduction
인간의 피부는 표피, 진피, 피하지방으로 구성되어 있으며, 이 중 표피를 구성하는 세포는 keratinocytes, melanocytes, langerhans cells, merkel cell 등이 있다(Boulais & Misery, 2008). 각질형성세포(keratinocytes)는 표피의 대부분을 차지하는 세포로서 다양한 사이토카인(cytokines)과 케모카인(chemokines)을 생산하는 등 피부의 면역 반응에 중요한 역할을 수행하며, 외부환경으로부터 신체 내부를 보호하거나 보습, 체온 조절과 외부 환경에 대한 장벽으로의 다양한 기능을 가지고 있다(Halliwell & Gutteridge, 1985; Rittié & Fisher, 2002). 태양광선을 비롯한 지속적인 외부 자극으로부터의 노출은 각질형성세포에 산화적 스트레스(oxidative stress) 및 손상을 일으킴으로 피부는 윤기가 없어지고, 탄력 저하와 주름 발생과 같은 피부노화현상이 나타나게 된다(Wong et al., 2007).
피부 노화는 유전에 의한 내인성 노화(intrinsic aging)와 UV와 같이 외부 환경에 의한 외인성 노화(extrinsic aging)로 분류할 수 있다(Naylor et al., 2011). 내인성 노화는 나이가 들어감에 따라 자연스럽게 신체기능이 저하되고, 세포의 대사과정으로부터 생성되는 reactive oxygen species (ROS)에 의해 발생하며(Rittié & Fisher, 2002; Yoon et al., 2013), 외인성 노화는 외부환경적 요인인 자외선, xenobiotics, 물리적 자극 등 여러가지 원인들에 의해 발생한다(Ma et al., 2001; Kulms et al., 2002; Rittié & Fisher, 2002). 외인성 노화의 주요 요인인 자외선은 단파장(200-209 nm)인 UVC, 중파장(290-320 nm)인 UVB, 장파장(320-400 nm)인 UVA로 나누어진다. 이 중 UVB는 기질금속단백질분해효소인 matrix metalloproteinase (MMPs)의 생산을 유도하고, 피부 각질 세포 내 DNA 손상과 조직의 산화적 스트레스(oxidative stress)를 유발하는(Ma et al., 2001) 광노화의 주요 원인이다(Cascinelli et al., 1994; Kalbina & Strid, 2006).
페놀화합물, 카로티노이드, 탄닌, 이소프렌 등과 같은 식물 추출물에는 항독, 항균, 항염, 항산화 등과 같은 다양한 작용을 하는 생리활성 물질이 들어있다(Ma et al., 2003). 특히 폴리페놀로도 잘 알려져 있는 페놀 화합물은 수산기를 비롯하여 카르복실기, 메틸기 등을 가지고 있어 항산화 효과는 물론이고 항암효과를 나타내기도 한다(Ferguson, 2001; Kolodziej et al., 2001). 페놀화합물 중 하나인 syringic acid는 여러 과일류 특히 아사이베리나 그 오일 등에 많이 함유되어 있으며(Pacheco-Palencia et al., 2008), 항염, 항암 작용(Lü et al., 1998; Sun et al., 2002; Rekha et al., 2014)을 비롯한 선택적 독성(Ferguson, 2001; Goldberg et al., 1999; Shim et al., 1995) 및 항산화 작용(Srinivasan et al., 2014)에 관한 연구들이 보고되어 있다.
Syringic acid에 대한 의학, 약학, 생명 과학, 식품 과학 분야에서의 항염, 항암, 항산화 등의 효능 연구는 그 동안 많이 보고되어 있지만 향장 미용 분야에서 인간 피부 세포에 대한 연구는 극히 미미한 실정이다. 본 연구를 통해 syringic acid가 자외선 B에 의해 손상된 인간 각질형성세포(HaCaT)에 대한 염증 억제 및 콜라겐 생성 효능을 확인하여 노화 지연에 도움을 주는 천연 phytochemical 화장품 원료로서의 가능성을 확인해보고자 한다.
Methods
1. 세포배양
본 연구에 사용된 인간각질형성세포주인 HaCaT keratinocytes는 ATCC (USA)로부터 구매하여 사용하였고, 10% fetal bovine serum (FBS; HyClone™, GE Healthcare Life Sciences, UK)과 1% penicillin/streptomycin (penicillin 100 IU/mL, streptomycin 100 μg/mL; Invitrogen™, Thermo Fisher Scientific, USA)를 함유한 Dulbecco's modified Eagles medium (DMEM; HyClone™) 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다.
2. 시료 처리
Syringic acid는 순수 정제된 분말형태로 Sigma-Aldrich (USA)로부터 구매하였고, 실험에서는 dimethyl sulfoxide (DMSO; Sigma-Aldrich)에 용해시켜 사용하였다. 세포배양 접시에 HaCaT (1×106 cells/well)을 24 h 배양한 후 적정 농도의 syringic acid를 배지에 첨가하여서 6 h 동안 전 처리 하였으며 자외선 B (Ultraviolet B) 조사를 위해 UV-B lamp (UVP, USA)를 사용하였다. 자외선 B 파장은 Fiber Optic Spectrometer System USB2000 (Ocean Optics, USA)을 사용하여 측정하였다. 자외선 B 조사 전, 배지를 제거하기 위해, pH 7.4의 phosphate-buffered saline (PBS)를 사용하여 2회 세척 하였고, 세포 건조를 막기 위해 PBS 1 mL를 넣은 후 세포배양 접시의 뚜껑을 열고 자외선 B를 조사하였다. 그 후 PBS를 제거하고 새로운 배지를 첨가하여 24 h 추가 배양 후 실험에 사용하였다.
3. Quantitative real-time polymerase chain reaction (qRT-PCR)
Syringic acid에 의한 HaCaT 내에서 일어나는 유전자 발현 분석을 위하여 RNA 추출 후 cDNA를 만들어 원하는 유전자의 발현량을 quantitative real-time polymerase chain reaction (qRT-PCR)로 확인하였다. 배양이 끝난 세포를 TRIzol reagent (Invitrogen™)로 용해 후, 0.2 mL chloroform (Biopure, Canada)를 첨가한 후 상온에 방치, 12000 rpm, 4℃에서 20 min 동안 원심분리 하였다. 원심분리하여 얻은 단백질이 포함된 하등액과 mRNA이 포함된 상등액을 분리하여 상등액은 0.5 mL isopropanol을 첨가하였고 10 min간 상온에 방치, 12000 rpm, 4℃ 조건으로 원심분리하였다. RNA를 침전시키고, 75% ethanol을 이용하여 세척 한 후 ethanol을 제거하여 상온에서 건조시켰다. 건조시킨 mRNA는 diethylpyrocarbonate (DEPC; Biopure) water로 녹여서 실험에 사용하였고, 추출된 RNA는 nanodrop (Maestrogen, USA) 260 nm, 280 nm의 ratio 1.8 이상의 RNA 순도만 실험에 사용하였다. PCR tube에 1 μg RNA, 0.5 ng oligo dT18, DEPC water를 total 10 μL로 제조 한 후 70℃에서 10 min간 처리하였고, RNA 변성을 유도한 후 M-MLV reverse transcriptase (Enzynomics, Korea)로 37℃의 온도 조건에서 1 h 반응시켜 cDNA를 합성하였다.
qRT-PCR은 PCR tube에 0.2 μM primers, 50 mM KCl, 20 mM Tris/HCl pH 8.4, 0.8 mM dNTP, 0.5 U Extaq DNA polymerase, 3mM MgCl, 1X SYBR green (Invitrogen™)을 혼합하여 제조하였고, LineGene K (Hangzhou Bioer Technology, China)로 94℃에서 3 min간 denaturation (94℃, 30 s) 후, anealing (58℃, 30 s), polymerization (72℃, 30 s)을 40 cycle 수행하였다. PCR의 유효성은 melting curve로 검증하였으며 각 유전자의 발현은 β-actin 발현을 표준화하여 비교분석 하였다. 실험에 사용된 primer는 다음과 같다(Table 1).
4. Procollagen type Ⅰ 생산량 측정
ELISA (enzyme-linked immunosorbent assay)는 효소랑 기질 결합의 특이적 반응을 본 것으로 우리가 얻고자 하는 항원에 특이적으로 반응하는 항체를 가지고 측정하는 것으로 procollagen type Ⅰ의 생산량을 측정하였다.
Cell seeding 후 24 h 배양하고 세포에 시료와 자극처리를 한 뒤 다시 24 h 동안 배양한 후 cell culture medium만을 분리한다. Procollagen Type I C-Peptide (PICP) EIA Kit (Takara Bio, Japan)을 사용하여 실험을 진행하였다. MMP-1 monoclonal antibody가 고정화되어 있는 plastic cell culture dish well 표면에 배양배지를 각각 100 μL 각각 분주하여 상온에 2 h 반응을 시킨다. 1X washing buffer로 5번 헹구어 주고 horseradish peroxide (HRP)-conjugated anti-MMP-1 antibody를 100 μL 넣어 상온에서 1 h 반응 시킨 뒤 100 μL substrate (3,3, 5,5'-tetramethylbenzidine, TMB)를 넣고 상온, 암실에서 30 min간 추가로 반응시켰으며, 450 nm에서 흡광도를 측정하였다.
Anti-PIP (Procollagen Type I C-Peptide) monoclonal antibody-coated plate에 배양 배지를 각각 100 μL 씩 분주하여 상온 2 h 반응을 보았다. 1X washing buffer로 5번 헹구어 주고 과산화수소를 이용하여 기질을 탈수소화시키는 반응을 촉매하는 효소 peroxidase가 표시되어있는 anti-PIP 단클론 항체(monoclonal antibody)를 넣고 3 h 반응시켰다. 3,3',5,5'-Tetramethylbenzidine (TMB) substrate를 100 μL 넣고 상온에서 15 min 반응시킨 후에 450 nm에서 흡광도를 측정하였다.
5. 통계분석
본 연구의 모든 실험은 동일한 조건으로 3회 이상 독립적으로 반복 수행하여 실험 결과를 얻었다. 각 실험 결과에 대해서 non-paired student t-test를 이용하였고 p-value를 구하였으며, p-value가 0.05 이하일 경우 통계적으로 유의하다고 보았다.
Results and Discussion
본 연구자들은 최근 발표한 'MMP expression alteration and MMP-1 production control by syringic acid via AP-1 mechanism' (Ryu & Na, 2018)에 관한 연구결과를 토대로, syringic acid가 독성을 보이지 않는 실험 최대 농도는 10 μM 이내, 세포 노화를 일으키는 UVB의 적정 세기는 15 mJ/cm2 로 결정하였다.
1. Syringic acid의 염증 억제 효과
피부질환의 대부분은 염증을 동반하고 있으며, 만성적으로 발생하는 염증은 질환의 악화 뿐 아니라 피부 노화를 유발하는 원인이 된다(Abu et al., 2009). IL6은 조직 손상 및 감염에 대한 직접적 피부 염증 세포의 기능에 영향을 미치는 숙주 반응의 주요 사이토카인이다(Grossman et al., 1989). 본 실험에서는 자외선 B에 의해 IL6 mRNA 발현이 대조군 대비 2.5배 증가되었으나 syringic acid 2, 5, 10 μM 전처리 후 농도의존적으로 2.1, 1.4, 0.8로 감소하는 것을 확인하였다(Figure 1A).

Analysis of inflammatory gene expression in UVB irradiated HaCaT cells pre-treated with syringic acid.
HaCaTs (2×105 cells) were seeded in a 60-mm culture dish and incubated for 24 h. Before UVB exposure, the cells were pretreated with varying concentrations of syringic acid. Then, the cells were washed with PBS and irradiated with 15 mJ/cm2 UVB. After further incubation for 24 h, the expression levels of IL6, IL1β, COX2, TNFα mRNA were estimated using qRT-PCR. The graph is representative of three independent experiments (M±SD). The results show averages of independent experiments, with error bars showing standard deviation (*p<0.05). UVB, ultraviolet B; qRT-PCR, quantitative real-time polymerase chain reaction; IL6, interleukin 6; IL1β, interleukin 1 beta; COX2, cyclooxygenase 2; TNFα, tumor necrosis factor alpha; M±SD, mean±standard deviation.
IL1β는 대식세포의 활성과 케모카인(chemokine)의 생성을 유도하며 림프구와 호중구의 내피 세포 접착을 높여주고, 염증 부위에 염증 세포의 확산을 증가시키는 염증 인자이다. 본 실험에서는 자외선 B에 의해 초기 염증반응에 반응하는 IL1β 발현이 약 3.7배 증가하였으나 syringic acid 2, 5, 10 μM 전처리 후 3.0, 2.2, 1.7로 농도의존적으로 감소하였다(Figure 1B).
다양한 신호 경로의 활성화를 통해 조절되고, mitogen-activated kinases (MAPKs)에 의해 활성이 촉진되며 NF-κB의 활성화 및 염증과 종양을 촉진하는 COX2 mRNA 발현은 자외선 B에 의해 약 2.2배 증가하였으나 syringic acid 2, 5, 10 μM 전처리 후 1.5, 1.2, 0.8 로 농도의존적으로 감소하였다(Figure 1C).
종양괴사인자인 TNFα는 면역반응에 필요한 사이토카인으로서 주로 대식세포에서 생성되어 대식세포를 자극, 종양세포에 신호를 주어 자살하도록 만들거나 그 밖에 바이러스의 세포내 복제를 저해하여 염증반응을 촉진하는 등, 내재 면역반응(innate immune response)에 폭넓게 관여하는 신호 인자이다(Hu et al., 2013). 본 실험을 통해 TNFα mRNA 발현은 자외선 B에 의해 6.9배 증가되었으나 syringic acid 2, 5, 10 μM 전처리 후 2.0, 1.5, 0.9로 농도의존적으로 감소하였다(Figure 1D).
2. Syringic acid의 콜라겐 생성 효과
Procollagen은 콜라겐의 전구체로서, 진피 섬유아세포의 폴리펩타이드 사슬의 형태로 합성된다(Varani et al., 2002). 진피층의 세포외 기질(extracellular matrix, ECM)중 type I collagen은 가장 많은 양을 차지하며, 그 외 type III collagen, elastin, proteoglycans, and fibronectin이 존재한다. type I collagen의 분열은 정상적인 조직 항상성, 조직 재생, 암, 그리고 그 외의 병적 증상들의 정상적 회복을 위해 중요한 작용을 한다. 진피층의 세포외기질(extracellular matrix, ECM) 중 가장 많은 양을 차지하는 type I procollagen 은 열이나 자외선 노출로 인해 유전자 발현은 억제되는 반면, MMP의 발현은 유도되며(Uitto et al., 1998), 일시적으로 type I procollagen 합성이 저해되지만 2-3일 이내에 회복되기도 한다(Shim, 2017; Varani et al., 2002).
자외선 B에 의해 감소된 typeⅠ procollagen mRNA가 syringic acid에 의해 어느 정도 회복되는지 qRT-PCR로 확인하였다. 그 결과 15 mJ/cm2 자외선 B에 의해 type Ⅰ procollagen mRNA의 발현은 0.5배 감소되었으나, syringic acid를 각각 2, 5, 10 μM 전 처리 후 15 mJ/cm2 자외선 B 조사 시 type Ⅰ procollagen mRNA 발현이 0.6, 0.8, 1.0으로 증가하였다. 즉 syringic acid가 농도의존적으로 type 1 procollagen mRNA 발현을 증가시키는 것으로 확인되었다(Figure 2A).
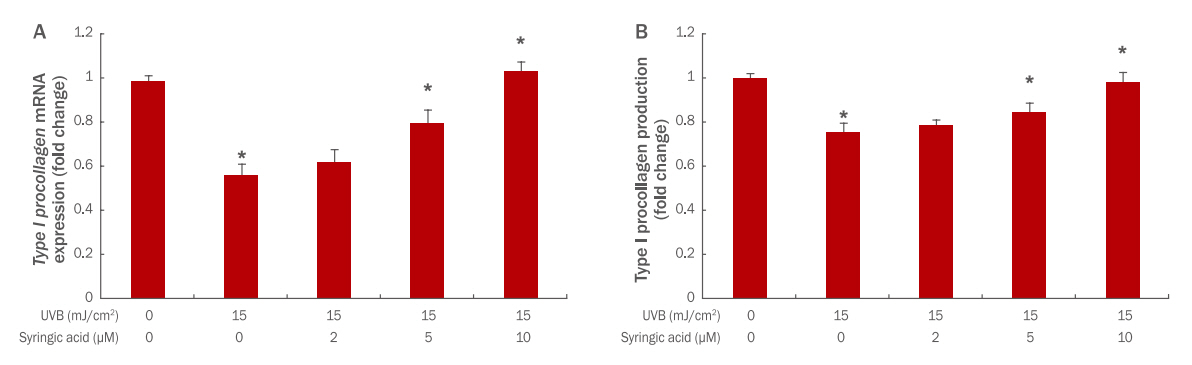
Effect of syringic acid on type Ι procollagen mRNA expressions (A) and type І procollagen production (B) in UVB-irradiated HaCaTs.
HaCaTs (2×105 cells) were seeded in a 60-mm culture dish and incubated for 24 h. Before UVB exposure, the cells were pretreated with varying concentrations of syringic acid. Then, the cells were washed with PBS and irradiated with 15 mJ/cm² UVB. After further incubation for 24 h, the expression level of type Ι procollagen mRNA was estimated using qRT-PCR (A). And type I procollagen production was examined using ELISA (B). The graph is representative of three independent experiments (M±SD). The results show average of independent experiments, with error bars showing standard deviation (*p<0.05). UVB, ultraviolet B; PBS, phosphate buffered saline; qRT-PCR, quantitative real-time polymerase chain reaction; M±SD, mean±standard deviation.
자외선 B에 의해 감소된 type I procollagen 생산량이 syringic acid에 의해 어떠한 변화를 보이는지 ELISA를 통해 확인하였다. 그 결과 15 mJ/cm2 자외선 B에 의해 type I procollagen의 생산량은 1에서 0.75로 약 0.25 감소되었으나, syringic acid 각각 2, 5, 10 μM 전 처리 후 15 mJ/cm2 자외선 B 조사 시 type I procollagen 생산량이 0.78, 0.84, 0.98로 증가하여 syringic acid가 농도의존적으로 type I procollagen 생산을 증가시키는 것이 확인되었다(Figure 2B). 그러므로 syringic acid가 농도의존적으로 콜라겐 전구체인 type I procollagen 유전자 발현 및 생산을 증가시켜 주름개선 성분인 콜라겐 합성을 증가 시킬 것으로 보인다.
Conclusion
식물에서 추출된 페놀성 화합물은 항암, 항염, 해독 작용 등이 뛰어난 성분들을 함유하고 있다는 것이 밝혀지면서 이에 대한 다양한 효능 연구가 지속적으로 이루어져 왔다(Andrade et al., 2001; De Heredia et al., 2001; Goldberg et al., 1999). 특히, 페놀화합물 중 syringic acid는 shikimic acid pathway에 의하여 생합성되는 방향족 화합물의 일종으로서 산소와 수산기 및 메틸기로 이루어져 있으며, 특히 2개의 수산기를 가지고 있어 강한 항산화와 항암 작용을 가지고 있음이 보고된 바 있다(Ferguson, 2001; Goldberg et al., 1999; Shim et al., 1995). 본 연구는 syringic acid을 인간 각질형성세포(HaCaT)에 적용하여 기능성 화장품 원료로의 개발가능성을 확인하려 하였고, 다음과 같은 결론을 얻었다. 염증 억제와 관련하여 syringic acid의 농도가 증가할수록 염증 진단 표지인자인 IL6, IL1β, TNFα mRNA와 염증반응전사자인 COX2 mRNA 발현양이 감소하는 것을 확인하였고, 이를 통해 syringic acid는 농도 의존적으로 인간 각질형성세포의 염증을 억제할 수 있을 것으로 보인다. 콜라겐 생성과 관련해서는 자외선 B에 의해 감소된 콜라겐 전구체인 type Ⅰ procollagen 의 mRNA가 syringic acid에 의해 농도의존적으로 증가했으며 type Ⅰ procollagen의 생산량 또한 증가하는 것을 확인하였다.
이상의 실험 결과를 통해 syringic acid는 농도의존적으로 자외선 B에 의해 손상된 인간 각질형성세포의 염증을 억제하고, 피부 내 콜라겐 생성을 증가시킬 수 있는 천연유래 phytochemical 화장품 원료로서 활용가능 하리라 사료된다. 다만 실제 화장품 원료로 피부에 적용하기 위해서는 추가적인 인체 대상 실험이 필요할 것으로 보인다.
