다양한 농도의 에탄올로 추출한 불등풀가사리 추출물의 항산화, 항염 특성에 관한 연구
A Study on the Antioxidative and Anti-inflammatory Properties of Gloiopeltis furcata Extract Obtained Using Different Concentrations of Ethanol
不同浓度乙醇提取物灰皮草提取物的抗氧化和抗炎特性研究
Article information
Abstract
목적
본 연구에서는 불등풀가사리 추출 조건에 따른 항산화능 차이 및 불등풀가사리 추출물의 항염효과에 대해 연구하고자 하였다.
방법
다양한 농도의 에탄올로 추출한 불등풀가사리 추출물의 항산화능 측정을 위해서 DPPH assay와 ABTS assay를 실시하였다. 동시에 불등풀가사리 추출물에 대해 항산화 물질인 폴리페놀과 플라보노이드의 농도를 측정하였다. 세포실험 역시 가장 항산화력이 우수했던 수성 추출물의 세포 독성과 항염활성을 측정하였다.
결과
DPPH 실험에서는 3.576 mg ascorbic acid/g의 항산화능을 나타내었으며, ABTS 실험에서는 4.892 mg ascorbic acid/g의 항산화능을 나타내었으며, 폴리페놀 농도는 35.52±2.32 mg/g으로 나타났다. 플라보노이드 농도는 0.88±0.34 mg/g으로 나타났다. 세포독성의 경우 실험에 사용된 모든 농도에서 20% 이하의 세포 독성을 보여 세포독성이 없음을 확인하였으며, 농도 비례적으로 염증을 감소시키는 효과를 확인함과 동시에 100 μg/mL 농도에서 47.66±1.53%의 염증 억제능을 보였다.
결론
불등풀가사리의 경우 수성 추출에서 가장 높은 항산화능을 나타내었으며, 불등풀가사리의 수성추출물의 경우 낮은 세포 독성과 항염효과가 있음을 확인하였으며, 상업적 이용가치가 있음을 확인하였다.
Trans Abstract
Purpose
This study aimed to explore the differences in the antioxidant activity and anti-inflammatory effects of Gloiopeltis furcata based on its extraction conditions.
Methods
2,2-diphenyl-1-picrylhydrazyl (DPPH) and 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) assays were performed to determine the antioxidant activity of Gloiopeltis furcata extracts obtained using different concentrations of ethanol. Concomitantly, the concentrations of polyphenols and flavonoids, which are antioxidants present in Gloiopeltis furcata extract, were measured. Additionally, in cell-based experiments, the cytotoxicity and anti-inflammatory activity of a water extract, which exhibited the most potent antioxidative activity among all extracts, was measured.
Results
In the DPPH assay, the Gloiopeltis furcata extract exhibited an antioxidant activity of 3.576 mg of ascorbic acid/g, whereas in the ABTS assay, the antioxidant activity was 4.892 mg of ascorbic acid/g. The polyphenol concentration was found to be 35.52±2.32 mg/g, whereas the flavonoid concentration was 0.88±0.34 mg/g. Furthermore, the extract had a cytotoxicity of ≤20% at all concentrations used in the experiment, thus indicating the absence of cytotoxicity and confirming that the extract was effective in reducing inflammation proportionally to its concentration. Moreover, the extract exhibited an anti-inflammatory activity of 47.66%±1.53% at a concentration of 100 μg/mL.
Conclusion
Gloiopeltis furcata exhibited the most potent antioxidant activity in its water extract, and it was confirmed that the extract of Gloiopeltis furcata that was obtained through water had low cytotoxicity, an anti-inflammatory effect, and a commercial value.
Trans Abstract
目的
本研究旨在探讨不同提取条件下的Gloiopeltis furcata的抗氧化活性和抗炎作用的差异。
方法
为测定不同浓度乙醇提取的Gloiopeltis furcata提取物的抗氧化性,进行DPPH和ABTS测定。同时,测量了多酚和类黄酮的浓度。此外,在基于细胞的实验中,测量了水提取物的细胞毒性和抗炎活性,水提取物在所有提取物中表现出最强的抗氧化活性。
结果
在DPPH测定中,Gloiopeltis furcata提取物的抗氧化活性为3.576 mg 抗坏血酸/g,而在ABTS测定中,抗氧化活性为4.892 mg 抗坏血酸/g。发现多酚浓度为35.52±2.32 mg/g,而类黄酮浓度为0.88±0.34 mg/g。此外,该提取物在实验中使用的所有浓度下的细胞毒性均≤20%,因此表明不存在细胞毒性,并证实该提取物在减少炎症方面的有效性与其浓度成正比。此外,该提取物在浓度为100 μg/mL时表现出 47.66%±1.53%的抗炎活性。
结论
Gloiopeltis furcata的水提物具有最强的抗氧化活性,证实了其水提物具有低细胞毒性、抗炎作用和商业价值。
Introduction
우리나라는 삼면이 바다로 이루어져 다양한 해양 자원을 가지고 있으며, 해양자원으로 머드, 해사, 해송, 염지하수, 해조류 등 다양한 소재를 이용할 수 있으며, 같은 소재여도 지역에 따라 다양한 특성을 지니고 있다(Kim et al., 2019).
그 중 해조류는 많은 비타민과 무기질을 가지고 있는 동시에 난소화성 다당류를 포함하고 있다. 이러한 특징으로 인해 열량을 제한하는 동시에 대사과정에 필요한 비타민과 무기질을 공급할 수 있어 체중 관리용 식품으로서 적합하다. 이러한 잠재성에도 불구하고 6,000종의 해조류 중 식용으로 소비되는 해조류는 150 여 종에 불과하다(Kim et al., 2013). 해조류에 대한 연구 역시 접근성 및 채집의 문제로 인해 지상의 식물에 비해서 매우 적은 양의 연구만 진행되어 있다(Kim & Lee, 2020). 해조류는 포함하고 있는 색소를 기준으로 녹조류, 갈조류, 홍조류 등 색을 바탕으로 명명되며(Lee, 2013), 남조류를 제외한 대부분의 해조류는 진핵생물에 해당된다. 이러한 해조류 중 갈조류는 유효성분 후코이단을 중심으로 다양한 효과가 연구되었으며, 식품, 화장품, 의약품 등 다양한 산업에 응용되고 있으나(Luthuli et al., 2019), 해수 온도 증가에 의해 국내 해양 생태계에서의 비중이 증가되고 있는 홍조류에 대한 연구는 매우 부족한 실정이다(Oh & Ahn, 2021; Yokohama, 1973). 하지만 홍조류 역시 피코시아닌, 피코에리트린, 카로티노이드 등의 유효성분을 함유하고 있으며 이들은 항산화, 항염증, 항암, 면역증진 활성을 가지고 있다고 보고되었다(Verma et al., 2018; Lee et al., 2017; Wu et al., 2015). 이러한 기능성은 홍조류의 연구 필요성 및 다양한 산업에서 응용 가능한 생물 자원으로서의 가능성을 보여주고 있다. 본 논문에서는 식용 해조류 중 하나인 불등풀가사리(Gloiopeltis furcata) 추출물의 항산화 특성 및 항염 특성에 대해 연구하였다.
천연 추출물의 평가에 사용되는 가장 대표적인 특징은 항산화능이다. 항산화능이란 다른 분자와 반응하기 쉬운 자유 라디칼의 반응성을 감소시키는 성질이다(Brand-Williams et al., 1995). 활성산소는 대표적인 자유 라디칼로 다른 생체분자를 산화시켜 변성시키지만, 유해 물질의 소거와 대사 물질의 합성 등 세포에서 필수적인 대사과정에 사용되기도 한다(Alfadda & Sallam, 2012). 이들은 크게 superoxide dismutase나 catalase와 같은 효소를 이용한 항산화 반응과 ascorbic acid나 tocopherol과 같은 특정 성분을 이용한 항산화 반응을 통해 일정한 수준으로 유지된다(Jeeva et al., 2015). 그러나 높은 농도로 생성될 경우 정상적인 세포와 조직을 손상시키며, 암과 세포 노화와 같은 질병을 유도한다(Schieber & Chandel, 2014). 이러한 활성산소의 과생성으로 인해 피부 조직을 산화시키는 것을 피부 노화라고 하며, 피부 노화의 대표적인 증상으로는 피부의 주름, 착색, 탄력 저하 등이 있다(Kammeyer & Luiten, 2015; Vashi et al., 2016). 이에 많은 화장품은 활성산소에 의한 피부 노화를 막기 위해 항산화 물질을 첨가한다.
과도한 활성산소의 생산 이유 중 하나로 염증이 거론된다. 염증반응은 생물에 유해한 물질을 제거하여 생물을 보호하는 반응으로, 유해 물질의 제거는 다양한 방법으로 진행되지만 활성산소를 이용해 유해 물질을 산화, 분해시키는 과정이 주로 진행된다(Chovatiya & Medzhitov, 2014). 이때 과도하게 생산된 활성산소는 위에 기술한 대로 세포의 노화를 유도한다(Checa & Aran, 2020). 이러한 노화를 염증성 노화(inflammaging)로 분류한다(Minciullo et al., 2016). 즉, 염증 역시 피부의 노화에 직접적인 영향을 줄 수 있으며, 염증을 완화시키는 성분 역시 일반적으로 화장품에 널리 사용되고 있다.
본 연구에서는 이러한 용도로 불등풀가사리 추출물를 사용하기 위해 항산화능 및 항염능을 평가하고자 하였다. 기존 해조류 추출물에 대한 연구에서는 70% 에탄올을 이용하여 추출하는 방법을 주로 사용하나, 홍조류인 참보라색우무, 까막살, 진두발, 지누아리의 경우 수성 추출이 에탄올을 이용한 추출보다 높은 추출효과를 나타내었다(Cho et al., 2012; Yu & Lee, 2022). 한편 물로 추출한 경우에도 항산화 및 항균, 항염 효과를 나타내어 화장품 원료로서 사용 가능성이 높다(Lee & Ahn, 2022; Choi, 2022). 이와 같이 홍조류는 기존 연구 방법과는 다르게 다양한 추출 조건으로 실험을 진행하여 추출 조건의 최적화가 진행되어야 한다.
Methods
1. 추출물 제조
불등풀가사리는 대한민국 전라남도 완도에서 채취된 불등풀가사리를 세척, 건조과정을 거쳐 실험에 사용하였다. 추출용매는 증류수와 에탄올을 0, 20, 40, 60, 80, 100% 비율로 혼합하여 제조하였다. 이때 에탄올 0%의 경우 증류수로 추출하였으므로 수성추출물로서 사용하였다. 용매와 건조된 불등풀가사리를 25:1 비율로 혼합하여 실온에서 3시간 동안 추출한 뒤 Whatman No.2 filter paper (Whatman plc, UK)로 불등풀가사리를 제거하였다.
2. DPPH 라디칼 소거능 측정
2,2-Diphenyl-1-picrylhydrazyl (DPPH) 소거능 측정은 Blois의 방법을 기반으로 불등풀가사리의 항산화 측정에 적합하도록 반응 비율과 시간을 조절하여 사용하였다(Blois, 1958). DPPH 용액은 70% 에탄올로 DPPH (Sigma-Aldrich, USA)를 1% (w/v)로 녹인 뒤 Whatman No.2 filter paper를 이용해 녹지 않은 DPPH를 제거하였다. 그 후 Microplate Reader (Synergy HT; Biotek, USA)를 이용하여 파장 540 nm을 기준으로 흡광도 가 1.00이 되도록 70% 에탄올로 희석하였다. 이를 DPPH 용액으로 사용하였다.
다양한 에탄올 농도로 추출된 불등풀가사리 추출물은 1 mg/mL 농도를 기준으로 희석하여 사용하였다. 불등풀가사리 시료 1.0 mL와 DPPH 용액 1.0 mL를 혼합 후 30 min간 반응시킨 뒤 540 nm에서의 흡광도를 측정하였다. 이때 시료 및 DPPH 용액이 흡광도에 영향을 줄 수 있어, 추출물과 라디칼 활성이 소거된 DPPH 용액의 흡광도를 측정하여 실험결과에서 제외했다. 이 때 최종 결과에서 가장 적합한 추출 조건을 가진 추출물에 대해서 EC50을 측정을 위한 실험을 진행하였다. 불등풀가사리 추출물을 10 mg/mL 농도로 제조한 뒤 기준으로 2배씩 희석하여 다양한 농도의 불등풀가사리 추출물을 제조하였다. 이 시료로 실험을 실시하여 EC50을 측정 후 동일한 방식으로 진행한 ascorbic acid (Sigma-Aldrich)의 EC50와 비교하여 항산화능을 측정하였다.
3. ABTS 라디칼 소거능 측정
2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) 소거능 측정은 Re의 방법을 기반으로 불등풀가사리의 항산화 측정에 적합하도록 반응 비율과 시간을 조절하여 사용하였다(Re et al., 1999). ABTS 는 증류수에 녹여 7 mM ABTS (SigmaAldrich)로 만든 뒤 2.45 mM 농도가 되도록 K2S2O8을 녹여 12시간 이상 ABTS의 발색이 충분히 일어나도록 반응 시간을 주었다. 그 후 ABTS 용액의 760 nm 흡광도를 측정하여 증류수로 0.7이 되도록 다시 희석하여 사용하였다.
다양한 에탄올 농도로 추출된 불등풀가사리 추출물은 1 mg/mL 농도를 기준으로 희석하여 사용하였다. 불등풀가사리 시료 0.5 mL와 ABTS 용액 1.5 mL를 혼합 후 60 min간 반응시킨 후 760 nm에서의 흡광도를 측정하였다. 이 때 추출물이 흡광도에 영향을 줄 수 있어, 추출물의 흡광도를 측정하여 실험결과에서 제외했다. 이 때 최종 결과에서 가장 적합한 추출 조건을 가진 추출물에 대해서 EC50을 측정을 위한 실험을 진행하였다. 불등풀가사리 추출물을 10 mg/mL 농도로 제조한 뒤 기준으로 2배씩 희석하여 다양한 농도의 불등풀가사리 추출물을 제조하였다. 이 시료로 실험을 실시하여 EC50을 측정 후 동일한 방식으로 진행한 ascorbic acid의 EC50와 비교하여 항산화능을 측정하였다.
4. 폴리페놀 함량 측정
다양한 에탄올 농도로 추출된 불등풀가사리 추출물은 1 mg/mL 농도를 기준으로 희석하여 만들어진 불등풀가사리 추출물 1.0 mL와 증류수로 Folin-Ciocalteu reagent (Junsei, Japan) 0.1 mL를 혼합한 뒤 5 분 동안 반응이 일어나도록 대기하였다. 그 후 5% CaCO3 (w/v) 용액 1.0 mL를 혼합한 뒤 반응을 위해 30 min 간 대기하였다. 그 후 반응이 끝난 시료의 760 nm 파장에서의 흡광도를 측정하였다. 폴리페놀 농도는 gallic acid (TCI, Japan) standard curve로 계산하였다.
5. 플라보노이드 함량 측정
불등풀가사리 추출물 1.0 mL에 2% AlCl3 (w/v) 0.5 mL를 혼합한 뒤 6 min 간 대기하였다. 1 M NaOH 0.5 mL를 혼합한 뒤 반응이 끝난 시료의 405 nm 파장에서의 흡광도를 측정하였다. 플라보노이드 농도는 quercetin (TCI, Japan) standard curve로 계산하였다.
6. 세포 독성 측정
본 실험 세포 독성 실험에는 항염 효과 실험에서 사용될 RAW 264.7 (한국세포주은행, 서울)을 사용하였다. 세포 배양 배지로는 DMEM broth (Dulbecco's Modified Eagle Medium; GE healthcare, USA) 445 mL, fetal bovine serum (FBS; Sigma-Aldrich) 50 mL, Penicillin-Streptomycin (100X) (Sigma-Aldrich) 5 mL를 혼합하여 사용하였다.
MTT assay를 이용하여 세포 독성을 평가하였다. 항염 작용 활성 측정 실험에 사용될 RAW 264.7을 전배양한 다음 이를 희석하여 96 well plate에 well 당 1×104 cell을 주입하여 1일간 37℃, CO2 농도 5%의 환경에서 배양하였다. 배양이 끝난 후 12.5-100 μg/mL 농도로 희석한 불등풀가사리 추출물을 처리하여 2일간 배양하였다. 배양 후 상층액을 제거하고 MTT (TCI, Japan)용액(5 mg/mL)를 가해준 뒤 배양 환경과 동일한 환경에서 반응시켰다. 각 well의 바닥에 생성된 결정이 끌려들어가지 않도록 상층액을 제거한 다음, NADH에 의해 결정화된 MTT를 DMSO로 녹여 540 nm 파장에서의 흡광도를 측정하였다.
7. NO 생성 억제능 측정
염증 억제능을 확인하기 위해 RAW 264.7 세포주의 nitric oxide (NO) 생성량을 측정하였다. 세포의 배양은 세포 독성 측정과 동일한 배양액 및 배양 조건으로 배양을 실시하였으며, 세포 염증 유도 물질로는 lipopolysaccharide (LPS; Sigma-Aldrich)를 사용하였다.
먼저 염증반응을 보기 위한 세포인 RAW 264.7을 전배양한 다음 이를 희석하여 96 well plate에 well 당 1×104 cells을 주입하여 1일간 배양하였다. 그 후 12.5-100 μg/mL 농도로 희석한 불등풀가사리 추출물과 최종 농도가 1 μg/mL가 되도록 희석한 LPS를 처리하여 2일간 배양하였다. 배양 후 배양 상층액 100 μL와 griess reagent 100 μL를 혼합하여 불등풀가사리 추출물의 염증에 관련된 세포 신호 전달물질인 NO 농도를 측정하였다.
8. 통계처리
실험결과는 3회 반복하였으며, 데이터의 통계처리는 Minitab 18 (Minitab, USA)를 이용하였다. 3회 반복한 실험 결과는 평균±표준편차(mean±standard deviation, SD)로 표기하였으며, Student's t-test, ANOVA 및 Tukey test를 이용하여 p value가 0.05 미만일 경우에 통계적으로 유의한 것으로 판정하였다.
Results and Discussion
1. DPPH 라디칼 소거능
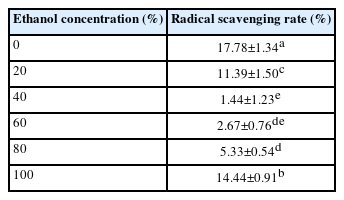
Table 1은 에탄올 농도에 따른 불등풀가사리 추출물의 DPPH 라디칼 소거능을 계산한 결과이다. 각 농도별로 측정한 결과 수성 추출물에서 가장 높은 항산화능을 나타내었으며, ANOVA 및 Tukey test를 통해 통계적으로 유의미한 차이가 있음을 확인하였다.
DPPH radical scavenging rates of the Gloiopeltis furcata extract based on the ethanol ratio used for extraction
실험에 앞서 비교대상으로 사용된 ascorbic acid의 EC50 수치를 측정하였다. 그 결과 ascorbic acid의 EC50 수치는 12.59 μg/mL임을 확인했다. 이때 EC50 수치는 Alexander의 방법으로 산출하였다(Alexander et al., 1999).
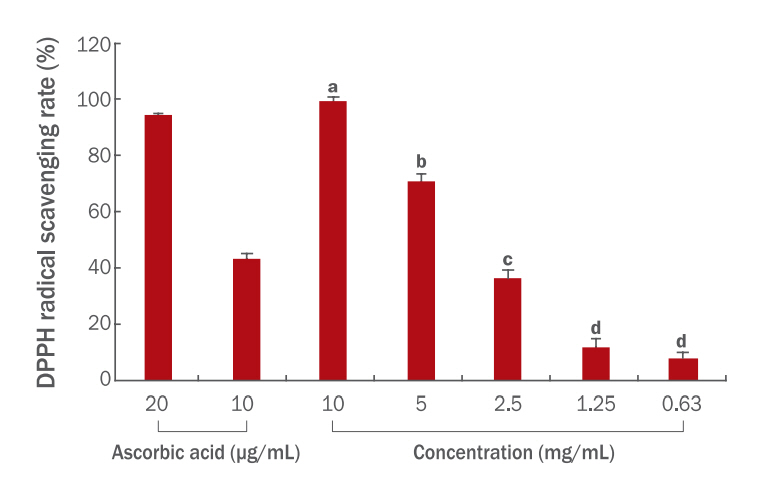
불등풀가사리 추출물의 경우 0.63-10 mg/mL로 희석하여 실험을 진행하였다. 실험 결과는 Figure 1과 같으며, 10 mg/mL 농도에서 98.53±1.67%, 5 mg/mL 농도에서 70.45±2.63%, 2.5 mg/mL 농도에서 35.88±2.39%, 1.25 mg/mL 농도에서 11.56±2.45%, 0.63 mg/mL 농도에서 7.62±1.55%의 라디칼 소거율이 나타났다. 이를 바탕으로 EC50을 계산하였으며, 3.521 mg/mL란 결과를 얻었다.
DPPH radical scavenging rates based on the concentration of the Gloiopeltis furcata extract.
a-d: different alphabets indicate statistically significant differences at p<0.05 (Tukey’s test) ANOVA; p=0.000; The EC50 of the sample was calculated using Alexander’s method (Alexander et al., 1999). EC50=4.360 mg/mL.
홍조류 중 꼬불꼬시래기, 각시꼬시래기, 꼬물꼬시래기에 대한 선행연구에서 10 mg/mL에서 실험한 결과에서 꼬물꼬시래기가 가장 높은 항산화능을 나타내었으며 69.53%의 라디칼 소거능을 나타내었다(Kang & Kang, 2021). 본 연구에서는 10 mg/mL 농도 조건으로 98.53%로 반주름말의 96.26%에 비해 높은 항산화능을 보였다(Shin & Kang, 2021). 홍조류의 추출 조건에 따른 항산화능을 비교한 선행연구에서 나타난 결과와 유사하게 수성 추출이 에탄올 추출에 비해 높은 항산화능을 보여줌을 확인할 수 있었다(Cho et al., 2012).
2. ABTS 라디칼 소거능
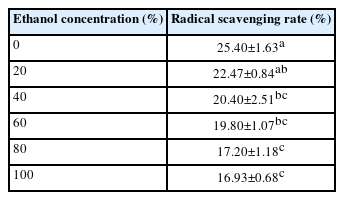
Table 2는 에탄올 농도에 따른 불등풀가사리 추출물의 ABTS 라디칼 소거능을 계산한 결과이다. 각 농도별로 측정한 결과 수성 추출물에서 가장 높은 항산화능을 나타내었으며, ANOVA 및 Tukey test를 통해 통계적으로 유의미한 차이가 있음을 확인하였다.
ABTS radical scavenging rates of the Gloiopeltis furcata extract based on the ethanol ratio used for extraction
실험에 앞서 비교대상으로 사용된 ascorbic acid의 EC50 수치를 측정하였다. 그 결과 ascorbic acid의 EC50 수치는 21.33 μg/mL임을 확인했다. 불등풀가사리 추출물의 경우 0.63-10 mg/mL로 희석하여 실험을 진행하였다. 실험 결과는 Figure 2와 같으며, 10 mg/mL 농도에서 91.36±1.94%, 5 mg/mL 농도에서 60.37±2.76%, 2.5 mg/mL 농도에서 19.85±3.35%, 1.25 mg/mL 농도에서 8.24±1.43%, 0.63 mg/mL 농도에서 5.81±1.87%의 라디칼 소거율이 나타났다. 이를 바탕으로 EC50을 계산하였으며, 4.360 mg/mL란 결과를 얻었다.

ABTS radical scavenging rates based on the concentration of the Gloiopeltis furcata extract.
a-d: different alphabets indicate statistically significant differences at p<0.05 (Tukey’s test) ANOVA; p=0.000; The EC50 of the sample was calculated using Alexander’s method (Alexander et al., 1999). EC50=4.360 mg/mL.
홍조류 중 꼬불꼬시래기, 각시꼬시래기, 꼬물꼬시래기에 대한 선행연구에서 10 mg/mL에서 실험한 결과에서 꼬물꼬시래기가 가장 높은 항산화능을 나타내었으며 24.07%의 라디칼 소거능을 나타내었다. 본 연구에서는 동일 조건으로 91.36%로 반주름말에 비해 높은 항산화능을 보였다(Kang & Kang, 2021). 이러한 결과는 DPPH의 결과와도 동일하다.
3. 폴리페놀 및 플라보노이드 함량
불등풀가사리 추출물의 폴리페놀 함량과 플라보노이드 함량을 계산하여 Table 3에 나타내었다. 폴리페놀의 경우 물로 추출한 경우 22.23±1.34 mg/g, 20%로 추출한 경우 24.53±1.45 mg/g, 40%로 추출한 경우 24.26±1.55 mg/g, 60%로 추출한 경우 31.28±1.91 mg/g, 80%로 추출한 경우 34.14±1.85 mg/g, 100%로 추출한 경우 35.52±2.32 mg/g으로 나타났다. 플라보노이드의 경우 물로 추출한 경우 2.58±0.54 mg/g, 20%로 추출한 경우 4.15±0.86 mg/g, 40%로 추출한 경우 9.45±0.45 mg/g, 60%로 추출한 경우 12.73±0.84 mg/g, 80%로 추출한 경우 13.45±0.47 mg/g, 100%로 추출한 경우 15.13±0.71 mg/g으로 나타났다.
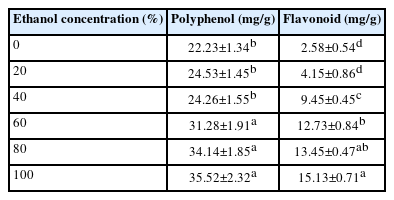
Polyphenol and flavonoid content of the Gloiopeltis furcata extract based on the ethanol ratio used for extraction
같은 홍조류인 김의 폴리페놀과 플라보노이드 함량을 측정한 연구에서 김의 폴리페놀과 플라보노이드 농도는 각각 32.14 mg/g, 0.55 mg/g이었으며, 불등풀가사리와 비교하였을 때 각각 1.1배, 1.6배에 해당하는 차이가 나타났다(Hwang & Thi, 2014). 본 결과에서 폴리페놀과 플라보노이드 모두 DPPH, ABTS의 결과와 반대로 에탄올 추출물에서 높은 농도를 나타내었다. 이러한 경향은 홍조류인 Polysiphonia와 Laurencia에 대한 항산화 효과에 대한 연구에서 폴리페놀과 플라보노이드 모두 에탄올 추출에서는 높은 농도를 나타내나 항산화 효과는 큰 차이가 없었던 결과와 유사하다(Al-Amro et al., 2019). 이러한 폴리페놀과 플라보노이드의 차이가 항산화능에 영향을 주지 못하는 이유로는 폴리페놀과 플라보노이드에 속하지 않는 항산화 물질이 있다. 그 예로 홍조류의 대표적 유효성분 중 하나인 phycoerythrin은 phycobiliprotein의 일종으로, 항산화능을 나타내는 동시에 물에 매우 잘 녹는 특성을 지니고 있어, 본 실험과 같은 결과를 나타내는 요인으로 생각된다(Glazer, 1994; Sonani et al., 2014).
4. 세포 독성
불등풀가사리 수성 추출물의 세포 독성을 측정하기 위해 MTT assay를 이용한 세포 생존율 측정을 실시하였다. 불등풀가사리 추출물은 세포가 배양될 배지에서의 최종농도가 12.5-100 μg/mL가 되도록 계산된 배지를 추가하여 배양을 진행하였다.
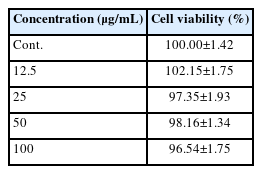
실험 결과는 Table 4와 같으며 100 μg/mL 농도에서 96.54±1.75%, 50 μg/mL 농도에서 98.16±1.34%, 25 μg/mL 농도에서 97.35±1.93%, 12.5 μg/mL 농도에서 102.15±1.75%의 세포 생존율이 나타났다.
ISO 10993-5의 기준으로는 80% 이상의 세포가 생존한 경우에는 독성이 없는 것으로 나타낼 수 있으며, 본 실험에 사용한 불등풀가사리 수성 추출물의 경우에 해당 기준을 적용할 경우 모든 실험 농도에서 세포독성이 나타나지 않은 것으로 나타났다.
5. NO 생성 억제능
염증 대사에서 중요 매개물질인 NO를 측정하여 불등풀가사리 수성 추출물의 항염효과를 확인하였다. 불등풀가사리 수성 추출물은 세포가 배양될 배지에서의 최종농도가 12.5-100 μg/mL가 되도록 계산된 배지를 추가하여 배양을 진행하였다.
Table 5는 NO의 생성율 및 불등풀가사리 처리 농도에 따른 변화를 계산한 결과이다. LPS 처리군의 NO를 100%로 한 뒤 이를 기준으로 100 μg/mL에서 47.66±1.53%, 50 μg/mL 에서 16.56±1.87%, 25 μg/mL 에서 6.52±1.27%, 12.5 μg/mL에서 3.87±2.48%의 염증 억제율이 나타났다. Student's t-test를 통해 검증을 실시한 결과, 25 μg/mL부터 통계적으로 유의미한 염증 감소 효과를 나타내었으며, 그 이상의 농도에서도 농도에 비례하는 염증 감소 효과를 나타내었다.

Nitric oxide (NO) production rate when Raw 264.7 cells were treated with the Gloiopeltis furcata extract
홍조류에는 염증을 일으키는 물질인 카라기난이 함유되어 있어 일부 추출 조건에서 제조된 추출물의 경우 염증을 유도할 수 있다(Salvemini et al., 1996). 카라기난은 일반적으로 60℃ 이상으로 가열한 물이나 알칼리 용액에서 녹일 수 있으며 실온에서의 물에서는 추출이 되지 않으며(Michel et al., 1997), 이러한 이유로 본 연구에서는 실온에서 물로써 추출하여 항산화물질의 추출을 증가시키는 동시에 카라기난의 용출을 방지하여, 홍조류의 카라기난이 추출되는 것을 막는 동시에 유효 항산화 및 항염 물질을 추출할 수 있었다.
Conclusion
불등풀가사리 추출물의 항산화능, 항염작용, 세포독성을 평가하여 불등풀가사리 추출물의 향후 이용 가능성을 확인하였으며, 다양한 조건으로 추출을 진행하여 추출물의 최적 추출 조건에 대한 연구를 진행하였다.
항산화능 실험으로 DPPH, ABTS를 이용하여 추출 조건에 따른 불등풀가사리 추출물의 항산화능을 확인하였다. 그 결과 여타 에탄올 추출방법에 비해 수성 추출방법으로 추출한 불등풀가사리 추출물이 항산화능 기준에서 뛰어남을 확인하였다. 이를 바탕으로 불등풀가사리 수성 추출물에 대해 ascorbic acid와의 비교 실험을 실시하였다. DPPH 실험에서는 3.576 mg ascorbic acid/g와 같은 항산화능을 보였으며, ABTS 실험에서는 4.892 mg ascorbic acid/g와 같은 항산화능을 보였다. 추출 조건에 따른 불등풀가사리 수성 추출물의 폴리페놀 농도는 35.52±2.32 mg/g이었고, 플라보노이드 농도는 0.88±0.34 mg/g으로 나타나 에탄올 추출방법에 비해 적은 추출양을 보였다.
항산화능이 높게 나온 수성 추출물에 대해서 세포실험을 실시하였다. 세포 실험으로는 화장품 원료로서 안전성을 확인하기 위한 독성 실험과 세포의 염증 반응을 억제할 수 있는 항염 활성 실험을 실시하였다. 실험 농도 범위에서 80% 이상의 세포가 생존하여 불등풀가사리 추출물은 ISO 10993-5의 기준 세포 독성이 없음을 확인하였다. 항염 활성 실험에서도 농도에 따라 염증반응을 감소시켜 항염 활성이 있음을 확인하였으며, 100 μg/mL로 처리한 경우 47.66±1.53%의 염증 억제능을 보였다.
Notes
Author's contribution
S.H.K. and J.B.L. contributed equally to this work. S.K. and J.L. conceived the experiments. S.K. performed experiments and collected the data. J.L. analyzed the data and interpreted the result. S.K. and J.L. wrote the paper and revised the manuscript.
Author details
Sook-Hee Kim (Professor), K-Beauty industry fusion, Konkuk Continuing Education Center, Konkuk University, 120 Neungdong-ro, Gwangjin-gu, Seoul 05029, Korea; Ja-Bok Lee (CEO), LFOUNDER INC., 70 Songdogwahak-ro, Yeonsu-gu, Incheon 21984, Korea.