건조 시간에 따른 피자두(과육, 과피)의 항산화 활성 측정
Measurement of Antioxidant Activity of Soldam Plum (Flesh, Peel) by Different Drying Time
Soldam李子(果肉、果皮)的不同干燥时间的抗氧化活性测定
Article information
Abstract
목적
본 연구에서는 한국산 피자두를 기능성식품의 소재로 활용하고자 70℃에서 각기 다른 열풍 건조 시간(0 h, 12 h, 18 h, 24 h)에 따른 피자두(과육, 과피)의 항산화 물질 함량 및 활성 변화의 비교 분석을 통해 최적 열풍 건조 시간을 찾아내고자 하였다.
방법
과육과 과피를 온도 70℃에서 건조 시간(0 h, 12 h, 18 h, 24 h)을 달리하여 건조하였다. 열풍 건조 후 모든 시료는 열수 추출하여 항산화 물질(total polyphenol 함량, total flavonoid 함량)과 항산화 활성(DPPH radical 소거능, ABTS radical 소거능)을 측정용 시료로 사용하였다.
결과
피자두 과육과 과피 모두 생과육 대비(0시간 건조) 18시간까지는 건조 시간이 증가함에 따라 생리활성이 높아졌으나 24시간에서는 생리활성이 감소하였다. 18시간 건조한 피자두 과육과 과피에서 모두 가장 좋은 항산화 활성이 나타났다.
결론
18시간 열풍 건조시 피자두 과육과 과피의 생리활성이 가장 우수하였고, 특히 피자두의 과피가 과육보다 높게 나타났다. 차후 건조 피자두를 활용한 제품 개발 시 18시간 건조하는 것이 바람직하겠다. 다만, 피자두 과육과 과피를 건강 기능성 식품 소재로 활용하기 위해서는 항산화 활성 이외에도 효소 활성이나 항염증 활성과 관련 된 후속 연구가 진행되어야 할 것으로 판단된다.
Trans Abstract
Purpose
The purpose of this study was to determine the optimal hot air drying time to use Asian Soldam plum to be utilized as a functional food ingredient, and to this end, the antioxidant components and activity changes of Soldam plum (both flesh and peel) applied with various drying times (0, 12, 18, 24 h) at 70°C were compared and analyzed.
Methods
Samples of Soldam plum flesh and peel, which had undergone hot air drying, were subjected to hot water extraction, and their antioxidant components (total polyphenol and total flavonoid contents) as well as antioxidant activity (DPPH and ABTS radical scavenging capabilities) were measured.
Results
The physiological activities of the hot water-extracted flesh and peel exhibited an increase with drying time, peaking at 18 h, compared to the fresh (not dried) counterparts, but decreased at 24 h. The highest level of antioxidant activity was observed in the peel of Soldam plum dried for 18 h.
Conclusion
Optimal physiological activity in the peel of Soldam is achieved when it is dried for 18 h using hot air. In future product development utilizing dried Soldam plum, an 18 h drying period is recommended. Additionally, further research should explore enzyme activity and anti-inflammatory properties in addition to antioxidant activity.
Trans Abstract
目的
本研究的目的是确定soldam李作为功能性食品成分的最佳热风干燥时间,并为此研究soldam李(果肉和果皮)的抗氧化成分和活性变化对70℃下不同干燥时间(0、12、18、24 h)下的干燥效果进行了比较和分析。方法:对经过热风干燥的soldam李果肉和果皮样品进行热水提取,测定其抗氧化成分(总多酚和总黄酮含量)以及抗氧化活性(DPPH和ABTS自由基清除能力)。
结果
热水提取的果肉和果皮的生理活性随着干燥时间的延长而增加,与新鲜(未干燥)的对应物相比,在18 h达到峰值,但在 24 h时下降。在干燥18 h的soldam李子果皮中观察到最高水平的抗氧化活性。
结论
当用热风干燥18 h时,Soldam果皮的生理活性达到最佳。在未来使用干soldam李子的产品开发中,建议干燥时间为18 h。此外,除了抗氧化活性之外,还应该进一步研究酶活性和抗炎特性。
Introduction
자두는 장미과(Rosaceae) 벚나무속에 속하는 자두나무(Prunus salicina L., plum tree)의 열매로, 전 세계적으로 30-40여 종이 있다(Jung et al., 2005). 우리나라에서는 순수 동양계 자두인 P. salicina 품종 중 Soldam과 Kelsey를 비롯하여 북미산 자두 P. Americana L.및 P. simonii L.와 동양계 자두 P. salicina L.의 교잡종인 Formosa (P. salicina Formosa), Santa Rosa와 Formosa의 자연교 잡종인 Oishiwase (대석조생), Oishinakate (대석중생), Wasegekko (조생월광) 등이 주로 재배되고 있다(Han et al., 2007; Yoon et al., 2011). 유럽산 자두 P. domestica L.은 건자두 형태로, 순수 동양계 자두 P. salicina L.은 생과일 형태로 유통되며, 한국에서 생산되는 주요 품종은 대석조생(Oishiwase), Formosa, Soldam이다(Park et al., 2021). 자두는 성질이 평하고 약간 신맛의 과일로, 예로부터 피로회복, 기미 제거, 골절 통증 완화, 소화기 및 장 건강 등에 사용된다고 알려져 있다(Sung et al., 2002).
자두의 영양성분으로는 pectin 등의 식이 섬유소, malic acid와 같은 유기산, 유리아미노산, 카로티노이드, 칼륨, 칼슘, 인, 철 등이 다량 함유되어 있으며(Chung, 1999; Lee et al., 1993), 특히 식이섬유는 혈중 콜레스테롤과 LDL 콜레스테롤을 감소시키는 효과가 있는 것으로 밝혀졌다(Tinker et al., 1991).
자두의 생리활성 성분으로는 myricetin, quercetin 같은 플라보노이드를 함유하고 있는데(Peng et al., 2003), 이중 Soldam과 Formosa에는 myricetin이 다량 함유되어 있다. 또한 항산화 활성이 높은 neochlorogenic acid, rutin, chlorogenic acid 같은 phenolic acid도 함유하고 있는데(Kim et al., 2012b), 특히, 붉은색을 띠는 자두 품종의 경우 anthocyanin 류인 cyanidin-3-glucoside 등의 폴리페놀 성분도 다량 함유하고 있어(Donovan et al., 1998; Raynal et al., 1989a), 골다공증 예방, 여성호르몬 형성, 주름살 예방, 미백효과,빈혈 예방 피로 회복, 항염증 및 암세포 보호 등의 효과가 보고되고 있다(Kim et al., 2013; Park et al., 2013; Sung et al., 2002; Yoon et al., 2011).
동양계 자두의 생리활성 연구를 살펴보면, 생육 시기에 따른 피자두의 항산화 효과(Yu et al., 2004), 대석조생과 Formosa의 화학적 특성 및 생리적 연구(Jung et al., 2005), 자두 추출물(Formosa, Soldam)의 자궁경부 암세포 증식 억제(Han et al., 2007), 자두의 면역 증강 효과(Lee et al., 2009), 김천산 자두 Formosa의 화학적 성분과 항산화 활성(Yoon et al., 2011) 등이 있다.
유럽계 자두의 생리활성 연구를 살펴보면, 항암 효능 연구(Marino & Zollo, 2007; Alsolmei et al., 2019), 골다공증에 대한 임상 연구(Al-Dashti et al., 2019; Marino & Zollo, 2007), 건자두와 프락토 올리고당의 결합으로 인한 골밀도 회복(Arjmandi et al., 2010), 건자두가 폐경 여성의 뼈의 회복 및 혈관 기능에 미치는 영향(Arjmandi et al., 2015; Al-Dashti et al., 2019), 프룬 자두 섭취의 골아 세포의 활성과 기능의 증가(Cuenca et al., 2017), 자두가 위장 기능에 미치는 영향(Lever et al., 2014), 간 보호, 항 비만 효과(Alsolmei et al., 2019; Bose et al., 2017; Kim et al., 2003; Noratto et al., 2015) 등이 보고되었다.
일반적으로 과피는 전체 과일 중량의 10-32%를 차지하며, 폴리페놀이 과육에 비해 높게 함유되어 있고, 과피부위에는 만성질환을 예방할 수 있는 페놀화합물 등 각종 기능성 성분이 많이 함유되어 있는 것으로 보고되고 있다(Contreras-Calderron et al., 2011; Eom et al., 2021; Kubola & Siriamornpun, 2011).
이와 같이 자두의 특성상 계절적인 제약이 크기 때문에 건자두를 활용한 가공품 개발 및 부가가치 향상을 위한 연구가 요구되고 있어 국내외적으로 건자두를 활용한 다수의 연구가 이루어져 있으나, 한국산 동양계 피자두를 활용한 연구는 매우 미미한 실정이다. 따라서 본 연구에서는 한국산 피자두를 기능성식품의 소재로 활용하고자 건조 시간에 따른 피자두(과육, 과피)의 항산화 물질 함량 및 활성 변화의 비교 분석을 통해 최적 열풍 건조 시간을 찾아내고자 하였다.
Methods
1. 실험재료
본 연구에 사용된 피자두(Prunus salicina L., Soldam)는 22년 8월에 경상북도 김천에서 구입하여 시료로 사용하였다.
2. 시료제조
1) 분석용 시료 제조
피자두 과육과 과피 건조를 위해 Stacewicz-Sapuntzakis et al.(2001)와 Kim et al.(2015)의 방법을 참조하여 피자두 생과를 3회 세척 후 과피를 1 mm로 얇게 벗겨 과육과 과피로 분리 및 세절하고 씨를 제거하였다. 과육을 7 mm두께로 잘라 식품 건조기(LD-918B; L'EQUIP, Korea)를 이용하여 70℃에서 0 h, 12 h, 18 h, 24 h에서 열풍 건조하였다. 시료 제조 과정 및 건조 전, 후를 Figure 1-3에 제시하였다.

Processes undertaken for sample preparation for physiological analysis and the drying of soldam plum (both flesh and peel) at various time intervals.

A comparison of the appearance of soldom plum flesh and peel by drying time.
(A) 0 hour dried plum flesh; (B) 12 hour dried plum flesh; (C) 18 hour dried plum flesh; (D) 24 hour dried plum flesh; (E) 0 hour dried plum peel; (F) 12 hour dried plum peel; (G) 18 hour dried plum peel; (H) 24 hour dried plum peel.
2) 추출물 제조
건조 시간을 달리하여 열풍 건조한 피자두(과육과 과피)의 항산화 활성 평가를 위해 Ko et al. (2015)과 Nam et al.(2017)의 열수 추출 방법을 사용하였다. 즉, 잘게 썬 시료들은 analytical balance (HR250A; A&D Company, Ltd., Japan)로 계량 후 각각의 시료(과육과 과피) 중량 대비 10배 부피의 증류수를 첨가하여 환류 냉각관을 부착한 80℃의 heating mantle (HM 250C; Sercrim Lab Tech, Korea)에서 2 h 동안 추출하였다. 모든 추출물은 진공펌프(Vacuum Pump, SM25PO45NL; Hyundai Micro, Korea)로 3회 여과 한 후 원심 분리기(Combi-514R; Hanil Scientific Inc., Korea)를 이용하여 4000 rpm에서 10 min간 원심 분리하였다. 여과액의 상충액을 필터 주사기(syringe filter)로 필터링하고. 필터링과 원심 분리를 5회 반복한 후 항산화 물질과 항산화 활성 평가용 시료로 사용하였다.
3. 생리활성 측정
1) 총 폴리페놀 함량 측정
열수 추출한 피자두(과육과 과피)의 총 폴리페놀 함량 측정은 F-C 시약을 사용하는 Singleton & Rossi (1965)의 방법을 변형하여 측정하였다.
희석한 각 시료 350 μL에 Folin-Ciocalteu (Sigma Chemical Co., USA)시약 70 μL를 가하여 실온에서 3 min간 정치한 다음, 2% (w/v) Na2CO3 용액 350 μL를 첨가하여 1 h 반응시킨 다음 ELISA microplate reader (Infinite M200 pro Nanoquant; Tecan Austria GmbH, Austria)를 사용하여 750 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 tannic acid를 이용하여 작성한 표준 곡선으로부터구하였고, mg TAE (tannic acid equivalent)/g으로 나타내어, 모든 실험은 3회 반복하여 평균값으로 나타내었다.
2) 총 플라보노이드 함량 측정
열수 추출한 피자두(과육과 과피)의 총 플라보노이드 함량 측정은 Davis (1947)의 방법을 응용하여 측정하였다. 각 시료 70 μL에 diethylene glycol 700 μL과 1N-NaOH 용액 7 μL를 차례로 첨가하여 vortex mixer로 10 s간 진탕한 후 37℃ Dry oven에서 1 h 반응시킨 후 420 nm에서 ELISA microplate reader (Infinite M200 pro Nanoquant; Tecan Austria GmbH)를 사용하여 420 nm 파장에서 흡광도를 측정하였다. 총 플라보노이드 함량 측정은 Quercetin을 표준 물질로 이용하여 작성한 표준 곡선으로부터 산출하였고, mg QE(quercetin equivalent)/g으로 나타내어, 모든 실험은 3회 반복하여 평균값으로 나타내었다.
3) DPPH radical scavenging activity
열수 추출한 피자두(과육과 과피)의 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical 소거능측정은 Blois (1958)의 방법을 응용하여 다음과 같이 실시하였다. 0.2 mM DPPH 용액을 517 nm에서 흡광도가 0.9-1이 되도록 99% 에탄올로 희석한 후 농도별로 희석한 시료 100 μL에 1.5×10-4 M DPPH 용액 100 μL를 가하여 vortex mixer로 10 s간 진탕한 후, 실온의 암실에서 30 min간 반응시킨 후 ELISA microplate reader (Infinite M200 pro Nanoquant; Tecan Austria GmbH)를 이용하여 517 nm 파장에서 흡광도를 측정하였다. 모든 실험은 3회 반복하여 평균값으로 나타내었다
4) ABTS radical scavenging activity
열수 추출한 피자두(과육과 과피)의 2,2-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid) (ABTS; Sigma-Aldrich, USA) radical 소거능은 Fellegrini et al. (1999)의 방법을 응용하여 측정하였다. 최종 농도가 7.4 mM인 ABTS와 2.6 mM인 potassium persulphate를 1:1로 혼합하여 실온의 암소에서 24 h 동안 반응시켜 ABTS 양이온을 형성시킨 다음 732 nm 파장에서 흡광도 값이 0.70±0.03가 되도록 phosphate buffered saline (PBS, pH 7.4)으로 희석하였다. 각각의 시료 10 μL에 희석된 ABTS용액 190 μL를 가하여 10 min간 반응시킨 다음 ELISA microplate reader (Infinite M200 pro Nanoquant; Tecan Austria GmbH)를 이용하여 732 nm에서 흡광도를 측정하였다. 모든 실험은 3회 반복하여 평균값으로 나타내었다.
4. 통계처리
실험 자료의 분석과 최적화는 Design Expert 10 (Stat-EaseInc., USA)을 이용하였으며, 이외 모든 자료는 SPSS statistics 27 (SPSS Institute, USA)을 이용하여 평균(mean)과 표준편차(standard deviation, SD)를 구하였다. 두 변수 간의 차이를 분석할 경우 Student's t-test를 실시하였다. 각각의 시료 간 유의성은 일원 배치분산분석(one-way ANOVA)을 실시한 후, Duncan's multiple range test로 각 시료 간의 평균 차이에 대한 사후 검정을 유의수준 5%에서 실시하였고, 변인 간의 상관관계는 Pearson의 상관계수 분석을 이용하였다.
Results and Discussion
1. 항산화 물질
천연 항산화제로서의 기능이 잘 알려진 식물체에는 2차 대사산물의 하나인 폴리페놀, 플라보노이드, phenolic acid, lignan, tannic acid 등과 같은 페놀화합물(Pehlivan, 2017; San Miguel-Chávez, 2017)이 다량 함유되어 있으며, 식물 유래 페놀성 물질 섭취는 활성 산소(reactive oxygen) 소거 및 항염증, 항바이러스 및 항암, 심혈관질환, 당뇨병 예방, 관절염 및 퇴행성 질환 예방 및 감소 등 다양한 생리활성 기능을 가지고 있어 건강에 도움을 준다고 알려져 있다(Catel-Ferreira et al., 2015; Kim et al., 2000; Zhang & Tsao, 2016).
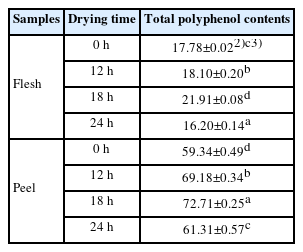
이에 본 연구는 Eom et al. (2021)의 선행연구를 참조하여 수 차례 예비 실험을 통해 2000 μg/mL의 농도에서 피자두 과육과 과피의 열수 추출 시료들을 건조 시간대별(0 h, 12 h, 18 h, 24 h)로 총 폴리페놀 함량과 총 플라보노이드 함량을 분석하여 Table 1-2에 제시하였다.
피자두의 과육과 과피의 총 폴리페놀 함량을 분석한 결과, 전체적으로 과피가 과육에 비해 총 폴리페놀 함량이 높게 나타났다. 건조 시간대별로 비교할 시, 과육과 과피 모두 건조시간이 18 h까지는 총 폴리페놀 함량이 증가하였으나, 24 h 건조시킨 시료들(과육과 과피)의 총 폴리페놀함량은 감소하였다. 생자두 과육(0 h 건조)의 경우 17.78±0.02 mg TAE/g에서 18 h 건조 후 21.91±0.08 mg TAE/g으로 가장 높은 함량으로 증가한 후 24 h 건조 후에는 16.20±0.14 mg TAE/g로 생과육(0 h 건조)보다 감소하는 경향이 나타났다. 생자두 과피(0 h 건조)의 경우 59.34±0.49 mg TAE/g에서 18 h 건조 후 72.71±0.25 mg TAE/g로 가장 높은 함량으로 증가한 후 24 h 건조 후에는 61.31±0.57 mg TAE/g로 18 h 건조 대비 함량이 감소하였다. 이는 붉은색의 자두품종에는 anthocyanin류인 cyanidin-3-glucoside 등과 같은 폴리페놀 성분도 다량 함유하고 있어 항산화 활성이 높으나(Donovan et al., 1998; Raynal et al., 1989b), anthocyanin은 빛과 열에 의해 쉽게 분해되므로, 총 페놀 함량은 건조시간이 길어질수록 anthocyanin의 함량이 감소하였다는 Kim et al. (2015)의 연구결과와 일치하였다. 또한, Raynal et al. (1989a)과 Raynal et al. (1989b)의 연구에서 생자두는 페놀 화합물의 풍부한 공급원이며, 과육보다 과피의 무게의 단위 당 약 5배 더 많은 페놀을 함유하고 있다는 것과 일치했다.
피자두의 과육과 과피의 총 플라보노이드 함량을 분석한 결과, 전체적으로 과피가 과육에 비해 총 플라보노이드 함량이 높게 나타났다. 건조 시간대별로 비교할 시, 과육과 과피 모두 건조시간이 18 h까지는 총 플라보노이드 함량이 증가하였으나, 24 h 건조시킨 시료들(과육과 과피)의 총 플라보노이드 함량이 감소하였다. 생자두 과육(0 h 건조)의 경우 9.00±0.21 mg QE/g에서 18 h 건조 후 14.30±0.36 mg QE/g으로 가장 높은 함량으로 증가한 후 24 h 건조 후에는 8.07±0.81 mg QE/g로 생과육(0 h 건조)보다 감소하는 경향이 나타났다. 생자두 과피(0 h 건조)의 경우 77.29±0.16 mg QE/g에서 18 h 건조 후 89.21±0.85 mg QE/g로 가장 높은 함량으로 증가한 후 24 h 건조 후에는 61.86±0.40 mg QE/g로 18 h 건조 대비 함량이 감소하였다. 이는 열풍 건조 처리 시 세포벽의 강한 결합력을 끊어 세포 내 플라보노이드의 용출량이 늘어 항산화 물질이 증가하였다는 Dewanto et al. (2002)와 Park (2004)의 연구와 일치하였다. 또한, 일정 시간 이상 열에 노출될 경우 항산화 물질의 변화가 발생하여 플라보노이드 함량이 감소하였다고 보고한 Oh et al.(2018)의 연구 결과와도 일치하였다.
2. 항산화 활성
DPPH radical은 비교적 안정한 free radical로 phenolic compound와 같은 전자공여체와 반응하여 전자나 수소를 받아들여 안정한 분자로 환원이 많이 될수록 보라색에서 점차 노란색으로 변화하여 흡광도가 감소하는 원리를 이용하여 분석하는 방법이다(Jung et al., 2008; Park & Ryu, 2019). ABTS radical 소거능이란 ABTS를 과황산 칼륨(potassium persulfate)과 암소에서 반응시켜 청록색의 ABTS radical를 미리 생성한 후 추출물의 항산화력에 의해 ABTS radical이 소거되어 radical 특유의 색이 탈색되는 원리를 이용하여 환원력을 측정하는 탈색반응이다(Lee, 2017; Oh et al., 2016). DPPH와 ABTS radical 소거능 은 항산화능을 지닌 페놀성 물질 함량이 높을수록 소거 활성이 증가된다고 알려져 있고(Kim et al., 2012a; RiceEvans et al., 1997) 대부분의 페놀성 물질이 free radical을 효과적으로 제거하지만 radical의 기질에 따라 선택적으로 작용하는 페놀성 물질이 존재하기 때문에 본 연구에서는 DPPH와 ABTS radical 소거활성 모두를 측정하여 과육과 과피의 항산화 활성을 비교 평가하였다.
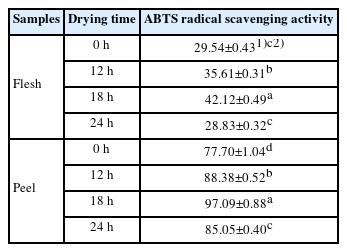
이에 본 연구는 Eom et al. (2021)의 선행연구를 참조하여 수 차례 예비 실험을 통해 2000 μg/mL의 농도에서 피자두 과육과 과피의 열수 추출 시료들을 건조 시간대별(0 h, 12 h, 18 h, 24 h)로 DPPH radical 소거능과 ABTS radical 소거능을 분석하여 Table 3-4에 제시하였다.
피자두의 과육과 과피의 DPPH radical 소거능을 분석한 결과, 전체적으로 과피가 과육에 비해 DPPH radical 소거능이 높게 나타났다. 건조 시간대별로 비교할 시, 과육과 과피 모두 건조시간이 18 h까지는 DPPH radical 소거능이 증가하였으나, 24 h 건조 시킨 시료들(과육과 과피)의 DPPH radical 소거능은 감소하였다. 생자두 과육(0 h 건조)의 경우 77.29±0.16%에서 18 h 건조 후 89.21±0.85%로 가장 높은 소거능을 보였고, 24 h 건조 후에는 61.86±0.40%로 생과육(0 h 건조)보다 소거능이 감소하였다. 생자두 과피(0 h 건조)의 경우 91.88±0.72%에서 18 h 건조 후 97.00±0.05%로 가장 높은 소거능을 보였고, 24 h 건조 후에는 93.95±0.34%로 18 h 건조보다 소거능이 감소하였다.
피자두의 과육과 과피의 ABTS radical 소거능을 분석한 결과, 전체적으로 과피가 과육에 비해 ABTS radical 소거능이 높게 나타났다. 건조 시간대별로 비교할 시, 과육과 과피 모두 건조시간이 18 h까지는 ABTS radical 소거능이 증가하였으나, 24 h 건조시킨 시료들(과육과 과피)의 ABTS radical 소거능이 감소하였다. 생자두 과육(0 h 건조)의 경우 29.54±0.43%에서 18 h 건조 후 42.12±0.49%로 소거능이 증가하였으나, 24 h 건조 후에는 28.83±0.32%로 생과육(0 h 건조)보다 소거능이 감소하였다. 생자두 과피(0 h 건조)의 경우 77.70±1.04%에서 18 h 건조 후 97.09±0.88%로 소거능이 증가하였으나, 24 h 건조 후에는 85.05±0.40%로 18 h 건조 대비 소거능이 감소하였다. 식용꽃을 열풍 건조 시 10 h까지는 DPPH radical 소거능과 ABTS radical 소거능이 증가하였지만 15 h 건조 시 소거능이 감소하였다는 Oh et al. (2018)의 연구결과와 일치하였다. 이는 장시간 열에 노출되었을 때 세포벽 파괴를 넘어 항산화 물질까지 파괴되어 항산화 활성에 영향을 미친 것으로 판단된다(Park & Kim, 2018).
3. 항산화 물질과 항산화 활성 간의 상관관계
본 연구는 자두의 항산화 물질(총 폴리페놀, 총 플라보노이드 함량)과 항산화 활성(DPPH radical 소거능, ABTS radical 소거능)과의 상관관계를 분석하고자 Pearson 상관분석을 실시하여 Table 5에 제시하였다.

Correlation coefficients among antioxidant substances contents and antioxidant activities of soldom plum (flesh & peel) with different hot-air drying time
Bertoncelj et al.(2007)과 Wu & Ng (2008)의 연구를 통하여 phenolic acid, 폴리페놀 및 플라보노이드와 같은 페놀 화합물과 항산화 활성과의 상관관계가 있음이 입증되어 있다. 자두의 항산화 물질(총 폴리페놀, 총 플라보노이드), 항산화 활성(DPPH radical 소거능, ABTS radical 소거능)과의 상관관계를 분석한 결과, 모두 정의 상관관계를 보여 자두의 생리활성이 입증되었다. 이는 항산화 물질과 항산화 활성 간에 상관관계가 높다고 보고한 기존의 연구들(Hwang et al., 2015; Sentkowska & Pyrzynska, 2020)과 일치하였다.
Conclusion
본 연구에서는 한국산 동양계 피자두(Prunus salicina L., soldom)의 과육과 과피의 건조 온도 70℃에서 최적의 열풍 건조 시간을 찾기 위하여 열풍 건조 시간(0 h, 12 h, 18 h, 24 h)별로 항산화 물질(총 폴리페놀 함량, 총 플라보노이드 함량)과 항산화 활성(DPPH radical 소거능, ABTS radical 소거능)을 비교 분석 한 후, 항산화 물질과 항산화 활성 간의 상관 관계를 분석하였다.
피자두의 과육과 과피를 시간별(0 h, 12 h, 18 h, 24 h)로 열풍 건조하여 항산화물질과 항산화 활성을 비교한 결과 18 h까지는 열풍 건조 시간이 증가함에 따라 높아졌으나 24 h 건조 시에는 감소하였다. 18 h까지는 열 반응성에 따라 항산화 물질 함량 및 활성이 증가하였으나 건조 시간이 더 경과함에 따라 항산화 물질이 열에 의해 파괴되어 항산화 활성이 떨어졌을 것으로 판단된다. 따라서 피자두 열풍 건조 처리 시 18 h 열풍 건조가 자두의 항산화 물질 함량 및 활성 증가에 최적 건조 시간으로 판단된다. 자두의 항산화 물질(총 폴리페놀, 총 플라보노이드 함량)과 항산화 활성(DPPH radical 소거능, ABTS radical 소거능)과의 상관관계를 분석한 결과, 모두 정의 상관관계를 보여 피자두의 생리활성이 입증되었다. 따라서 차후 기능성 식품 개발 시 18 h 열풍 건조한 피자두 과피를 이용한다면 생자두와 달리 계절의 제약없이 사용이 가능할 것으로 판단된다.
Notes
This work is part of the Hee-Jae Chung's M.S. thesis at the Kyonggi University, Seoul, Korea.
Author's contribution
K.A.J. designed all experimental design. C.H.J. collected literature and contributed to all aspects of analysis and experiment. C.H.J. wrote the manuscript with assistance from K.A.J.
Author details
Hee-Jae Chung (Graduate Student), Department of Alternative Medicine, Kyonggi University, 24, Kyonggidae-ro 9 gil, Seodaemun-gu, Seoul 03746, Korea; Ae-Jung Kim (Professor), Department of Nutrition Therapy, Graduate School of Alternative Medicine, Kyonggi University, 24, Kyonggidae-ro 9 gil, Seodaemun-gu, Seoul 03746, Korea.