요약방법단풍나무 잎을 수확 시기별로 추출한 후, 총 폴리페놀 함량, 총 플라보노이드 함량,P DPH radical 소거 활성, 세포독성, 그리고 Staphylococcus aureus, Bacillus subtilis 그리고 Pseudomonas aeruginosa에 대해 항균 활성을 측정하였다.
AbstractPurposeThis study aimed to investigate the optimal collection time of Acer palmatum extract (APE) through anti-oxidant and anti-bacterial activities.
MethodsWe confirmed the anti-oxidant activity of APE by estimating the total polyphenol content, total flavonoid content, 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging effect, and cell viability. In addition, we determined anti-bacterial activities against Staphylococcus aureus, Bacillus subtilis, and Pseudomonas aeruginosa during growth.
ResultsAnti-oxidant activities of APE peaked in July and November. RAW 264.7 displayed high cell viability in APE concentrations of 5–100 μg/mL in July and November. As a result of conducting anti-bacterial activities, seasonal variation of APE against three bacteria was exhibited.
ConclusionThe anti-oxidant and anti-bacterial activities of APE showed seasonal variation, and high cell viability in July and November; therefore, consideration of the optimal seasonal collection time for Acer palmatum could be an important factor attributing to its natural antioxidant properties and the optimal collection time was confirmed especially to be in July and November.
Introduction최근에 자연지향적이고 환경친화적인 소비형태와 함께 합성 항산화제의 독성이 보고되면서 화장품 산업에서도 천연유래 물질을 이용하여 항산화, 항균, 항알러지, 항염, 그리고 항노화 등의 생리활성을 가진 화장품 소재 개발이 활발히 이루어지고 있다(Park, 2005).
피부에는 활성산소종의 생성을 촉진하는 불포화지방산이 풍부하고 자외선에 의해 생성된 활성산소가 matrix metalloproteinase (MMP)의 발현을 유도하여, 진피층의 collagen, elastin, glycosaminoglycan의 사슬을 절단시켜서 피부 주름을 생성시키고, 또한 피부 내 세포의 DNA 손상은 염증 과정과 알러지 반응에 관여하여 아토피 피부염과 여드름, 건선, 피부암 등의 피부질환과 피부노화를 유발한다(Kim et al., 2016).
식물은 외부자극 및 광합성 과정에서 발생되는 활성산소종에 의한 산화적 손상으로부터 보호할 수 있는 폴리페놀 화합물인 flavonoid, anthocyanin, tannin, catechin 등의 산화방지 물질을 다량 함유하고 있어 산화적 스트레스를 유발하는 자유라디칼의 생성을 지연시키거나 활성을 억제하는 것으로 알려져 있다(Pyo et al., 2004).
단풍나무는 단풍나무과(Aceraceae)에 속하는 활엽수종으로, 학명은 Acer palmatum Thunb.이다. 단풍나무속에는 약 150종이 우리나라를 비롯한 동아시아와 북미, 유럽 등의 북반구 온대지역에 분포하고 있다(Lim, 1997). 단풍나무에서 채취된 수액은 천연감미료로 이용되는데, 수액(樹液)의 주성분은 자당이고, 이외에도 카르복실산, 페놀, 페닐배당체, 올리고당, 바닐린, 아미노산을 포함한다(Ball, 2007). 단풍나무는 중국과 일본, 우리나라에서 약용식물로 사용하며 류머티즘, 타박상, 안과질환, 통증, 해독 등 다양한 질환치료에 효과적인 것으로 알려져 있다. 34개 단풍나무속에서 flavonoids (18.7%), tannins (12.4%), diarylheptanoids (8.8%), phenylpropanoids (22.4%), phytosterols (9.7%) 등의 331개의 생리활성 물질이 확인되었으며, 전체 화합물의 5분의 1에 해당하는 플라보노이드가 함유되어 있는 것으로 보고되었다(Aritomi, 1963; Bi et al., 2016).
현재까지 진행된 단풍나무속에 관한 선행 연구로는 항산화 활성(Schmitzer et al., 2009; Prihantini et al., 2014), 항균 활성(Webb & Agnihotri, 1970), 항염 효과(Ding et al., 2010), 항암 효과(González-Sarrias et al., 2012) 등에 대하여 보고된 바 있으나, 수확시기별 단풍나무의 항산화 활성과 항균 활성을 비교한 연구는 미비한 실정이다. 식물의 생리활성 물질은 구조와 특성이 매우 다양하고 여러 가지 조건에서 생리활성 물질의 함량이 다르므로 수확시기별 생리활성 물질의 함량을 조사하는 것은 어려운 일이다. 그러나 최근 식물의 생리활성 성분이 가장 많이 함유되는 시기를 규명하여 약용식물 생산에 이용하고 있다(Oh et al., 2015). 해당화 잎의 시기별 연구에 따르면 11월에 채취한 해당화의 잎이 9월에 비해 ascorbic acid 함량이 1.7배 정도 높았으며(Kim et al., 2001), 인삼 잎의 총 사포닌 함량이 4월에 비해 5월에 8배 가량 증가한 연구 결과(Choi et al., 2009a)가 있다.
따라서 본 연구에서는 단풍나무 추출물의 수확시기에 따른 항산화 함량과 활성을 측정하고 항균 활성을 비교하여, 항산화능과 항균 활성이 높은 적정 수확시기 및 이용시기를 도출하고자 하였다. 또한 본 연구가 천연 항산화제로서의 이용가능성 검토에 기초자료로 활용되기를 기대한다.
Methods1. 시료준비본 실험에 사용된 단풍나무(Acer palmatum)의 잎은 서울 광진구 능동로 건국대학교 교내의 단풍나무에서 채취하여 수세한 후 자연 건조시키고 분쇄하였다. 단풍나무는 낙엽활엽 교목으로 잎이 핀 4월부터 낙엽이 되기 전 11월까지를 사용하였다. 건조 시료 2 g에 70% 에탄올을 10배 가해 60℃, 3 h 동안 water bath (SB-1200; EYELA, Japan)에서 추출하였다. 원심분리기(VS-4000i; Vision Scientific, Korea)를 이용하여 3500 rpm, 15 min 동안 추출물을 원심분리한 후, 여과지(Whatman No.2; GE Healthcare Life Sciences, USA)로 상층액을 여과하고, 감압농축기(N-1110; EYELA)를 사용하여 에탄올을 제거한 후, 동결 건조하여 분말형태의 추출물(Acer palmatum extract, APE)을 사용하였다.
2. 실험시약본 연구에 사용된 시약 ethanol, Folin & Ciocalteu's phenol reagent, sodium carbonate (Na2CO3), gallic acid, potassium acetate, aluminium nitrate, quercetin, 1,1-diphenyl-2-picrylhydrazyl (DPPH), methanol, ascorbic acid, penicillin, streptomycin, neutral red solution (NR solution), formaldehyde, phosphate buffered saline (PBS), NR desorb solution은 Sigma-Aldrich (USA)를 사용하였고, high glucose Dulbecco's modified Eagle's medium (DMEM)과 fetal bovine serum (FBS)는 Thermo Scientific (USA)를 사용하였다.
3. 항산화 측정1) 총 폴리페놀 함량총 폴리페놀 함량은 Folin-Ciocalteu method (Singleton & Rossi, 1965)를 수정하여 Folin-Ciocalteu's phenol reagent가 시료의 페놀성 화합물에 의해 환원되어, 몰리브덴 청색으로 발색되는 원리를 이용하여 정량하였다. 증류수 용액에 시기별 APE를 1 mg/mL 농도로 희석한 후, APE 100 μL와 Folin-Ciocalteu's phenol reagent 750 μL을 혼합하여 5 min 동안 반응시킨 뒤, 1 M Na2CO3를 750 μL를 혼합하여 암실에서 60 min 동안 반응시킨 후 765 nm에서 UV spectrophotometer (Optizen 2120 UV; Mecasys, Korea)를 사용하여 흡광도를 측정하였다. 이때 gallic acid를 표준물질로 사용하여 0-100 μg/mL 농도로 제조한 검량곡선을 작성하고 이로부터 총 폴리페놀 함량을 구하였다.
2) 총 플라보노이드 함량총 플라보노이드 함량 측정은 Moreno et al. (2000)의 방법을 이용하였다. 증류수 용액에 시기별 APE를 1 mg/mL 농도로 희석한 후, APE 100 μL와 1 M potassium acetate 20 μL를 혼합하여 40 min 방치한 후 10% aluminium nitrate 20 μL와 80% ethanol 860 μL를 혼합하여 실온에서 40 min 동안 방치한 후 UV spectrophotometer 를 이용하여 415 nm에서 흡광도를 측정하였다. 이때 총 플라보노이드 함량은 quercetin을 표준물질로 사용하여 0-100 μg/mL 농도로 제조한 검량 곡선을 작성하고 이로부터 총 플라보노이드 함량을 구하였다.
3) DPPH radical 소거활성APE의 산화방지 활성을 측정하기 위하여 DPPH를 사용한 Blois (1958)의 방법을 응용하여 측정하였다. 각 시료의 DPPH에 대한 전자공여 효과로써 시료의 환원력을 측정하였다. 메탄올 용액에 녹인 0.2 mM DPPH 용액 800 μL와 시기별로 메탄올 용액에 녹인 APE 200 μL를 혼합하여 최종 농도 125 μg/mL가 되도록 희석한 후, 암실에서 20 min 동안 반응시키고 microplate reader (Synergy-HT; BioTek Instruments, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH radical 소거활성은 아래의 식에 의해 계산하여 산출하였으며, 양성대조군은 ascorbic acid를 사용하여 활성을 비교하였다. 또한 APE와 ascorbic acid의 농도별 DPPH radical 소거활성을 확인하기 위해, 위와 동일한 방법으로 메탄올 용액에 녹인 0.2 mM DPPH 용액 800 μL와 메탄올 용액에 녹인 시료(APE 및 ascorbic acid) 200 μL를 혼합하여 최종 농도 10, 50, 100, 1000 μg/mL가 되도록 희석한 후, 암실에서 20 min 동안 반응시켜 517 nm에서 흡광도를 측정하였다.
DPPH radical 소거활성(%)=100-(시료 첨가군의 흡광도)/(시료 무첨가군의 흡광도)×100
4. 세포배양실험에 사용한 세포주 RAW 264.7은 한국세포주은행(Korea)에서 분양하여 사용하였고, 배양 시에는 DMEM에 사용하였으며, 10% FBS와 1% penicillin (100 IU/mL), 1% streptomycin (50 μg/mL)을 첨가하여 37℃로 유지되는 5% CO2 습윤 배양기에서 배양하였다.
5. Neutral red assay를 이용한 세포독성 측정실험에서 사용된 시료의 독성 농도 범위를 알아보기 위하여 neutral red assay (NR assay)를 이용하여 측정하였다(Borenfreund & Puerner, 1985). 세포주는 RAW 264.7 세포를 사용하였으며, 96 well plate에 3×104cells/well의 농도로 분주하여 24 h 동안 37℃, 5% CO2 배양기에서 부착시켰다. 세포 부착 확인 후 APE를 DMEM 배지에 녹여 5, 10, 25, 50, 100 μg/mL 농도가 되도록 첨가하여 48 h 배양하였다. 배양한 세포는 배양액을 NR solution이 1% 포함된 무혈청 배지로 교환하여 3 h 배양한 다음, 현미경으로 관찰하여 NR의 결정화 유무를 확인하였다. 세포고정액으로 formaldehyde 용액 10%가 첨가된 PBS를 각 well에 100 μL로 20 min 처리하여 고정하였다. NR desorb solution (1% glacial acetic acid, 49% ethanol, 50% distilled water)을 각 well에 100 μL씩 분주하여 세포내의 NR을 추출하고 microplate reader를 이용하여 540 nm에서 흡광도를 측정하였고, 세포 생존율은 다음의 식에 따라 계산하였다. 세포 독성 실험은 동일한 조건하에 독립적으로 3회 반복 실시하여 평균±표준편차(mean±standard deviation)로 표기하였다.
세포생존율(%)=(시료 첨가군의 흡광도)/(시료 무첨가군의 흡광도)×100
6. 항균실험항균실험의 실험방법은 다음과 같다. 그람양성균인 Staphylococcus aureus (S. aureus, 6538™; ATCC, USA), Bacillus subtilis (B. subtilis, 19659™; ATCC), 그리고 그람음성균 Pseudomonas aeruginosa (P. aeruginosa, 29336™; ATCC)을 액체배지(nutrient broth; Difco, Becton, Dickinson and Company, USA)에 접종하고 30℃에서 24 h 동안 배양시킨 후 시험에 사용하였으며, APE는 메탄올을 이용하여 700, 1000 μg/mL 농도로 제조하여 사용하였다. S. aureus와 B. subtilis, 그리고 P. aeruginosa 각각의 배양액을 Muller Hinton agar 평판배지(Difco)에 멸균된 면봉으로 고르게 도말하였다. 멸균된 paper disk (6.0 mm)에 시료 약 40 μL를 흡수시키고, 메탄올 용매를 휘발시키기 위해 상온에서 1 h 동안 방치한 후, 배지에 올리고 30℃에서 18 h 동안 배양하여 형성된 clear zone을 확인하였다. 항균실험의 대조군으로는 메탄올을 사용하였다.
Results and Discussion1. 항산화능수확시기별 총 폴리페놀 함량은 4월에 105.94±2.84 μg/mg을 나타낸 후 7월에는 173.32±5.67 μg/mg까지 증가하였다. 8월 이후 감소하여 10월에는 114.54±2.92 μg/mg 을 나타내다가 11월에는 191.86±5.32 μg/mg로 다시 증가하였다(Figure 1). 총 플라보노이드 함량은 4월, 7월, 10월, 11월에 각각 34.83±0.92, 51.71±2.10, 31.50±1.12, 44.15±1.65 μg/mg을 나타내어 총 폴리페놀의 결과와 유사한 경향을 나타내었다(Figure 2). DPPH radical 소거능은 125 μg/mL에서 각각 4월, 7월, 10월, 11월에 60.76%, 79.81%, 61.48%, 81.46%로 나타났다(Figure 3). 총 폴리페놀 함량과 DPPH radical 소거활성이 높은 11월 시료를 사용하여 대조물질인 ascorbic acid를 사용하여 농도별로 비교해본 결과, 추출물의 농도가 증가함에 따라 DPPH radical 소거능도 증가하는 것을 확인하였다(Figure 4). Kim et al. (2005)의 연구에서는 단풍나무 잎이 70%의 superoxide 소거활성과 60%의 DPPH radical 소거활성을 나타냈으며, Kim et al. (2007)의 제주도 자생식물 탐색에서는 단풍나무 잎이 IC50 5.44 μg/mL로 254종의 식물 가운데 두 번째로 높은 항산화 효과를 보였다. 이러한 연구결과에 비추어볼 때 단풍나무 추출물이 천연 항산화제로서 활용할 수 있을 것으로 판단된다.
식물은 온도와 강수량 또는 토양적 차이로 동일한 나무라도 수확시기와 재배지역에 따라 생리활성 성분에 차이가 날 수 있다(Yim et al., 2016). 참죽나무 잎의 quercitrin 함량의 경우, 7월과 8월에 각각 8.89, 7.94 mg/g으로 최대치를 보이다가 9월부터 감소하였고(Park & Kim, 1995), 꾸지뽕나무 열매의 isoflavonoid 화합물은 7월과 8월에 함량이 증가하였다가 9월에 감소하고 성숙과에서 성분이 증가되어(Yoon et al., 2016) 본 연구와 유사한 경향을 보였다. 또한 Kang et al. (2004)의 감잎과 뽕잎의 항산화 성분을 수확시기별 조사한 결과, polyphenol, ascorbic acid 및 glutathione의 함량은 잎이 성숙할수록 감소되었으나, β-carotene과 α-tocopherol의 함량은 잎이 성숙함에 따라 증가되어 동일 식물이라도 생육 시기에 따라 생리활성 물질의 함량이 다르며 생리활성 성분의 함량이 최고에 달하는 시기도 다른 것으로 나타났다.
따라서 본 연구 결과에서 단풍나무 추출물의 총 폴리페놀 함량과 총 플라보노이드 함량이 수확시기에 따라 변화를 나타낸 것은 앞서 제시한 선행연구의 결과들과 상통하는 것이며, 이에 따라 단풍나무 추출물을 천연 항산화제로써 활용함에 있어, 수확시기는 매우 중요한 요소로 작용할 것임을 알 수 있다.
2. RAW 264.7 세포에 대한 세포독성세포의 증식과 생존율을 확인하기 위하여 항산화 함량과 활성이 높은 7월과 11월 시료를 선정하여 NR assay를 실시하였다. RAW 264.7 세포에 대해 APE를 5, 10, 25, 50, 100 μg/mL 농도별로 세포독성을 실험한 결과, 농도 100 μg/mL에서 세포생존도가 7월과 11월에 각각 102%, 90% 이상 유지하는 것을 확인할 수 있었다(Figure 5). 선행 연구인 가을철 붉게 물든 단풍나무의 잎에서 분리한 vitexin의 세포독성을 MTT assay로 분석한 결과, 100 μg/mL 농도에서 85% 이상의 세포생존율을 보여 농도 10-100 μg/mL까지는 세포독성을 유발하지 않는 것을 확인하였다(Kim et al., 2005). 본 연구에서도 100 μg/mL 농도까지 RAW 264.7 세포생존율이 90% 이상 유지되는 것으로 나타나 APE가 세포생존율에 크게 영향을 주지 않는 것으로 해석된다.
3. 항균실험3가지 균주(S. aureus, B. subtilis, P. aeruginosa)에 대해 APE의 시기별, 농도별 항균 활성을 비교하였다. 준비된 평판 배지 위에 각각의 배양액을 멸균된 면봉으로 고루 접종하고, 멸균된 paper disk에 시료 약 40 μL를 처리하여 배지 중앙에 올려놓은 다음 30℃에서 S. aureus와 B. subtilis, 그리고 P. aeruginosa를 18 h 배양하여 형성된 clear zone을 측정하였다.
항균실험의 대조군은 메탄올 용매를 사용하였으며, 메탄올 용매를 휘발시키기 위해 상온에서 1 h 동안 방치한 후, 배지에 올리고 30℃에서 18 h 동안 배양한 결과, 형성된 clear zone이 없는 것을 확인하였다. 실험에 사용한 3종의 균주는 시기별로 다른 항균력을 나타내는 것으로 확인되었다. 특히 S. aureus와 B. subtilis는 700, 1000 μg/mL 농도에서 4월부터 11월까지 시기별로 모두 항균 활성을 나타냈다. S. aureus의 경우, APE의 1000 μg/mL 농도에서 5, 6월에 최대 13 mm의 clear zone을 형성하였으며, B. subtilis에 대해서는 동일한 농도에서 7, 8월에 최대 9 mm의 clear zone을 형성하였다. P. aeruginosa는 700 μg/mL에서는 항균 활성이 나타나지 않았고, 1000 μg/mL 농도에서 6-8월과 11월에만 8 mm의 clear zone을 나타내어 다른 균주에 비해 낮은 항균력을 나타내었다(Table 1).
식물 성장에 관련된 과정은 계절 변화에 따라 달라진다. 사철쑥의 수확시기별 항균 활성을 측정한 결과, S. aureus와 B. subtilis는 8월에 항균성이 높았지만, P. aeruginosa는 7월에 높은 항균력을 나타냈다. 이러한 결과는 식물의 생리활성 성분의 생성과 함량이 시기적으로 다르기 때문으로 추정된다(Choi et al., 2009b). 따라서 단풍나무 추출물의 항균성은 다양한 물질에 의해 나타나는 것으로 생각되며, 항균 활성을 가진 성분이 시기별로 다르게 발현된 것으로 생각된다. 또한 그람 음성균보다 그람 양성균에서 항균 활성이 높게 나타난 것은 그람 양성균의 세포벽은 peptidoglycan이 표면에 노출되어 항균 활성 물질의 공격을 받기 쉽지만, 그람 음성균은 lipopolysaccharide를 주성분으로 하는 외막이 peptidoglycan을 보호하는 작용을 하기 때문인 것으로 사료된다(Nakamura et al., 1991).
Conclusion수확시기별 APE의 항산화 효과와 항균 활성에 미치는 영향을 객관적으로 검증한 결과는 다음과 같다.
첫째, APE의 총 폴리페놀 및 플라보노이드 함량 측정 결과, 7월과 11월의 총 폴리페놀 함량은 각각 173.32±5.67, 191.86±5.32 μg/mg으로 나타났으며, 총 플라보노이드 함량은 7월과 11월에 각각 51.71±2.10, 44.15±1.65 μg/mg으로 나타나 수확시기별로 함량이 변하고 있음을 확인할 수 있었다(Figure 1, 2).
둘째, APE의 항산화 활성 측정결과 125 μg/mL 농도에서 7월과 11월에 각각 79.81%, 81.46%의 항산화능을 나타내었고, APE에 대한 DPPH radical 소거능은 농도의존적으로 증가하였다(Figure 3, 4).
셋째, APE의 RAW 264.7 세포에 대한 독성은 대조군에 비하여 100 μg/mL에서 90% 이상의 세포 생존율을 나타내어 안전한 것으로 확인되었다(Figure 5).
넷째, APE의 항균 활성을 측정결과, S. aureus와 B. subtilis는 700, 1000 μg/mL 농도에서 수확시기별로 모두 항균 활성을 나타냈으며, P. aeruginosa는 700 μg/mL에서는 항균 활성이 나타나지 않았다. APE의 1000 μg/mL 농도에서 S. aureus는 5, 6월에 최대 13 mm, B. subtilis는 7, 8월에 최대 9 mm의 clear zone을 형성하였으며, P. aeruginosa는 6-8월과 11월에만 8 mm의 clear zone을 나타내어 다른 균주에 비해 낮은 항균 활성을 나타내었다(Table 1).
이러한 결과들을 토대로 단풍나무 추출물의 항산화 활성과 항균 활성이 일정한 농도로 존재하지 않고 수확시기에 따라 함량이 변하고 있음을 확인하였다. 즉, 단풍나무 추출물은 여름철에 활발한 광합성의 대사과정에서 ascorbic acid 농도와 superoxide dismutase 활성이 증가하여 항산화능이 높아진 것으로 판단되며(Lepeduš et al., 2011), 11월에는 단풍나무의 잎에 축적된 당이 안토시아닌의 원료가 되어 항산화능이 높아진 것으로 사료된다(Lee & Moon, 2005). 이에 단풍나무 추출물을 천연 항산화제로 활용할 경우 수확시기는 중요한 요소로 작용할 것임을 확인하였고, 향후 수확시기별 이화학적 특성 및 생리활성 성분의 변화에 대한 메커니즘 연구의 필요성을 제언한다.
NOTESAuthor's contribution
YWS as first author designed and performed an experiment regarding this manuscript. Additionally, YWS wrote it. MJC supported all experiments including sample collection, analysis of anti-oxidant and anti-bacterial activity, and extraction from maple leaves. YKC, HS, and SYS assisted with experimental design and analyzed some correlation with statistics program. JY and KJK revised and reviewed this manuscript. HJK as corresponding author reviewed overall sections and experiments in this manuscript. All authors read and approved the final version of manuscript.
Figure 1.Seasonal variation of total polyphenol content in APE.Polyphenol content in Acer palmatum extract (APE) appeared to peak in November. The results are expressed as mean±standard deviation from three independent experiments. The calibration curve of gallic acid (0–100 μg/mL) as a standard material is y=0.006902x+0.070775, R2=0.971. Different letters (a-f) indicate significant difference (p <0.05). APE, Acer palmatum extract.
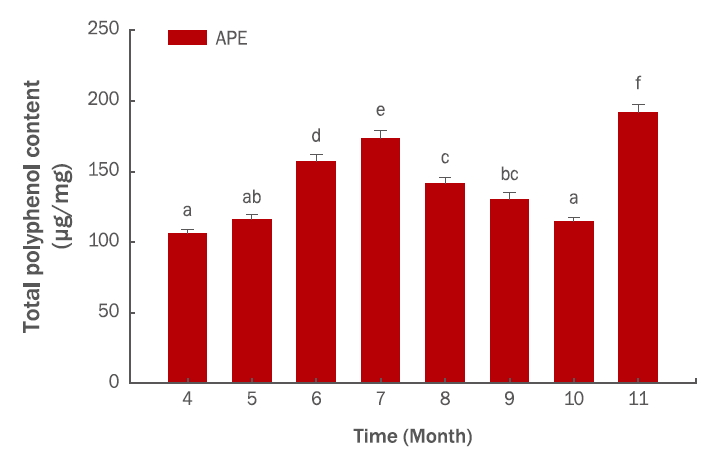
Figure 2.Seasonal variation of total flavonoid content in APE.Total flavonoid content in APE appeared to peak in July. The results are expressed as mean±standard deviation from three independent experiments. The calibration curve of quercetin (0– 100 μg/mL) as a standard material is y=0.006298x+0.004625, R2=0.999. Different letters (a-e) indicate significant difference (p <0.05). APE, Acer palmatum extract.
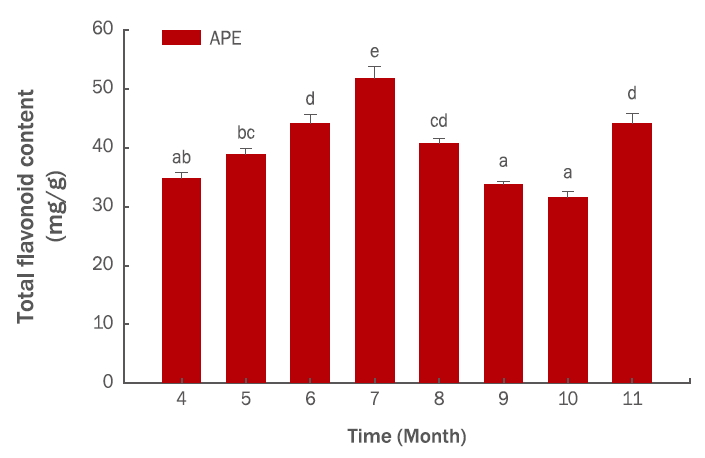
Figure 3.Seasonal variation of DPPH radical scavenging activity in APE.APE and AA were measured at concentrations of 125 μg/mL. AA was used as a positive control. DPPH radical scavenging activity in APE appeared to peak in November. The results were expressed as mean±standard deviation from three independent experiments. Different letters (a-c) indicate significant difference (p <0.05). APE, Acer palmatum extract; AA, ascorbic acid; DPPH, 2,2-diphenyl-1-picrylhydrazyl.
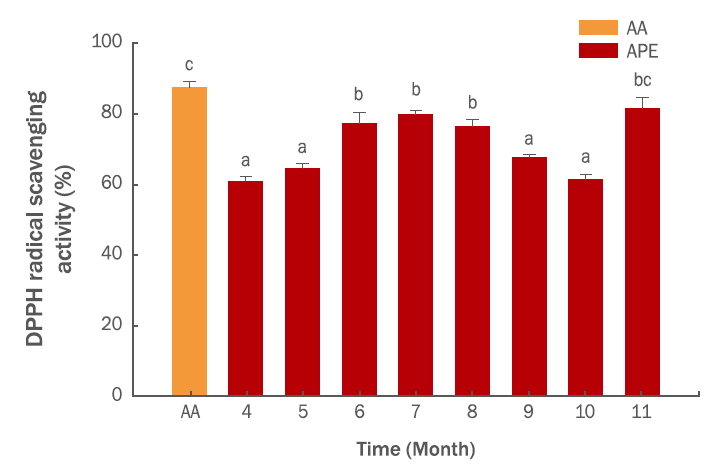
Figure 4.DPPH radical scavenging activity of AA and APE in November according to concentration.DPPH radical scavenging activity of AA and APE was measured at concentrations of 10, 50, 100, and 1000 μg/mL. AA was used as a positive control. The activity of APE and AA increased in a concentration-dependent manner. The results are expressed as mean±standard deviation from three independent experiments. Different letters (AA, a-c; APE, a-d) indicate significant difference (p <0.05). APE, Acer palmatum extract; AA, ascorbic acid; DPPH, 2,2-diphenyl-1-picrylhydrazyl.

Figure 5.Cell viability of RAW 264.7 cells in APE.Each cell was treated with 5, 10, 25, 50, and 100 μg/mL of APE for 48 h. Cell viability of RAW 264.7 cells in APE showed more than 90% at a concentration of 5–100 μg/mL of APE in July and November. The results are expressed as mean±standard deviation from three independent experiments. Different letters (a-d) indicate significant difference (p <0.05). APE, Acer palmatum extract.
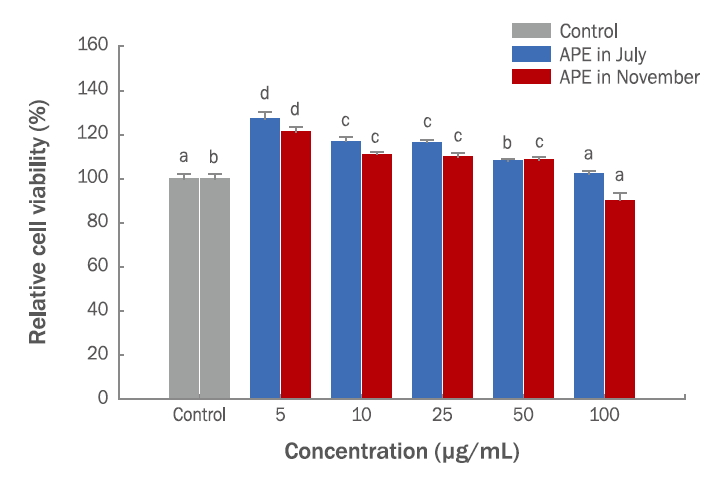
Table 1.Anti-bacterial effect of APE using the paper disc method from April to November ReferencesAritomi M. Chemical constituents in aceraceous plants: I. Flavonoid constituents in the leaves of Acer palmatum Thunberg. Yakugaku Zasshi 83: 737-740. 1963.
Ball DW. The chemical composition of maple syrup. Journal of Chemical Education 84: 1647-1649. 2007.
Bi W, Gao Y, Shen J, He C, Liu H, Peng Y, Zhang C, Xiao P. Traditional uses, phytochemistry, and pharmacology of the genus Acer (maple): a review. Journal of Ethnopharmacology 189: 31-60. 2016.
Blois MS. Antioxidant determinations by the use of a stable free radical. Nature 181: 1199-1200. 1958.
Borenfreund E, Puerner JA. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters 24: 119-124. 1985.
Choi JE, Li X, Han YH, Lee KT. Changes of saponin contents of leaves, stems and flower-buds of Panax ginseng C. A. Meyer by harvesting days. Korean Journal of Medicinal Crop Science 17: 251-256. 2009a.
Choi SR, You DH, Kim JY, Park CB, Kim DH, Ryu J, Choi DG, Park HM. Antimicrobial activity of methanol extracts from Cudrania tricuspidata Bureau according to the parts harvested and time. Korean Journal of Medicinal Crop Science 17: 335-340. 2009b.
Ding Y, Liang C, Kim JH, Lee YM, Hyun JH, Kang HK, Kim JA, Min BS, Kim YH. Triterpene compounds isolated from Acer mandshuricum and their anti-inflammatory activity. Bioorganic & Medicinal Chemistry Letters 20: 1528-1531. 2010.
González-Sarrias A, Li L, Seeram NP. Effects of maple (Acer) plant part extracts on proliferation, apoptosis and cell cycle arrest of human tumorigenic and non-tumorigenic colon cells. Phytotherapy Research 26: 995-1002. 2012.
Kang JY, Kim SJ, Park S. Changes in antioxidants of several plant leaves during growth. Journal of Life Science 14: 104-109. 2004.
Kim JH, Lee BC, Kim JH, Sim GS, Lee DH, Lee KE, Yun YP, Pyo HB. The isolation and antioxidative effects of vitexin from Acer palmatum. Archives of Pharmacal Research 28: 195-202. 2005.
Kim KS, Han SH, An IS, Ahn KJ. Protective effects of ellagic acid against UVA-induced oxidative stress in human dermal papilla. Asian Journal of Beauty & Cosmetology 14: 191-200. 2016.
Kim MJ, Kim JS, Kim KE, Shin KH, Heo K, Cho DH, Park CH, Yu CY. Comparison of antioxidative activities from different organs of Rosa rugosa Thunb. Korean Journal of Medicinal Crop Science 9: 40-44. 2001.
Kim SS, Hyun CG, Lee J, Lim J, Kim JY, Park D. In vitro screening of Jeju medicinal plants for cosmeceutical materials. Applied Biological Chemistry 50: 215-220. 2007.
Lee SP, Moon JD. Dyeability and antibacterial activities of maple leaves extracts. Journal of Korea Society of Color Studies 19: 13-19. 2005.
Lepeduš H, Gaća V, Viljevac M, Kovač S, Fulgosi H, Simić D, Jurković V, Cesar V. Changes in photosynthetic performance and antioxidative strategies during maturation of Norway maple (Acer platanoides L.) leaves. Plant Physiology and Biochemistry 49: 368-376. 2011.
Lim DO. Anatomical aspects in the stem of Korean aceraceous plant. Journal of the Industrial Technology 4: 247-252. 1997.
Moreno MI, Isla MI, Sampietro AR, Vattuone MA. Comparison of the free radical-scavenging activity of propolis from several regions of Argentina. Journal of Ethnopharmacology 71: 109-114. 2000.
Nakamura S, Kato A, Kobayashi K. New antimicrobial characteristics of lysozyme-dextran conjugate. Journal of Agricultural and Food Chemistry 39: 647-650. 1991.
Oh KJ, Kim MJ, Han JS, Ji EH, Kim AJ. Comparative biological properties of Prunus davidiana fruits according to harvest month. The Korean Journal of Food and Nutrition 28: 643-649. 2015.
Park CS. Antioxidative and nitrite scavenging abilities of medicinal plant extracts. Korean Journal of Food Preservation 12: 631-636. 2005.
Park JC, Kim SH. Seasonal variation of flavonoid contents in the leaves of Cedrela sinensis. Journal of the Korean Society of Food Science and Nutrition 24: 578-581. 1995.
Prihantini AI, Tachibana S, Itoh K. Evaluation of antioxidant and α-glucosidase inhibitory activities of some subtropical plants. Pakistan Journal of Biological Sciences 17: 1106-1114. 2014.
Pyo YH, Lee TC, Logendra L, Rosen RT. Antioxidant activity and phenolic compounds of Swiss chard (Beta vulgaris subspecies cycla) extracts. Food Chemistry 85: 19-26. 2004.
Schmitzer V, Osterc G, Veberic R, Stampar F. Correlation between chromaticity values and major anthocyanins in seven Acer palmatum Thunb. cultivars. Scientia Horticulturae 119: 442-446. 2009.
Singleton VL, Rossi JA. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture 16: 144-158. 1965.
Webb DP, Agnihotri VP. Presence of a fungal inhibitor in the pericarps of Acer saccharum fruits. Canadian Journal of Botany 48: 2109-2116. 1970.
|
|
||||||||||||||||||||||||||||||||||||||||||